
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вивчення ізоелектричної точки білківСодержание книги
Поиск на нашем сайте
Для роботи необхідно: розчини: 0,01н. СН3СООН; 0,1 н. СН3СООН; 1 н. СН3СООН; 0,1 н. СН3СООNa; розчин казеїну в 0,1 н. CH3COOONa; індикатор метилоранж; піпетка, градуйована на 10 мл; штатив з пробір-
Білки, які складають основу протоплазми, мають ряд властивостей, що витікають з їх специфічної хімічної природи. Молекули білків являють собою довгі ланцюги типу полімерів, що складаються з багатьох амінокислот. Спрощену схему структури білкової молекули можна представити таким чином:
Зі схеми видно, що молекула білка поряд з вуглеводневим радикалом містить значну кількість полярних гідрофільних груп: –СООН; –NH2; =СО; =NH.
важає вплив аміногрупи, і кислотні, коли переважає вплив
карбоксильної групи У водних розчинах білки проявляють властивості слабих електролітів. В цьому випадку проходить дисоціація і основної, і кислотної групи. В кислому середовищі дисоціація карбоксильних груп понижується водневими йонами, які присутні в надлишку. При цьому білкова молекула заряджається позитивно. Наприклад, в присутності соляної кислоти про-
В лужному середовищі внаслідок надлишку іонів ОН– понижується дисоціація основної групи –NH2 і білкова молекула заряджається нега-
Отже, при певній концентрації водневих йонів (тобто при певному значенні рН середовища) кількість йонізованих основних груп і сумарний заряд частинки буде рівним нулю, тобто система буде знаходитись в ізоелектричному стані. Концентрація водневих йонів, виражена величиною водневого показника рН, при якій молекула білка знаходиться в ізоелек- Для кожного білка існує певне значення рН, при якому він знахо- Це пояснюється тим, що на поверхні білкової молекули переважають кислотні групи, константа дисоціації яких набагато більша від константи дисоціації основних груп. Так як в ізоелектричній точці по всій довжині молекули розташовується однакова кількість протилежно заряджених ос- При виконанні практичної частини роботи беруть штатив на 18 про- Згідно нижче приведеної таблиці в усі 18 пробірок за допомогою гра- Розчинність казеїну залежить від рН середовища і в ізоелектричному стані вона найменша. Це спостерігається в найбільшому помутнінні розчину. Отже, значення рН в пробірці, де помутніння розчину казеїну найбільше, відповідає ізоелектричній точці казеїну. Очевидно, перехід забарвлення метилоранжу від оранжевого до чер-
Другий ряд пробірок являється контрольним. Перехід забарвлення індикатора від основного до кислого середовища повинен лежати в межах ізоелектричної точки казеїну. Для метилоранжу цей перехід лежить в межах рН = 2,7 – 4,7. Через 5 – 10 хв. в ряді пробірок, які містять казеїн, зазначають ступінь помутніння. Відсутність помутніння позначають знаком “–”, його наяв- Результати роботи перевіряються керівником занять. Значення рН, що відповідає ізоелектричній точці казеїну записують.
НАБУХАННЯ ГЕЛІВ Для роботи необхідно: желатин; 0,1 н. розчин СН3СООН; 0,1 н. роз-
Поглинання рідини студнем або гелем, що супроводжується значним збільшенням його об’єму, називається набуханням. Процес набухання є характерною властивістю гелів у таких високомо- Характерною рисою високомолекулярних сполук являється асиметрія форми ниткоподібних макромолекул, що мають великі розміри ланцюгів. Властивість еластичного гелю зв’язана з пружністю ланцюгів макро- Процес набухання можна уявити як проникнення молекул низькомо- Так натуральний каучук у воді набухає, а потім переходить в розчин, утворюючи розчин високомолекулярної сполуки. У даному випадку прохо- Гелі желатини і агар-агару при звичайній температурі набухають у воді до певної межі і в розчин не переходять. Розширення ланцюгів прохо- Початкова стадія набухання характеризується значним виділенням тепла – теплотою набухання і тиском набухання. Сума об’ємів сухого гелю і поглиненої ним рідини більша, ніж об’єм набухлого гелю. Це явище носить назву контракції. Воно спостерігається, головним чином, у гелів, що набухають у воді (желатина, агар-агар, крохмаль) і пояснюється відносно більшою густиною орієнтованих молекул зв’язаної води. Набухання в органічних розчинниках проходить без помітної контракції. Кількість рідини, що поглинається одним грамом гелю, називається ступенем набухання. При необмеженому набуханні кількість рідини, що поглинається, може бути дуже великою і перевищувати десятикратний об’єм взятого для набухання гелю. Процес набухання проходить з певною швидкістю, зале- Велику групу, що мають ряд особливостей при набуханні, пред- При певній концентрації водневих йонів від макромолекули білка від- Крива залежності ступеня набухання від рН має мінімум в ізо-
Хід виконання роботи
Для виконання роботи в пробірках готують 6 буферних розчинів (див. табл. 1): В градуйовані пробірки насипають по 0,1×10–3кг сухого порошку желатини, точно відзначають об’єм сухої речовини в пробірках. Потім в кожну з пробірок вливають 5 мл одного з приготовлених розчинів з відповідним значенням рН. Через годину замірюють об’єм набухлої желатини. Ступінь набухання розраховують за формулою:
Таблиця 1
Дані експерименту записують у табл. 2. Таблиця 2
ХІ. БІОГЕННІ ЕЛЕМЕНТИ
S-Елементи та їх сполуки З s-елементів до біометалів відносяться натрій, калій, магній та каль-
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 663; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.195.180 (0.007 с.) |



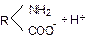 У зв’язку з цим білки мають високогідрофільні властивості. При-
У зв’язку з цим білки мають високогідрофільні властивості. При-

 .
.


