
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення теплоти розчинення і теплоти гідратації солі
Для роботи необхідно: калориметр; термометр; мішалка; пробірка для солі; дистильована вода; секундомір; сіль для розчинення; джерело струму; амперметр; вольтметр; електрообігрівач.
Мета роботи: 1. Визначення теплоємності калориметричної системи методом електро- 2. Визначення питомої теплоємності розчинення солі. 3. Визначення інтегральної теплоти розчинення, тобто теплового ефекту розчинення одного моля солі в такій кількості розчинника, коли Q буде постійним – Q інт. 4. Визначення теплоти гідратації солі – питомої і віднесеної до одного моля солі.
Тепловий ефект розчинення солі в великій кількості води дорівнює двом тепловим ефектам: зміні тепловмісту солі при руйнуванні криста-
В залежності від співвідношення величин відповідних ефектів, тепло- Визначивши теплоти розчинення солей, можна визначити і теплоту гідратації солі. Теплотою гідратації називають кількість тепла, яку сис-
Q Б. – тепловий ефект розчинення безводної солі; Q К. – тепловий ефект розчинення кристалогідрату з молекули води. Для визначення теплоти розчинення користуються калориметром з електрообігрівачем. При визначенні теплоємності системи виходять з того, що на систему подають певну кількість тепла електрообігрівом Qтеор. і відраховують зміну температури D t. Для проведення експерименту збирають прилад (калориметр). У склян-ку наливають 300 г дистильованої води (тобто 300 мл, враховуючи, що густина води при температурі досліду приблизно дорівнює 1). Склянку з мішалкою ставлять у калориметр і закривають кришкою. На кришці калориметру закріплена спіраль для обігріву. Зважують певну кількість солі (на технічних терезах), висипають її в суху пробірку і вставляють у калориметр через отвір на кришці, щоб сіль прийняла температуру калориметричної установки. (Сіль і наважка солі вказується керівником заняття). Коли калориметрична установка зібрана, починають налагод-
Налагоджений термометр вставляють у прилад і приступають до складання електричної схеми (рис. 1). Джерело струму включається тільки після перевірки електричної схеми керівником занять.
Після цього приступають до виконання експерименту. Переміщуючи рідину в калориметрі, включаючи секундомір, починають відлік темпе-ратури по термометру. Температура змінюється внаслідок теплообміну із зовнішнім середовищем. Відлік ведуть кожні півхвилини протягом Вмикання і вимикання струму проводять три рази і кожного разу записують покази приладів. Після третього вимикання струму, продов-
Дійсну температуру D tнар. знаходять як середнє арифметичне
D t розчинення визначають аналогічно. Якщо після нагрівання на шкалі термометра далі не можна заміряти зміну температури розчинення солі, то дослід після нагрівання зупиняють. Термометр налагоджують на відповідні поділки шкали і проводять цикл розчинення солі. Знаючи D t нагрівання, вираховують кількість тепла, яка одержана водою під час її нагрівання
де с – питома теплоємність води, яку приймають за одиницю; т – вага води, яка дорівнює її об’єму 300 мл. Підставляючи ці значення, одержимо
Ця кількість тепла менша за Qтеор., у зв’язку з поглинанням тепла системою. Qтеор. можна розрахувати, виходячи з закону Джоуля – Ленца.
Виміряючи силу струму І в амперах, напругу U – у вольтах, а час проходження струму t – в секундах, визначають кількість тепла в джоулях. Із розрахованої теоретичної кількості тепла віднімають кількість тепла, що одержана експериментально і різницю перераховують на 1 К. Це і буде кількість, яка поглинається всіма частинами калориметру – Ск. Розраховують її, виходячи з пропорції
Загальна теплоємність системи дорівнює
де Срід. – теплоємність калориметричної рідини, яка дорівнює:
С – питома теплоємність розчину, приблизно дорівнює одиниці. Масу розчину приймають рівною об’єму, тобто 300 мл. Тоді Срід можна прийняти рівною 1293,6 Дж, отже
Визначивши по графіку D t розч. і розрахувавши теплоємність калориметричної системи, знаходять тепловий ефект розчинення взятої наважки солі:
Тепловий ефект розчинення, віднесений до одного грама розчиненої речовини, дає питому теплоту розчинення:
де g – наважка солі в грамах. Молекулярна теплота розчинення дорівнює:
де М – молекулярна маса солі. Для визначення молекулярної теплоти гідратації знаходять моле-
Кристалогідрат розчиняють не в 0,3 кг води, а в кількості, меншій на величину, яка міститься в наважці кристалогідрату. Правильність результатів роботи перевіряється керівником занять. Результати досліду записуються у табл. 1 і 2: Таблиця 1
Таблиця 2
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 1067; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.171.136 (0.016 с.) |
 .
. ,
,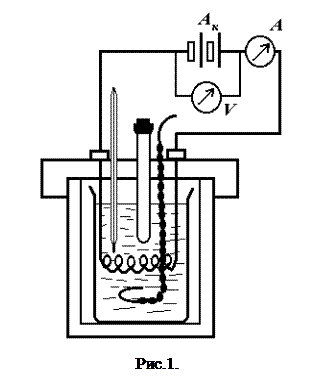 Для цього термометр ставлять похило, щоб нижній резервуар знахо-
Для цього термометр ставлять похило, щоб нижній резервуар знахо-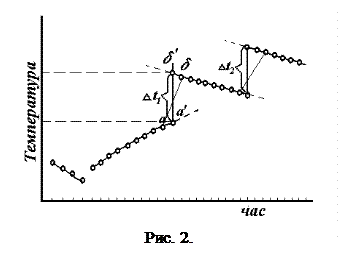 По осі абсцис відкладають час, по осі ординат – темпера-туру (тобто покази термометра). Прямі початкового і кінцевого періодів екстраполюють, тобто продовжують до середини діа-
По осі абсцис відкладають час, по осі ординат – темпера-туру (тобто покази термометра). Прямі початкового і кінцевого періодів екстраполюють, тобто продовжують до середини діа- .
. ,
, .
. (Дж).
(Дж). ,
,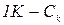 ,
, .
. .
. ,
, .
. .
. ,
, ,
, .
.


