
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення електропровідності електролітів і обчислення ступеня дисоціаціїСодержание книги
Поиск на нашем сайте
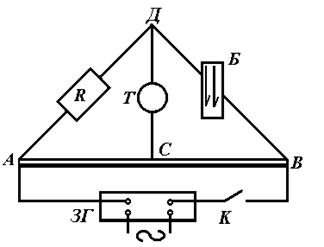
Для роботи необхідно: реохорд АВС; звуковий генератор ЗГ; на-
Так як електропровідність є величиною обернено пропорційною опо-
Рис. 1. Електрична схема для визначення електропровідності (мостик Кольрауша).
Від джерела струм поступає в А, розгалужується, іде по АВС і АДС. Переміщаючи контакт С по дротині АВ, можна знайти таке положення, при якому на відрізку ДС струму не буде. Це має місце, коли
звідки
При визначенні електропровідності користуються слабкими стру-
До нижніх кінців трубок впаяні плати-
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Роботу починають з приготування розчинів із відомою питомою електропровідністю і тих, питому електропровідність яких потрібно виз- З 1 н. розчину КСl або NaCl шляхом розведення готують розчини, вказані керівником занять. Не слід готувати всі розчини безпосередньо з Після того, як всі розчини приготовлені, складають електричну схему. Джерело струму не вмикають, поки схему не перевірить керівник занять або лаборант. Якщо схема працює, приступають до вимірювань величини опо- Одягнувши навушники, або по розгортці екрану осцилографа контакт ставлять приблизно посередині лінійки (0,25–0,30 м). Ввімкнувши струм, на магазині опору підбирають такий опір, при якому в навушниках звук буде мінімальним (точка на екрані). Рекомендується при підбиранні опору користуватися одним каскадом. При цьому слід пам’ятати, що чим більш розведений розчин, тим менша його загальна електропровідність, тобто більший опір. Отже, щоб компенсація була на середині лінійки, очевидно, на магазині необхідно брати більші опори. Із збільшенням концентрації опір, який підбирається на магазині, знижується. Досягнувши мінімуму звуку в навушниках, точнішу компенсацію здійснюють за допомогою пересувного контакту на реохорді. Не виливаючи розчину, міняють опір магазину на 10% у більшу і меншу сторону і визначають положення контакту для цих випадків, тобто для кожного розчину проводять три визначення для знаходження серед- Користуючись результатами досліду, можна розрахувати опір і елек- Питома електропровідність водних розчинів KCl та NaCl при 298 К наведена в табл. 1.
Таблиця 1
Опір розчинів або води розраховують, користуючись виразом:
Звідки
З середніх значень опорів розраховують їх середні електро-
Користуючись залежністю питомої електропровідності від загальної Згідно формулі Електропровідність води розраховують за формулами (1), (2). Якщо Тоді
Щоб скористатися формулою (3), необхідно знати значення питомої електропровідності c. Для цього загальну електропровідність визначають з досліду, а питому беруть з табличних даних. Для визначення ємності електропровідності (К) використовують три розчини KCl або NaCl. Концентрації їх вказує керівник занять. Питому електропровідність для цих розчинів беруть з таблиць. Знаючи константу посудини, можна розрахувати питому електропро-
Знаючи питому електропровідність, розраховують еквівалентну
де С – концентрація розчину виражена в моль×екв./л. Аналогічно визначають еквівалентну електропровідність при розве- Знаючи l¥ і l при даному розведенні, розраховують ступінь дисоціації
Користуючись законом розведення Оствальда можна розрахувати константу дисоціації слабкого електроліту, підставляючи (6)
Величина α слабких кислот та основ у не дуже розбавлених розчинах дуже мала, і нею в знаменнику (7) можна знехтувати, приймаючи
або
Це рівняння дає змогу вирахувати ступінь електролітичної дисоціації слабкого електроліту в розчині відомої концентрації, якщо відома константа Кдис. Вищевказані закономірності придатні для слабких електролітів. Однак при малих концентраціях вони придатні і для сильних.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 712; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.011 с.) |

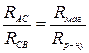 ,
,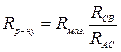 .
.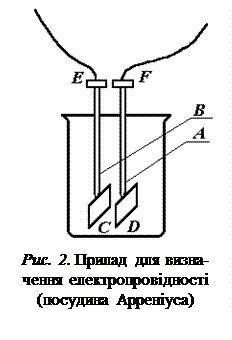 Прилад для визначення електропровід-ності зображений на рис. 2. Це скляна посу-
Прилад для визначення електропровід-ності зображений на рис. 2. Це скляна посу-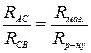 .
.
 .
.

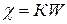 , де c – питома електропровідність, яку можна розрахувати, якщо відомий коефіцієнт пропорційності К, який є константою (ємністю опору) посудини, в якій проводяться вимірювання. Величина його залежить від площі електродів, відстані між ними, від форми посудини та інших факторів.
, де c – питома електропровідність, яку можна розрахувати, якщо відомий коефіцієнт пропорційності К, який є константою (ємністю опору) посудини, в якій проводяться вимірювання. Величина його залежить від площі електродів, відстані між ними, від форми посудини та інших факторів.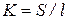 , де S – площа електроду, l – відстань між ни-
, де S – площа електроду, l – відстань між ни-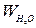 – величина дуже мала, порівняно з Wр-ну, то при розрахунках величини К нею нехтують.
– величина дуже мала, порівняно з Wр-ну, то при розрахунках величини К нею нехтують.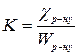 .
.
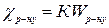 .
.
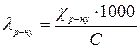 ,
,
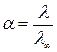 .
.
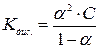 .
.
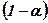 за 1. Тоді одержуємо:
за 1. Тоді одержуємо: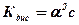
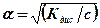 . (8)
. (8)


