
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення швидкості розкладу пероксиду водню газометричним методом
Для роботи необхідно: Установка (рис.1.), перексид водню, термостат.
Пероксид водню в водних розчинах повільно розкладається по рівнянню:
У присутності катіонів і аніонів деяких органічних речовин, а також ряду твердих речовин розклад перекису водню значно прискорюється. Тому ця реакція у водних розчинах може бути гомогенною або гетерогенною каталітичною реакцією в залежності від взятого каталізатору. За ходом реакції спостерігають по зміні об’єму кисню, що виділяється через різні проміжки часу від початку реакції.
ПОСЛІДОВНІСТЬ ВИКОНАННЯ РОБОТИ.
Після 30 хвилин термостатування в реакційну посудину налити певну кількість пероксиду водню. Розчин ретельно розмішати скляною паличкою і реакційну посудину закрити корком. Верхній кран на протязі 1-2 хв. тримати відкритим (для витіснення повітря, що виділяється киснем з реакційної посудини), потім його закрити, з’єднавши таким чином реакційну посудину з газовою бюреткою. Встановити одинакові рівні рідини в бюретці і зрівняльній склянці, провести перший вимір і записати рівень на бюретці і час. Кожна послідуюча зміна супроводжується таким записом, причому рівень рідини в бюретці і зрівняльній склянці підтримують одинаковим. Рівень рідини в бюретці записується через 2-5 хв. (чим вище температура, тим менший час між вимірами). Після того, як реакція практично припиниться, реакційну посудину помістити в киплячу водяну баню і витримати в ній до повного розкладу пероксиду водню (біля 30 хв.). Реакція вважається закінченою, якщо рівень газу в бюретці перестає змінюватись. При кип’ятінні на водяній бані зрівняльну склянку тримають у найбільш високому положенні. Після повного розкладу пероксиду водню реакційну посудину охолодити до температури термостату, витримати в ньому на протязі 25-30 хв. і при одинакових рівнях рідин у бюретці і в зрівняльній склянці заміряти рівень рідини в бюретці.
При обробці експериментальних даних за початок реакції приймати третій або четвертий вимір (тобто вимірювання в умовах режиму, що встановився). Визначають інтервал часу від початку реакції до кожного послідуючого вимірювання t і об’єми кисню, що виділився при проходженні цих інтервалів аt. По одержаних даних побудувати графіки залежності: 1.Рівності об’ємів кисню від часу (час у хвилинах).
2.Тобто 3.Логарифму швидкості реакції через різні проміжки часу від логарифму різниці об’ємів кисню, що виділився Далі проводять обрахунок величини константи швидкості реакції за рівнянням
де а¥ - об’єм кисню, що виділився після розкладу пероксиду водню (визначається як різниця рівней у бюретці в момент, прийнятий за початок реакції, і після кипіня Н2О2 до повного розкладу). Результати представити у вигляді 4-х графіків і таблиці. Температура досліду___________ Каталізатор___________________ Кількість перекису водню_______
6. ФОТОХІМІЧНИЙ РОЗКЛАД Н2О2 Для роботи необхідно: установка (рис.1), перексид водню.
Фотохімічний розклад Н2О2 являється типовим ланцюговим процесом, механізм якого можна представити таким чином:
Виділення кисню відбувається в результаті реакції
Ця реакція відноситься до ланцюгових реакцій з „виродженими розгалуженнями”. В даному процесі розгалуження здійснюється фотохімічно за рахунок підводу енергії ззовні. Відносно стійким проміжним продуктом являється вільний радикал ОН-. Кінетика цієї реакції виражається рівнянням: φ - константа наростання, що характеризує швидкість розгалуження; τ – час. Логарифмування його дає Перед початком роботи необхідно по термодинамічним функціям розрахувати теплові ефекти елементарних стадій реакції та оцінити принципову можливість їх здійснення. Робота проводиться на установці, схема якої приведена на рис.1.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 562; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.255.134 (0.005 с.) |
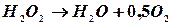 .
.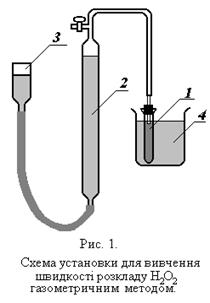 Реакційну посудину 1 наповнити розчином каталізатору таким чином, щоб висота повітряного простору між рівнем рідини і корком не перебільшувала 2 см і помістити його в термостат 4 при певній заданій температурі. Зрівнювальну склянку 3 і бюретку 2 наповнити водою. Рівень води в бюретці встановити на рівні верхнього крану.
Реакційну посудину 1 наповнити розчином каталізатору таким чином, щоб висота повітряного простору між рівнем рідини і корком не перебільшувала 2 см і помістити його в термостат 4 при певній заданій температурі. Зрівнювальну склянку 3 і бюретку 2 наповнити водою. Рівень води в бюретці встановити на рівні верхнього крану.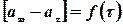 .
.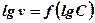 , по якому знаходять порядок реакції.
, по якому знаходять порядок реакції. .
. ,
,



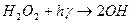 - реакція зародження ланцюга;
- реакція зародження ланцюга;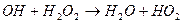 - цикл регенерації;
- цикл регенерації;
 - реакція розгалуження;
- реакція розгалуження; - реакція обриву ланцюга.
- реакція обриву ланцюга.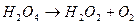
 , де
, де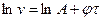 . Це рівняння прямої в системі координат
. Це рівняння прямої в системі координат  .
.


