
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тепловий ефект хімічної реакції. Екзотермічні і ендотермічні реакції. Термохімічні рівнянняСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Вам відомі реакції, які відбуваються з виділенням значної кількості теплоти. Це - реакції горіння:
Теплота виділяється не лише при горінні речовин. При змішуванні в пробірці розчинів лугу і сильної кислоти, відбувається виділення теплоти, що є наслідком реакції нейтралізації:
Аналогічний ефект спостерігається при гасінні вапна Існують реакції, за яких теплота поглинається. Серед них - реакції розкладання багатьох сполук (оксидів, гідроксидів, оксигенномістких солей): 2 CuO → 2 Cu + O2 Fe(OH)2 → FeO + H2O 2 KMnO4 → K2MnO4 + MnO2 + O2 Для того, щоб такі реакції відбувалися, речовини нагрівають. Якщо нагрівання припинити, то припиняється і хімічне перетворення. Реакції, що протікають з виділенням теплоти, називають екзотермічними, а що протікають з поглинанням теплоти - ендотермічними. Тепловий ефект реакції Виділення або поглинання теплоти при хімічній реакції називають тепловим ефектом реакції. З'ясуємо причину його виникнення. Кожна речовина володіє внутрішньою енергією (її позначають латинською літерою Уявимо собі, що в разі деякої реакції загальна внутрішня енергія реагентів більше внутрішньої енергії продуктів:
Тоді в результаті реакції речовини «віддають» частину своєї енергії; відбувається виділення теплоти. Отже, дана реакція є екзотермічною. Зменшення внутрішньої енергії речовин виразимо математично, використавши спеціальний знак
Якщо загальна внутрішня енергія реагентів менше внутрішньої енергії продуктів
то в результаті реакції речовини «споживають» енергію і теплота поглинається. Така реакція є ендотермічною:
У разі потреби тепловий ефект вказують разом з хімічним рівнянням:
Явище виділення (поглинання) теплоти при хімічній реакції узгоджується з принципом збереження енергії: енергія не виникає ні з чого, не зникає безслідно, а лише перетворюється з одного виду в іншій. Термохімічне рівняння Хімічне рівняння із записом числового значення теплового ефекту реакції називають термохімічним рівнянням.
Приклади термохімічних рівнянь:
Перше рівняння свідчить про те, що при розкладанні 1 моль сульфатної кислоти з утворенням 1 моль сульфур(VI) оксиду і 1 моль води поглинається 177 кДж теплоти.
Термохімічні розрахунки Розглянемо, як розв'язують завдання на складання і використання термохімічних рівнянь. ЗАВДАННЯ 1. При згоранні 0,5 моль фосфору в надлишку кисню виділилося 373 кДж теплоти. Скласти термохімічне рівняння.
ЗАВДАННЯ 2. Виходячи з термохімічного рівняння
Вправа. Які з реакцій є екзотермічними:
Вправа. Які з реакцій є ендотермічними:
Вправа. При сполученні 4,2г заліза з сіркою утворився ферум (ІІ) сульфід FeS і виділилася теплота, рівна 7,15 кДж. Складіть термохімічне рівняння реакції Вправа. Термохімічне рівняння реакції розкладу вапняку: Швидкість хімічної реакції, залежність швидкості реакції від різних Чинників. Вам відомо, що деякі хімічні реакції, наприклад горіння водню в хлорі, протікають дуже швидко; інші ж, наприклад, корозія заліза, - повільно. Для підвищення продуктивності хімічних виробництв необхідно створити умови, які сприяють прискоренню хімічних процесів. Чим швидше протікатиме та або інша хімічна реакція, тим більше в одиницю часу утворюється необхідного продукту. Деякі хімічні реакції завдають шкоди (іржа заліза, псування харчових продуктів). Швидкість таких небажаних реакцій необхідно уповільнити. Швидкість реакції повинна визначатися зміною концентрації речовини, що прореагувала або утворюється, в одиницю часу. Концентрація речовини часто визначається числом молів в літрі.
Припустимо, що початкова концентрація сульфур (IV) оксиду в реакції окислення його до сульфур (VI) оксиду була 2 моль/л, а через 50 с стала 0,5 моль/л. В цьому випадку швидкість даної реакції дорівнює:
Це означає, що в кожну секунду в 1 л газової суміші 0,03 моль сульфур (IV) оксиду перетворюється на сульфур (VI) оксид. Якщо первинну концентрацію речовини позначити vp = (C1 – C2) / (t2 – t1), або vp = ∆C / ∆t.
|
||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 995; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.150.195 (0.008 с.) |




 ). Ця енергія складається з енергій всіх його часток (атомів, молекул, іонів) і енергій хімічних зв'язків між ними. Внутрішню енергію речовин виміряти неможливо.
). Ця енергія складається з енергій всіх його часток (атомів, молекул, іонів) і енергій хімічних зв'язків між ними. Внутрішню енергію речовин виміряти неможливо.
 (читається «дельта-аш»):
(читається «дельта-аш»):


 (екзотермічна реакція)
(екзотермічна реакція) (ендотермічна реакція)
(ендотермічна реакція)
 2. Розраховуємо тепловий ефект реакції.
При згоранні 0,5 моль фосфору виділяється 373 кДж теплоти, а при згоранні 4 моль фосфору виділяється
2. Розраховуємо тепловий ефект реакції.
При згоранні 0,5 моль фосфору виділяється 373 кДж теплоти, а при згоранні 4 моль фосфору виділяється 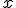 кДж теплоти;
3. Записуємо термохімічне рівняння:
кДж теплоти;
3. Записуємо термохімічне рівняння:
 Відповідь:
Відповідь: , визначити, яка кількість теплоти виділяється при згоранні 5,6л метану (н.у.).
, визначити, яка кількість теплоти виділяється при згоранні 5,6л метану (н.у.).
 Знайти:
Знайти:

 2. Обчислюємо кількість теплоти
При згоранні 1 моль метану виділяється 802 кДж теплоти,
а при згоранні 0,25 моль метану виділяється
2. Обчислюємо кількість теплоти
При згоранні 1 моль метану виділяється 802 кДж теплоти,
а при згоранні 0,25 моль метану виділяється 
 Скільки теплоти витрачається на розклад 1кг вапняку?
Скільки теплоти витрачається на розклад 1кг вапняку?
 , а через деякий час
, а через деякий час  -
-  , то швидкість реакції в загальному вигляді можна виразити так:
, то швидкість реакції в загальному вигляді можна виразити так:


