
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакція з розчином купрум (ІІ) сульфату.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте 4.6.1. Хід роботи: в пробірку помістити 2 краплі розчину метиламіну, добавити 2 краплі купрум (ІІ) сульфату – випадає голубий осад. До реакційної суміші добавити по краплях надлишок розчину аміну. Осад розчиняється, розчин набуває інтенсивного фіолетового забарвлення. 4.6.2. Спостереження: випадає голубий осад, потім осад розчиняється, розчин забарвлюється в фіолетовий колір. 4.6.3. Хімізм реакцій: 2[СН3NH3]ОН + СuSO4→ [СН3NH3 ]2 SO4 + Сu(ОН)2 4.6.4. Висновок: метиламін осаджує купрум (ІІ) гідроксид.
Реакція з розчином ферум (ІIІ) хлориду. 4.7.1. Хід роботи: в пробірку ввести 2-3 краплі розчину метиламіну і добавити декілька крапель розчину ферум (ІІІ)хлориду. 4.7.2. Спостереження: випадає осад Fe(OH)3. 4.7.3.Хімізм реакцій: 3[CH3NH3]OH + FeCl3 → 3[CH3NH3]Cl + Fe(OH)3↓ 4.7.4. Висновок: аміни є органічними основами.
Реакція газоподібного метиламіну з концентрованою хлоридною кислотою. 4.8.1. Хід роботи: до отвору газовідвідної трубки приладу для отримання метиламіну підносимо скляну паличку змочену концентрованою хлоридною кислотою. 4.8.2. Спостереження: утворюється білий осад. 4.8.3. Хімізм реакцій: СН3NH2 + HCl → [CH3NH3]Cl↓ 4.8.4. Висновок: аміни як похідні аміаку проявляють основні властивості.
Розчинність аніліну у воді. 4.9.1. Хід роботи: в пробірку поміщаємо 5 крапель води, 1 краплю аніліну і енергійно збовтуємо. 4.9.2. Спостереження: анілін погано розчиняється у воді. 4.9.3. Хімізм реакцій: 4.9.4. Висновок: Aнілін погано розчиняється у воді.
Утворення солі аніліну. 4.10.1. Хід роботи: до розчину з попереднього досліду додаємо по краплях концентровану хлоридну кислоту. 4.10.2. Спостереження: утворився прозорий розчин.
4.10.4. Висновок: анілін утворює солі тільки з сильними мінеральними кислотами.
Кольорова реакція аніліну з хлоридним вапном. 4.11.1. Хід роботи: до 1 мл розчину хлориднокислого аніліну добавляємо 1 краплю хлоридного вапна. 4.11.2. Спостереження: з ’являється темно-зелене забарвлення. 4.11.3. Хімізм реакцій: 4.11.4. Висновок: анілін легко окислюється.
Бромування аніліну. 4.12.1. Хід роботи: в пробірку поміщаємо 3 краплі бромної води і 1 краплю анілінової води. 4.12.2. Спостереження: випадає білий осад. 4.12.3. Хімізм реакцій:
+ 3Br2 → + 3НВr
Br 4.12.4. Висновок: бромування аніліну проходить легко.
Діазотування сульфанілової кислоти. 4.13.1. Хід роботи: в першу пробірку поміщаємо на кінці мікролопатки сульфанілову кислоту, 4 краплі розчину їдкого натру і легенько нагріваємо, потім приливаємо 0,5н розчин натрію нітриту. В другу пробірку поміщаємо кусочок льоду, обережно доливаємо 2 краплі сульфатної кислоти і виливаємо в першу пробірку. Залишити на наступний дослід. 4.13.2. Спостереження: випадає білий осад діазобензолсульфо кислоти.
НО3S – – NH2 + NaOH → NaO3S – – NH2 + H2O
4.13.4. Висновок: діазотувати можна будь яку ароматичну сполуку, що містить первинну аміногрупу в ароматичному ядрі. Одержання геліантину. 4.14.1. Хід роботи: в першій пробірці знаходиться розчин діазосульфанілової кислоти з попереднього досліду. В другій пробірці змішують 3 краплі диметиланіліну і 5 крапель льодяної оцтової кислоти до одержання однорідного розчину. До розчину додають шматочок льоду і при помішуванні додають суміш діазобензенсульфокислоти (з попереднього досліду). потім додають декілька крапель розчин їдкого натру до лужної реакції на лакмус. Виділяється оранжевий осад натрієвої солі геліантину (метилоранжу). 4.14.2. Спостереження: виділяється оранжевий осад. 4.14.3. Хімізм реакцій:
NH2 NH2 N2 N(CH3)2 N = N
N(CH)3 Властивості геліантину. 4.15.1. Хід роботи: у пробірку поміщають 2 краплі геліантину і 10 крапель води. Вміст пробірки ретельно перемішують і ділять на 2 пробірки: в одну додають 2 краплі кислоти, в другу - 2 краплі лугу. 4.15.2. Спостереження: в пробірці з кислотою з’являється червоний колір, а в пробірці з лугом – жовтий. 4.15.3. Хімізм реакцій:
[ NaSO3 NH – N = = N(CH3)2]+ Cl- 4.15.4. Висновок: геліантин – добрий індикатор.
КОНТРОЛЬНІ ЗАПИТАННЯ: 1. Навести приклади різних нітросполук. 2. З бензену добути пікринову кислоту, м- нітробензойну кислоту. 3. Порівняйте умови нітрування бензену, толуену і бензенсульфокислоти. 4. При відновленні 61,5 г нітробензену одержано 44 г аніліну. Розрахувати вихід аніліну у % до теоретично можливого виходу. 5. Навести приклади реакцій амінування, умови проведення. 6. Здійснити синтези: а) з СН2 = СН2 à анілін б) з СН2 =СН2 à сульфанілову кислоту в) з С6Н6 à 2,4,6–триброманілін. 8. Який об’єм аніліну (ρ = 1,02 г/см3) можна одержати із нітробензену масою 9,2 г. 9. Яку масу нітробензену треба взяти, щоб відновленням одержати анілін масою 186 г, вихід якого складає 92% від теоретичного. 10. Опишіть хімічні властивості діазосполук на прикладі о-толілдіазоній хлориду. 11.З бензену добудьте: а) о-нітробензендіазоний хлорид; б) м-нітробензендіазоній гідроксид; в).метилоранж. ЛІТЕРАТУРА: А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980. Досліди 136, 137, 62. А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980.Досліди 139, 140 (1,3,4,5), 142, 143, 144 (2), 145. А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980. Гл.10, Досліди 153, 155.
ЛАБОРАТОРНА РОБОТА № 9. 1.ТЕМА: Вуглеводи (Моносахариди). 2. МЕТА: Вивчити властивості цукрів. 3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1. Глюкоза 0,5 % р-н, сахароза 0,5 % р-н. 3.2. Їдкий натр 2н і концентрований р-ни, СuSO4 2н р-н; 3.3. Купрум (ІІ) сахарату 0,2н р-н, хлорид на кислота концентрований і 2н р-ни; 3.4. Реактив Фелінга, Ag NO3 0,2 н р-н, аміак 0,2 н р-н. 3.5. Лакмус, лактоза 1% р-н.
ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ.
4.1Окислення глюкози реактивом Фелінга. 4.1.1 Хід роботи: у пробірку вводять 3 краплі розчину глюкози і 1 краплю реактиву Фелінга (лужний розчин мідного алкоголяту сегнетової солі). Тримаючи пробірку під кутом, уважно нагрівають верхню частину розчину. 4.1.2. Спостереження: з’являється синє забарвлення 4.1.3. Хімізм реакцій: 4.1.4. Висновок: це є якісною реакцією на глюкозу.
4.2. Окислення глюкози амоніачним розчином арґентум оксиду (реакція срібного дзеркала). 4.2.1. Хід роботи: в пробірку поміщають 1 краплю розчину нітрату срібла, 2 краплі розчину їдкого натрію і доливають по краплях розчин амоніаку до розчинення утвореного осаду арґентум гідроксиду. Потім добавляють 1 краплю розчину глюкози і легко підігрівають склад пробірки над полум’ям пальника до початку почорніння розчину. Далі реакція проходить без нагрівання. 4.2.2. Спостереження: утворюється осад.
4.2.3. Хімізм реакцій:
Н – ОН Н – ОН OH – Н [O] НО – Н
Н – ОН Н – ОН СН2ОНСН2ОН 4.2.4. Висновок: відбулось окислення глюкози арґентум оксидом в лужному середовищі. Пройшла якісна реакція. Окислення глюкози лугом. 4.3.1.Хід роботи: в пробірку поміщають 4 краплі розчину глюкози і добавляють 2 краплі розчину їдкого натру. Нагрівають суміш до кипіння і кип’ятять 2-3 хв. 4.3.2. Спостереження: розчин жовтіє, а потім коричневіє. 4.3.3. Хімізм реакцій: 4.3.4. Висновок: Пройшла якісна реакція
4.4.Доведення наявності гідроксильних груп в сахарозі. Відсутність відновлюючої здатності у сахарози. 4.4.1. Хід роботи: в пробірку поміщають 1 краплю сахарози, 5 крапель розчину лугу, 4 краплі води і 1 краплю сульфату міді. З’являється синє забарвлення сахарату міді. Розчин сахарату міді нагрівають до кипіння (нагрівають тільки верхню частину).Сахароза в цих умовах не окислюється, що вказує на відсутність в її молекулі альдегідної групи. 4.4.2. Спостереження: з’являється синє забарвлення купром (ІІ) сахарату. 4.4.3. Хімізм реакцій: 4.4.4. Висновок: сахароза в цих умовах не окислюється.
|
||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 638; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |

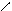
 NH2 NH3
NH2 NH3
 4.10.3. Хімізм реакцій: + НСl → [ ]+ Cl-
4.10.3. Хімізм реакцій: + НСl → [ ]+ Cl- NH2 NH2
NH2 NH2


 Br Br
Br Br


 4.13.3. Хімізм реакцій:
4.13.3. Хімізм реакцій:
 NaО3S – – NH2 + NaNO2 + H2SO4 → O3S – – N2 + Na2SO4 + 2H2O
NaО3S – – NH2 + NaNO2 + H2SO4 → O3S – – N2 + Na2SO4 + 2H2O





 + NaОН → + →
+ NaОН → + →

 -Н2О -Nа2SO4 – 2H2O
-Н2О -Nа2SO4 – 2H2O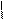


 4.14.4. Висновок: ми одержали геліантин.
4.14.4. Висновок: ми одержали геліантин.


 NaSO3 N = N N(CH3)2 + HCl →
NaSO3 N = N N(CH3)2 + HCl →
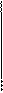 СНО СООН
СНО СООН Н – ОН Н – ОН
Н – ОН Н – ОН


