
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кінетика хімічних реакцій у розчинахСодержание книги
Поиск на нашем сайте Миттєва або істинна швидкість хімічної реакції за окремим компонентом за умови сталого об’єму системи визначається як зміна концентрації будь-якого учасника реакції i у певний нескінченно малий проміжок часу, тобто як похідна концентрації цього компоненту по часу:
Швидкість реакції завжди додатна. Якщо її визначають за продуктом реакції Згідно із законом діючих мас, швидкість гомогенної реакції пропорційна добутку концентрацій речовин, які вступають до реакції, з певними показниками степенів. Вираз, що описує залежність швидкості реакції від концентрацій реагентів, називається кінетичним рівнянням реакції. Якщо деяка реакція
де Якщо реакція, загальний вигляд якої наведено вище, є складною, тобто багатостадійною, то кінетичне рівняння набуває вигляду:
У даному випадку показники степенів, до яких піднесені концентрації вихідних речовин, зазвичай не збігаються зі стехіометричними коефіцієнтами. Загальний порядок реакції Молекулярність є характеристикою простої реакції або окремої стадії складного хімічного процесу. Вона визначається числом частинок, що беруть участь у елементарному акті хімічної взаємодії. Існують моно-, бі- та (рідко) тримолекулярні реакції. Молекулярність не може бути більшою за три, оскільки одночасне зіткнення чотирьох та більше частинок є вкрай малоймовірним. Для простої реакції порядок та молекулярність збігаються тоді, коли реагенти взято у стехіометричному співвідношенні. Якщо ж один з них міститься у надлишку, то молекулярність реакції не змінюється, а загальний порядок зменшується на величину частинного порядку за компонентом з надлишковою концентрацією. Якщо складна реакція перебігає через ряд послідовних стадій, то її швидкість визначається швидкістю найповільнішої стадії, яку називають лімітуючою. Константи швидкості реакцій різних порядків обчислюють за рівняннями:
де Порядок реакції за певним компонентом (частинний порядок) визначають на основі експериментальних даних про зміну концентрації цієї речовини з часом. Досліджуючи частинний порядок реакції за певним компонентом, всі інші реагенти беруть у надлишку. Внаслідок цього їх концентрації в ході досліду практично не змінюються і можуть бути включені до величини константи швидкості реакції. Таким чином, надлишок одного або декількох реагентів призводить до зменшення загального порядку реакції на суму частинних порядків за тими речовинами, концентрації яких є надлишковими. Методи визначення частинних порядків поділяють на інтегральні та диференціальні. В інтегральних методах порядок визначають на основі експериментальних залежностей концентрацій речовин або інших, пропорційних концентраціям властивостей, від часу. В диференціальних методах застосовують залежності миттєвої швидкості за компонентом від його концентрації. Для визначення частинного порядку реакції, наприклад, на основі методу підстановки, який належить до інтегральних, експериментальні дані послідовно підставляють у рівняння (1.4) – (1.7). Співвідношення, що дає приблизно однакові константи швидкості, які відрізняються у межах похибки досліду, вказує на порядок реакції за певним компонентом. Часом напівперетворення Внаслідок підвищення температури швидкість переважної більшості реакцій зростає. Згідно з правилом Вант-Гоффа внаслідок збільшення температури на 10 градусів швидкість гомогенної реакції зростає приблизно у 2 – 4 рази. Температурний коефіцієнт швидкості реакції визначають як:
де Якщо відомо константи швидкості для будь-яких двох температур, то
Температурний коефіцієнт Значно краще залежності швидкості та константи швидкості реакції від температури описує рівняння Арреніуса, диференціальна форма якого має вигляд:
а інтегральна за умови
В рівняннях (1.10) та (1.11)
Інтегральну форму рівняння Арреніуса (1.10) за умови
де
Для більшості гомогенних реакцій енергія активації лежить у межах 50 – 200 кДж/моль.
|
||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 626; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

 . (1.1)
. (1.1) , то в рівнянні (1.1) ставлять знак
, то в рівнянні (1.1) ставлять знак  , якщо за вихідною речовиною
, якщо за вихідною речовиною  – знак "–".
– знак "–". є простою (елементарною), тобто перебігає в одну стадію, то кінетичне рівняння має вигляд:
є простою (елементарною), тобто перебігає в одну стадію, то кінетичне рівняння має вигляд: , (1.2)
, (1.2) – константа швидкості реакції, яка чисельно дорівнює швидкості процесу за умови одиничних концентрацій реагентів; a і b – частинні порядки за компонентами А та В, відповідно. Для простої реакції частинні порядки мають такі самі значення, що й стехіометричні коефіцієнти реагентів у рівнянні реакції.
– константа швидкості реакції, яка чисельно дорівнює швидкості процесу за умови одиничних концентрацій реагентів; a і b – частинні порядки за компонентами А та В, відповідно. Для простої реакції частинні порядки мають такі самі значення, що й стехіометричні коефіцієнти реагентів у рівнянні реакції. . (1.3)
. (1.3) – це сума частинних порядків, а саме: для рівняння (1.2)
– це сума частинних порядків, а саме: для рівняння (1.2)  , а для виразу (1.3)
, а для виразу (1.3)  . Порядок реакції може бути цілим, дробовим та нульовим. Частинні порядки іноді набувають навіть від’ємних значень. Порядок реакції не залежить від часу, концентрацій реагентів (якщо немає значного надлишку одного або декількох з них) та температури. Він є формальною ознакою, яка визначає ступінь залежності швидкості реакції від концентрацій учасників процесу.
. Порядок реакції може бути цілим, дробовим та нульовим. Частинні порядки іноді набувають навіть від’ємних значень. Порядок реакції не залежить від часу, концентрацій реагентів (якщо немає значного надлишку одного або декількох з них) та температури. Він є формальною ознакою, яка визначає ступінь залежності швидкості реакції від концентрацій учасників процесу.
 ; (1.4)
; (1.4)
 ; (1.5)
; (1.5)
 ; (1.6)
; (1.6)
 , (1.7)
, (1.7) - початкова концентрація вихідної речовини; х - зменшення концентрації вихідної речовини за час
- початкова концентрація вихідної речовини; х - зменшення концентрації вихідної речовини за час 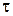 ;
;  - поточна концентрація вихідної речовини, яка відповідає часу
- поточна концентрація вихідної речовини, яка відповідає часу  називається час, за який концентрація вихідної речовини зменшується удвічі.
називається час, за який концентрація вихідної речовини зменшується удвічі.
 , (1.8)
, (1.8) ,
,  ,
, 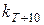 ,
,  - відповідно швидкості та константи швидкості за температур, які відрізняються на 10 К. У рівнянні (1.8) відношення швидкостей реакції дорівнює відношенню її констант швидкостей, оскільки концентрації реагентів в результаті збільшення температури на 10 градусів майже не змінюються. Зазвичай у температурні залежності швидкості реакції замість неї підставляють саме константу швидкості, оскільки вона, на відміну від швидкості, не залежить від часу та концентрацій.
- відповідно швидкості та константи швидкості за температур, які відрізняються на 10 К. У рівнянні (1.8) відношення швидкостей реакції дорівнює відношенню її констант швидкостей, оскільки концентрації реагентів в результаті збільшення температури на 10 градусів майже не змінюються. Зазвичай у температурні залежності швидкості реакції замість неї підставляють саме константу швидкості, оскільки вона, на відміну від швидкості, не залежить від часу та концентрацій. . (1.9)
. (1.9)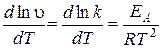 , (1.10)
, (1.10) :
: . (1.11)
. (1.11) – енергія активації реакції, тобто та мінімальна енергія, яку потрібно надати 1 молю вихідних речовин, щоб вони мали змогу перетворитись у продукти.
– енергія активації реакції, тобто та мінімальна енергія, яку потрібно надати 1 молю вихідних речовин, щоб вони мали змогу перетворитись у продукти.  .
. можна записати також у вигляді:
можна записати також у вигляді: , (1.12)
, (1.12) – стала інтегрування. З виразу (1.12) випливає, що
– стала інтегрування. З виразу (1.12) випливає, що  є лінійною функцією від
є лінійною функцією від  . Тангенс кута нахилу цієї прямої та енергія активації пов’язані залежністю
. Тангенс кута нахилу цієї прямої та енергія активації пов’язані залежністю . (1.13)
. (1.13)


