
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Робота 6.3. Електрохімічний синтез перманганату.Содержание книги
Поиск на нашем сайте
Мета роботи: одержати електролізом перманганат-іон у водному розчині та визначити його вихід за струмом. Промисловий електрохімічний синтез перманганату полягає в анодному розчиненні мангану в лужному розчині. Зазвичай як анод використовують не чистий марганець, а його сплав із залізом, вуглецем та силіцієм – так званий фероманган. Катод повинен бути зроблений з інертного в лужному середовищі металу, наприклад, з нікелю або зі сталі. На аноді при електролізі одночасно перебігають два процеси: основний – та побічний – Внаслідок наявності побічного анодного процесу вихід за струмом перманганат-іону не може бути 100 % – вим. На катоді також відбуваються два паралельні процеси: виділення водню з води і відновлення утвореного на аноді іона
Зазначений вторинний процес перетворення перманганат-іона на катоді також призводить до суттєвого зниження виходу за струмом. Отже, очікуваний Перед роботою анод зачищають наждаковим папером до появи металічного блиску і промивають дистильованою водою. У склянку, що слугує електролізером, мірним циліндром наливають 100 – 200 см3 (за вказівкою викладача) 20 % – вого водного розчину Na2СО3 і занурюють в нього електроди. Електролізер послідовно з’єднують з амперметром і підключають до джерела постійного струму. Встановлюють зазначену викладачем силу струму і вмикають секундомір. Електроліз проводять протягом 40 – 60 хвилин. Концентрацію утвореного в розчині перманганату визначають титруванням. Для цього відбирають піпеткою 25 см3 проби і виливають до конічної колби, доливають сірчану кислоту для нейтралізації соди та створення кислого середовища (після закінчення виділення газу з розчину додають деякий надлишок розчину кислоти), нагрівають приблизно до температури 50 – 60 о С і титрують 0,1 – нормальним розчином оксалатної (щавлевої) кислоти до знебарвлення. За даними титрування розраховують концентрацію моль-еквівалентів
де
оксалатною кислотою ступінь окислення мангану зменшується від +7 до +2, тобто в процесі відновлення беруть участь 5 електронів). За кількістю пропущеної через розчин електрики розраховують на основі (6.2) теоретичну масу перманганат-іона, виходячи з того, що внаслідок анодного розчинення мангану молярна маса еквіваленту
оскільки в основному процесі на аноді беруть участь 7 електронів. За рівнянням (6.4) обчислюють вихід за струмом. Звіт 1. Дані експерименту: об’єм розчину Na2СО3 сила струму тривалість електролізу 2. Результати титрування: об’єм проби об’єм титранту концентрація 3. Обчислення практичної маси перманганат-іона: 4. Розрахунок теоретичної маси перманганат-іона: 5. Розрахунок виходу за струмом: 6. Висновок. ЛІТЕРАТУРА: [1, с. 513 – 516; 2, с. 405 – 409; 3, с. 433 – 436; 5, с. 357 – 360; 6, с. 199 – 205; 7, с. 143 – 147; 8, с. 56]. Перелік рекомендованої літератури 1. Физическая химия / Под ред. К.С. Краснова. – М.: Высш. шк., 1982. – 688 с. 2. Стромберг А.Г., Семченко Д.П. Физическая химия. – М.: Высш. шк., 1988, 2001. – 496 с. 3. Лебідь В.І. Фізична хімія. – Харків: Фоліо, 2005. – 480 с. 4. Практикум по физической химии / Под ред. С.В. Горбачева. – М.: Высш. шк., 1974. – 496 с. 5. Практикум по физической химии / Под ред. Н.К. Воробьева. – М.: Химия, 1975. – 368 с. 6. Практические работы по физической химии / Под ред. К.П. Мищенко, А.А. Равделя, А.М. Пономаревой. – Л.: Химия, 1982. – 400 с. 7. Краткий справочник физико-химических величин / Под ред. А.А. Равделя, А.М. Пономаревой. – Л.: Химия, 1983, 1999. – 232 с. 8. Фізична хімія: Методичні вказівки для самостійної роботи студентів напряму підготовки 6.051301 «Хімічна технологія» усіх форм навчання / Уклад.: Г.А. Рудницька, Т.А. Каменська, Т.В. Кірсенко, І.О. Ренський. – К.: НТУУ «КПІ», 2010. – 60 c. Зміст Вступ 3 1. Кінетика хімічних реакцій у розчинах 5 Робота 1.1. Дослідження кінетики розкладу пероксиду водню у водному розчині за сталої температури 10 Робота 1.2. Дослідження впливу температури на швидкість процесу розкладу пероксиду водню у водному розчині 14 Робота 1.3. Дослідження кінетики реакції окиснення йодиду калію персульфатом калію 16 Робота 1.4. Дослідження кінетики реакції окиснення йодиду калію персульфатом калію 19 2. Кінетика гетерогенних процесів 20 Робота 2.1. Дослідження кінетики розчинення твердої кислоти у воді 24 Робота 2.2. Дослідження кінетики реакції нейтралізації між твердою кислотою та розчином лугу 27 3. Електропровідність розчинів електролітів 30 Робота 3.1. Визначення константи електролітичної комірки 34 Робота 3.2. Дослідження електропровідності розчинів сильних та слабких електролітів 36 Робота 3.3. Визначення константи дисоціації слабкого електроліту 37 Робота 3.4. Кондуктометричне титрування 38 4. Електрорушійні сили 42 Робота 4.1. Визначення ЕРС хімічних гальванічних елементів та електродних потенціалів 47 Робота 4.2. Визначення ЕРС концентраційного гальванічного елементу 50 Робота 4.3. Визначення добутку розчинності галогеніду арґентуму у водному розчині 51 Робота 4.4. Потенціометричне титрування 53 5. Потенціометричне визначення Робота 5.1. Калібрування Робота 5.2. Вимірювання 6. Електроліз 63 Робота 6.1. Електролітичне одержання міді 66 Робота 6.2. Електроліз води 67 Робота 6.3. Електрохімічний синтез перманганату 71 Перелік рекомендованої літератури 74
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 345; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.73.6 (0.006 с.) |


 .
.
 за реакцією
за реакцією .
. у цьому випадку буде меншим, ніж 100 %.
у цьому випадку буде меншим, ніж 100 %.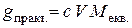 ,
, – нормальність розчину перманганату;
– нормальність розчину перманганату; 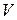 – загальний об’єм розчину;
– загальний об’єм розчину; – молярна маса еквіваленту
– молярна маса еквіваленту  ,
, см3;
см3; А;
А; год.
год.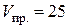 см3;
см3; см3;
см3;  см3;
см3;  см3;
см3; моль-екв./дм3.
моль-екв./дм3. г.
г.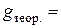 г.
г.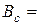 %.
%. 58
58


