
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Робота 4.4. Потенціометричне титрування.Содержание книги
Поиск на нашем сайте
Мета роботи: визначити молярну концентрацію водного розчину електроліту потенціометричним методом. Потенціометричне титрування використовують у разі визначення концентрації забарвлених або каламутних розчинів, де неможливе застосування кольорових індикаторів, а також для визначення вмісту окремих компонентів у сумішах кислот або основ, константи дисоціації яких відрізняються не менш, ніж на три порядки, і у сумішах електролітів, які внаслідок додавання титранту утворюють осади з суттєво різними добутками розчинності. Для визначення концентрації досліджуваного розчину складають гальванічний елемент з двох електродів: електрода порівняння, потенціал якого залишається сталим у процесі титрування, та індикаторного електрода, потенціал якого залежить від концентрації (активності) іонів, що входять до складу утвореного внаслідок додавання титранту осаду або слабкого електроліту. Еквівалентний об’єм визначають за графічними залежностями Якщо індикаторний електрод в ГЕ є катодом, то його потенціал і ЕРС ГЕ внаслідок додавання титранту згідно з (4.1) змінюються однаково (або зростають, або спадають). У випадку, коли індикаторний електрод є анодом у ланцюгу, його потенціал та ЕРС ГЕ змінюються протилежно (якщо Наприклад, якщо розчин KI титрувати розчином AgNO3, то перебігає реакція:
Електродом порівняння оберемо хлорсрібний ( Якщо індикаторним є йодсрібний електрод, то схема ГЕ запишеться як
потенціал індикаторного електрода
Якщо індикаторним є срібний електрод, то схема ГЕ запишеться як потенціал індикаторного електрода У випадку кислотно-основного титрування змінюється рН розчину, тому як індикаторний можна використовувати водневий, стибієвий, хінгідронний, скляний електроди, тому що їх потенціали залежать від кислотності середовища. У деяких випадках стрибок ЕРС на інтегральній кривій титрування виявляється нечітким. Тоді для точного знаходження точки еквівалентності будують диференціальну криву (на практиці Для виконання роботи в склянку для титрування наливають досліджуваний розчин, занурюють в нього індикаторний електрод і з’єднують сольовим містком з електродом порівняння. Потім з бюретки послідовно додають певні об’єми титранту, перемішують і вимірюють ЕРС після кожної наступної порції. Об’єми досліджуваного розчину та порцій титранту задає викладач. Експеримент закінчують тоді, коли після стрибка електрорушійна сила ГЕ досягає практично незмінного значення. Дані експерименту записують у табл. 4.1 (див. звіт). Будують, як показано на рис. 4, інтегральну та диференціальну криві. Для побудови другої кривої на осі абсцис відкладають об’єми Звіт 1. Досліджуваний розчин:___; об’єм досліджуваного розчину: 2. Титрант:____; концентрація титранту: 3. Рівняння реакції при титруванні: 4. Схема індикаторного електрода: 5. Вираз для потенціалу індикаторного електрода та аналіз його зміни при титруванні: 6. Схема гальванічного елементу: 7. Вираз для ЕРС ГЕ та аналіз її зміни при титруванні: 8. Результати титрування: Таблиця 4.1. Результати потенціометричного титрування
9. Побудова графіків 10. Визначення еквівалентного об’єму за перегином на графіку 11. Обчислення концентрації досліджуваного розчину: 12. Висновок. ЛІТЕРАТУРА: [3, с. 301 – 303; 5, с. 315 – 323; 7, с. 142; 8, с. 54 – 56]. 5. ПОТЕНЦІОМЕТРИЧНЕ ВИЗНАЧЕННЯ рН Водневим показником
У загальному випадку для 1–1-валентних електролітів
де Для сильних 1–1-валентних електролітів
і
Якщо концентрація розчину сильного електроліту дуже мала
Для не дуже розведених розчинів слабких 1–1-валентних електролітів
Згідно із законом розведення Оствальда ступінь дисоціації слабкого
де
звідки
Тоді, виходячи з рівняння (5.3), маємо
а за (5.1):
Для точного розрахунку Вода є дуже слабким електролітом, який дисоціює за рівнянням:
Константа рівноваги цього процесу записується як:
Оскільки для води де
де Нейтральним вважається розчин, в якому Потенціометричний метод визначення За Для потенціалів інших індикаторних електродів за стандартної температури: В приладах Потенціал скляного електрода за де Електродом порівняння в Розчини з певною концентрацією іонів водню,
де Робота 5.1. Калібрування Мета роботи: відкалібрувати
Звіт 1. Результати експерименту: Таблиця 5.1. Дані для побудови калібрувального графіка
2. Побудова калібрувальної прямої. Робота 5.2. Вимірювання Мета роботи: за допомогою рН – метра визначити рН водних розчинів сильних та слабких електролітів та порівняти їх з теоретично розрахованими. За допомогою
Звіт 1. Результати вимірювань та обчислень: Таблиця 5.2. Результати експериментальних та теоретичних досліджень
Обов’язково навести розрахунки 5. Висновок. ЛІТЕРАТУРА: [1, с. 496 – 497; 2, с. 272 – 275; 3, с. 299 – 300; 5, с. 304 – 314; 6, с. 155 – 163; 8, с. 53 – 55]. ЕЛЕКТРОЛІЗ Електролізом називають сукупність окислювально-відновних реакцій, що перебігають на електродах під час проходження через них постійного електричного струму від зовнішнього джерела енергії. Іноді електроліз спрощено характеризують як розклад речовини під дією електричного струму. При електролізі на негативному електроді (катоді) відбувається розряд катіонів, на позитивному (аноді) – розряд аніонів або окиснення матеріалу анода. У разі можливості перетворення на електродах декількох речовин на катоді першочергово перебігає процес, який характеризується найбільшим значенням електродного потенціалу серед конкуруючих реакцій відновлення, а на аноді – процес з найменшим значенням потенціалу серед можливих реакцій окиснення. За першим законом Фарадея маса речовини, що перетворюється при електролізі, прямо пропорційна кількості електрики, яку пропущено через систему:
де За другим законом Фарадея внаслідок проходження однакової кількості електрики через різні електролітні системи маси речовин, що перетворюються на електродах, відносяться між собою як молярні маси їх еквівалентів або просто як хімічні еквіваленти. Звідки випливає, що:
де Хімічний еквівалент речовини залежить від того, який саме електрохімічний процес перебігає на катоді або аноді. Для обчислення цієї величини записують електродну реакцію і визначають відношення молярної (атомної) маси речовини, що перетворюється на електроді, до кількості електронів, які беруть участь в електродному процесі
Із другого закону Фарадея випливає, що на перетворення одного моль-еквівалента будь-якої речовини витрачається однакова кількість електрики, яка називається сталою Фарадея ( За законами Фарадея масу речовини, що зазнає електрохімічних змін при електролізі на катоді або аноді, розраховують за рівнянням:
Швидкість електролізу залежить від густини електричного струму, яку визначають за формулою:
де Важливою кількісною характеристикою ефективності електролізу є вихід за струмом
або
Якщо вихід за струмом менший за 100 %, то причинами цього можуть бути з одного боку перебіг побічних (паралельних, спряжених, конкуруючих) процесів, що відбуваються одночасно з основною реакцією на тому самому електроді, а з іншого – наявність вторинних процесів, внаслідок яких кількість перетвореної при електролізі речовини у системі зменшується (відбувається її взаємодія з компонентами розчину, з матеріалом електрода, електрохімічна зміна на протилежному електроді тощо).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 568; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.155.48 (0.007 с.) |

 (інтегральна крива) або
(інтегральна крива) або  (диференціальна крива). Поблизу точки еквівалентності потенціал індикаторного електрода різко змінюється, що призводить у свою чергу до стрибка ЕРС ГЕ. Стрибки потенціалу індикаторного електрода і ЕРС ГЕ будуть тим більші, чим менші розчинність або ступінь дисоціації утвореної внаслідок додавання титранту сполуки.
(диференціальна крива). Поблизу точки еквівалентності потенціал індикаторного електрода різко змінюється, що призводить у свою чергу до стрибка ЕРС ГЕ. Стрибки потенціалу індикаторного електрода і ЕРС ГЕ будуть тим більші, чим менші розчинність або ступінь дисоціації утвореної внаслідок додавання титранту сполуки. збільшується, то
збільшується, то  зменшується і навпаки).
зменшується і навпаки).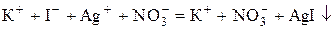 . (4.11)
. (4.11)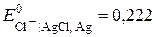 В за
В за  ). Індикаторними, приміром, можуть бути або йодсрібний (
). Індикаторними, приміром, можуть бути або йодсрібний ( В за
В за 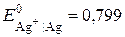 В за
В за  та Ag+, які входять до складу осаду AgI.
та Ag+, які входять до складу осаду AgI. ,
, , а ЕРС ГЕ
, а ЕРС ГЕ 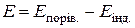 . Додавання до розчину КІ титранту AgNO3 зменшує концентрацію і, відповідно, активність
. Додавання до розчину КІ титранту AgNO3 зменшує концентрацію і, відповідно, активність  визначають за точкою максимального перегину інтегральної кривої.
визначають за точкою максимального перегину інтегральної кривої.
 ,
, , а ЕРС ГЕ
, а ЕРС ГЕ  . Внаслідок додавання до розчину КІ титранту в системі утворюється малорозчинний осад AgI, що дисоціює з утворенням іонів арґентуму, концентрація яких майже не змінюється до еквівалентної точки. Після еквівалентної точки, коли титрант є у надлишку, концентрація і активність іонів Ag+ різко зростають, оскільки вони вже не зв’язуються йодид-іонами. Тому і
. Внаслідок додавання до розчину КІ титранту в системі утворюється малорозчинний осад AgI, що дисоціює з утворенням іонів арґентуму, концентрація яких майже не змінюється до еквівалентної точки. Після еквівалентної точки, коли титрант є у надлишку, концентрація і активність іонів Ag+ різко зростають, оскільки вони вже не зв’язуються йодид-іонами. Тому і 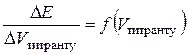 , див. рис. 4), екстремум якої відповідає максимальному перегину на інтегральній залежності і, відповідно, еквівалентному об’єму.
, див. рис. 4), екстремум якої відповідає максимальному перегину на інтегральній залежності і, відповідно, еквівалентному об’єму. , а на осі ординат – значення
, а на осі ординат – значення 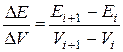 . На основі кривих титрування визначають еквівалентний об’єм і концентрацію досліджуваного розчину.
. На основі кривих титрування визначають еквівалентний об’єм і концентрацію досліджуваного розчину. см3.
см3. моль/дм3.
моль/дм3. , см3
, см3
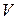 , см3
, см3
 , В/см3
, В/см3
 .
. см3.
см3.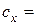 моль/дм3.
моль/дм3. називається від’ємний десятковий логарифм активності іонів водню:
називається від’ємний десятковий логарифм активності іонів водню: . (5.1)
. (5.1)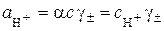 ,
, – ступінь дисоціації електроліту у розчині;
– ступінь дисоціації електроліту у розчині;  – молярна концентрація розчину;
– молярна концентрація розчину;  – середній іонний коефіцієнт активності електроліту в розчині (довідникова величина).
– середній іонний коефіцієнт активності електроліту в розчині (довідникова величина). . Тоді
. Тоді
 . (5.2)
. (5.2) , то його
, то його 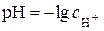 .
. ,
,  і тоді
і тоді . (5.3)
. (5.3)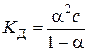 , (5.4)
, (5.4) – константа дисоціації слабкого 1–1-валентного електроліту (довідникова величина), яка залежить від природи електроліту та розчинника, а також від температури. Для наближеного розрахунку (
– константа дисоціації слабкого 1–1-валентного електроліту (довідникова величина), яка залежить від природи електроліту та розчинника, а також від температури. Для наближеного розрахунку (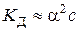 ,
,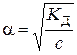 .
. 
 ,
,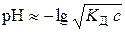 . (5.5)
. (5.5) .
.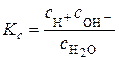 .
. за сталої температури незмінна, то
за сталої температури незмінна, то  , (5.6)
, (5.6) – константа, яку називають іонним добутком води і яка залежить від температури. За стандартної температури
– константа, яку називають іонним добутком води і яка залежить від температури. За стандартної температури  (моль/дм3)2, а
(моль/дм3)2, а  , оскільки
, оскільки  . Отже, у водних розчинах концентрації іонів
. Отже, у водних розчинах концентрації іонів  та
та  не можуть бути довільними, оскільки вони пов’язані рівнянням (5.6). На підставі цієї формули можна записати
не можуть бути довільними, оскільки вони пов’язані рівнянням (5.6). На підставі цієї формули можна записати , (5.7)
, (5.7) .
. (
( ). За
). За  , кислому –
, кислому –  , лужному –
, лужному – 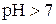 .
.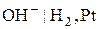 ), стибієвий (
), стибієвий ( ), хінгідронний (
), хінгідронний (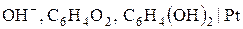 ) та скляний (
) та скляний ( ).
). К потенціал водневого електрода пов’язаний з
К потенціал водневого електрода пов’язаний з  .
. .
. ,
, – стандартний для певного скляного електрода потенціал, який визначають його калібруванням за допомогою буферних розчинів з відомими значеннями
– стандартний для певного скляного електрода потенціал, який визначають його калібруванням за допомогою буферних розчинів з відомими значеннями  , (5.8)
, (5.8) – константа дисоціації слабкої кислоти;
– константа дисоціації слабкої кислоти;  ,
,  – концентрації кислоти і солі у буферному розчині. Для визначення концентрації
– концентрації кислоти і солі у буферному розчині. Для визначення концентрації  ). Послідовно вимірюють
). Послідовно вимірюють  ) у табл. 5.1. Будують калібрувальну пряму, відкладаючи на осі абсцис
) у табл. 5.1. Будують калібрувальну пряму, відкладаючи на осі абсцис  .
. водних розчинів кислот та основ
водних розчинів кислот та основ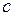 , моль/дм3
, моль/дм3

 , %
, %
 , (6.1)
, (6.1) – маса перетвореної внаслідок електролізу речовини;
– маса перетвореної внаслідок електролізу речовини;  – коефіцієнт пропорційності (електрохімічний еквівалент), який чисельно дорівнює масі речовини, що зазнала перетворення в процесі електролізу в результаті проходження через систему 1 кулона (1 Кл = 1 А×с) електрики;
– коефіцієнт пропорційності (електрохімічний еквівалент), який чисельно дорівнює масі речовини, що зазнала перетворення в процесі електролізу в результаті проходження через систему 1 кулона (1 Кл = 1 А×с) електрики;  – кількість пропущеної через електрохімічну систему електрики (Кл);
– кількість пропущеної через електрохімічну систему електрики (Кл);  – сила струму (А);
– сила струму (А); 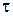 – тривалість електролізу (с).
– тривалість електролізу (с). ,
,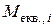 – хімічний еквівалент речовини і (г/моль-екв.)
– хімічний еквівалент речовини і (г/моль-екв.) :
: .
. ):
): 
 . (6.2)
. (6.2) , (6.3)
, (6.3)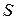 – площа поверхні електрода (м2 або см2).
– площа поверхні електрода (м2 або см2). . Його виражають у відсотках і визначають або за практично отриманою та теоретично розрахованою за рівнянням (6.2) масами перетвореної речовини, або за її практично виміряним та теоретично обчисленим об’ємами, що приведені до нормальних умов:
. Його виражають у відсотках і визначають або за практично отриманою та теоретично розрахованою за рівнянням (6.2) масами перетвореної речовини, або за її практично виміряним та теоретично обчисленим об’ємами, що приведені до нормальних умов: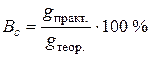 (6.4)
(6.4)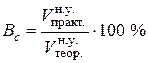 . (6.5)
. (6.5)


