
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Робота 3.1. Визначення константи електролітичної комірки.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Мета роботи:визначити константу комірки для вимірювання електропровідності розчинів електролітів. Електролітична комірка (посудина для вимірювання електропровідності) – це скляна ємність, в яку зазвичай впаяно два платинованих платинових електроди. Оскільки для певної комірки невідомі площа електродів та відстань між ними, то спочатку потрібно визначити її константу – відношення відстані між електродами до їх площі:
Для цього комірку заповнюють розчином електроліту з відомою питомою електропровідністю (зазвичай 0,02 М розчин KCl, табл. 3.1) в такій кількості, щоб були покриті електроди, розміщують її у термостаті, який налаштовано на певну температуру, витримують протягом 8 – 10 хв. і вимірюють опір. Таблиця 3.1. Питома електропровідність 0,02 М розчину KCl за різних температур
Згідно з рівняннями (3.2) і (3.11) константа комірки визначається за формулою:
Звіт 1. Температура досліду: 2. Питома електропровідність стандартного розчину КСl:
3. Опір стандартного розчину КСl: 4. Обчислення константи комірки за рівнянням (3.12): Робота 3.2. Дослідження електропровідності розчинів сильних та слабких електролітів. Мета роботи:визначити питому, молярну електропровідності розчинів електролітів, ступінь дисоціації слабкого електроліту та коефіцієнт електропровідності сильного електроліту. В електролітичну комірку наливають розчин сильного електроліту (за вказівкою викладача) і після термостатування за необхідної температури вимірюють його опір. Після цього посудину для вимірювання електропровідності промивають дистильованою водою і наливають в неї піпеткою 10 см3 розчину слабкого 1–1-валентного електроліту (за вказівкою викладача), термостатують і вимірюють опір. Питому електропровідність розчинів обчислюють за формулою:
Молярну електропровідність електроліту
Звіт 1. Температура досліду: 2. Таблиця 3.2. Результати експерименту та обчислень
Обчислення для сильного електроліту: Обчислення для слабкого електроліту: 3. Висновок. Робота 3.3. Визначення константи дисоціації слабкого електроліту. Мета роботи:визначити константи дисоціації слабкого електроліту в розчинах різної концентрації та підтвердити закон розведення Оствальда. В електролітичну комірку наливають піпеткою 10 см3 розчину слабкого 1–1-валентного електроліту (за вказівкою викладача), витримують в термостаті 8 – 10 хв. і вимірюють його опір (для виконання роботи може бути використано розчин слабкого електроліту з попереднього досліду 3.2). Потім додають до нього 10 см3 дистильованої води (концентрація зменшується удвічі), ретельно перемішують, термостатують і знову вимірюють опір. Для подальшого розведення розчину удвічі кожного разу піпеткою відбирають із комірки 10 см3 рідини, додають 10 см3 дистильованої води, перемішують, термостатують і вимірюють опір. Розраховують для розчину кожної концентрації розведення, питому і молярну електропровідності, ступінь і константу дисоціації електроліту. Результати вимірювань і розрахунків записують у табл. 3.3.
Звіт 1. Температура досліду: 2. Електроліт:_____; гранична молярна електропровідність: 3. Таблиця 3.3. Експериментальні дані та розраховані величини
4. Довідникове значення константи дисоціації електроліту за температури 25 о С: 5. Побудова графіків: 6. Висновок. ЛІТЕРАТУРА: [1, с. 429 – 437, 458 – 463; 2, с. 226 – 233, 235 – 243; 3, с. 222 – 225, 245 – 253, 257 – 258; 4, с. 268 – 281; 5, с. 249 – 255, 262 – 263; 6, с. 182 – 194; 7, с. 123 – 124, 136 – 137; 8, с. 51 – 52].
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 495; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.185.207 (0.011 с.) |

 . (3.11)
. (3.11) ,См/см
,См/см
 . (3.12)
. (3.12)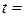 о С.
о С. См/см.
См/см. Ом.
Ом. см -1.
см -1. . (3.13)
. (3.13) розраховують за формулою (3.4), граничну молярну електропровідність
розраховують за формулою (3.4), граничну молярну електропровідність  визначають за довідниковими даними на основі рівняння (3.7). Для сильних електролітів обчислюють коефіцієнт електропровідності (за 3.9), для слабких – ступінь дисоціації (за 3.8). Виміряні та розраховані величини зводять у табл. 3.2.
визначають за довідниковими даними на основі рівняння (3.7). Для сильних електролітів обчислюють коефіцієнт електропровідності (за 3.9), для слабких – ступінь дисоціації (за 3.8). Виміряні та розраховані величини зводять у табл. 3.2. ,
См/см
,
См/см
 або
або 
 См×см2/моль.
См×см2/моль. ,
моль/дм3
,
моль/дм3
 ,
дм3/моль
,
дм3/моль
 ,
Ом
,
Ом
 ,
моль/дм3
,
моль/дм3

 моль/дм3.
моль/дм3. ,
,  ,
,  ,
,  .
.


