
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Робота 4.1. Визначення ЕРС хімічних гальванічних елементів та електродних потенціалів.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Мета роботи: визначити експериментально ЕРС хімічних гальванічних елементів і потенціали їх електродів та порівняти з теоретично обчисленими величинами. За вказівкою викладача складають гальванічний елемент. Для цього в дві пробірки наливають зазначені викладачем розчини електролітів певної моляльної концентрації, в які занурюють відповідні промиті дистильованою водою та просушені електроди. Деякі електроди перед роботою потрібно зачистити наждаковим папером. Обидві пробірки з’єднують промитим дистильованою водою та просушеним фільтрувальним папером сольовим містком (сифоном), який заповнений загущеним концентрованим розчином хлориду амонію. Електроди приєднують до високоомного вольтметра і вимірюють ЕРС досліджуваного ГЕ. Для експериментального визначення потенціалу окремого електрода ГЕ його сполучають чистим сольовим містком з нормальним каломельним або хлорсрібним електродом і вимірюють ЕРС утвореного ланцюга. Те ж саме роблять і з іншим електродом ГЕ. Експериментальні значення електродних потенціалів розраховують за формулою (4.1). Для теоретичного обчислення потенціалів електродів використовують рівняння Нернста (4.4). Стандартні електродні потенціали та коефіцієнти активності електролітів виписують з довідника. Теоретичне значення ЕРС досліджуваного ГЕ визначають на основі (4.1). Стандартні потенціали електродів, які використовуються в роботі, істотно відрізняються. Тому, записуючи схеми ГЕ у звіті, порівнюють Звіт 1. Схема досліджуваного гальванічного елементу (ГЕ 1): а) рівняння анодного процесу: б) рівняння катодного процесу: в) рівняння сумарної реакції в ГЕ 1: г) експериментальне значення ЕРС ГЕ 1: 2. Теоретичне і експериментальне визначення потенціалу катода ГЕ 1: а) дані для теоретичного обчислення потенціалу катода ГЕ 1: електроліт: концентрація електроліту концентрація іонів, які визначають потенціал електрода, середній іонний коефіцієнт активності електроліту активність іонів, які визначають потенціал електрода, за (4.3) стандартний потенціал катода б) розрахунок теоретичного значення рівноважного потенціалу катода за (4.4): в) схема ланцюга для експериментального визначення потенціалу катода (ГЕ 2): г) експериментальне значення ЕРС ГЕ 2: д) розрахунок на основі е) обчислення відносної похибки визначення потенціалу катода: 3. Теоретичне і експериментальне визначення потенціалу анода ГЕ 1: а) дані для теоретичного обчислення потенціалу анода ГЕ 1: електроліт: концентрація електроліту концентрація іонів, які визначають потенціал електрода, середній іонний коефіцієнт активності електроліту активність іонів, які визначають потенціал електрода, за (4.3) стандартний потенціал анода б) розрахунок теоретичного значення рівноважного потенціалу анода за (4.4): в) схема ланцюга для експериментального визначення потенціалу анода (ГЕ 3): г) експериментальне значення ЕРС ГЕ 3: д) розрахунок на основі е) обчислення відносної похибки визначення потенціалу анода: 4. Розрахунок теоретичного значення ЕРС ГЕ 1 з використанням визначених у пп. 2 і 3 теоретичних величин потенціалів окремих електродів: 5. Обчислення відносної похибки визначення ЕРС ГЕ 1: 6. Висновок. Робота 4.2. Визначення ЕРС концентраційного гальванічного елементу. Мета роботи: визначити експериментально ЕРС концентраційного гальванічного елементу і порівняти її з теоретично обчисленою величиною. Складають гальванічний елемент з двох однакових електродів з різними концентраціями розчинів (за вказівкою викладача) і вимірюють його електрорушійну силу. За рівнянням (4.6) розраховують теоретичне значення електрорушійної сили гальванічного елементу і порівнюють з одержаним експериментально. Звіт 1. Схема гальванічного елементу: анодний процес: катодний процес: 2. Концентрації електролітів: середні іонні коефіцієнти активності електролітів:
3. Обчислення активностей іонів за (4.3):
4. Розрахунок теоретичного значення ЕРС ГЕ: 5. Експериментальне значення ЕРС ГЕ: 6. Обчислення відносної похибки вимірювання ЕРС ГЕ: 7. Висновок. Робота 4.3. Визначення добутку розчинності галогеніду Мета роботи: визначити розчинність і добуток розчинності галогеніду арґентуму у водному розчині потенціометричним методом. У насиченому водному розчині малорозчинного галогеніду арґентуму AgHal за певної температури встановлюється рівновага
Добуток розчинності (ДР) малорозчинного електроліту – це добуток активностей іонів у насиченому розчині, на які дисоціює сполука, з показниками степенів, що дорівнюють стехіометричним коефіцієнтам в рівнянні (4.7). ДР за Для галогеніду арґентуму добуток розчинності виражається формулою
а розчинність
Для експериментального визначення ДР AgHal складають концентраційний гальванічний елемент. Для цього в одну пробірку за вказівкою викладача наливають 0,1-моляльний розчин галогеніду калію, до якого піпеткою додають декілька крапель AgNO3 до появи каламуті (активність іонів арґентуму в утвореному розчині складає
Електрорушійна сила цього ланцюга за стандартної температури виражається рівнянням:
З рівняння (4.10) на основі вимірювання ЕРС визначають Для визначення добутку розчинності одержані значення
Звіт 1. Досліджуваний галогенід арґентуму: 2. Схема гальванічного елементу: 3. Експериментальне значення ЕРС елементу: 4. Середній іонний коефіцієнт активності 0,1-моляльного розчину AgNO3: 5. Обчислення 6. Розрахунок 7. Середній іонний коефіцієнт активності 0,1-моляльного розчину KHal: 8. Розрахунок 9. Обчислення експериментального значення ДР AgHal за (4.8): 10. Довідникове значення ДР AgHal: 11. Розрахунок розчинності AgHal за (4.9): 12. Висновок. ЛІТЕРАТУРА: [1, с. 466 – 476, 479 – 492; 2, с. 248 – 270; 3, с. 263 – 265, 276 – 297, 301; 4, с. 288 – 304; 5, с. 283 – 298; 6, с. 128 – 130, 135 – 149, 163; 7, с. 143 – 147; 8, с. 53 – 55].
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 1238; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.98.39 (0.008 с.) |

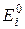 електродів для того, щоб визначити, який з них є анодом, а який – катодом.
електродів для того, щоб визначити, який з них є анодом, а який – катодом. В.
В. моль/кг;
моль/кг; моль/кг;
моль/кг; ;
; моль/кг;
моль/кг; В;
В; В;
В; В;
В; експериментального значення потенціалу катода ГЕ 1 за (4.1):
експериментального значення потенціалу катода ГЕ 1 за (4.1):  В;
В; %.
%. В;
В; В;
В; В;
В; експериментального значення потенціалу анода ГЕ 1 за (4.1):
експериментального значення потенціалу анода ГЕ 1 за (4.1):  В;
В; %.
%. В.
В. %.
%. моль/кг;
моль/кг;  моль/кг;
моль/кг; ;
;  .
. моль/кг;
моль/кг;  моль/кг.
моль/кг. В.
В. В.
В. . (4.7)
. (4.7) є сталою величиною.
є сталою величиною. , (4.8)
, (4.8)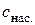 такого бінарного електроліту дорівнює:
такого бінарного електроліту дорівнює: . (4.9)
. (4.9) і дорівнює
і дорівнює  в рівнянні (4.8)), та занурюють срібний електрод. В іншу пробірку наливають 0,1-моляльний розчин AgNO3 з активністю іонів арґентуму
в рівнянні (4.8)), та занурюють срібний електрод. В іншу пробірку наливають 0,1-моляльний розчин AgNO3 з активністю іонів арґентуму  і також занурюють в нього срібний електрод. Зрозуміло, що
і також занурюють в нього срібний електрод. Зрозуміло, що  , оскільки внаслідок утворення в першій пробірці малорозчинного AgHal концентрація Ag+ в ній дуже мала. Розчини з’єднують сифоном і вимірюють ЕРС ГЕ, схема якого має вигляд:
, оскільки внаслідок утворення в першій пробірці малорозчинного AgHal концентрація Ag+ в ній дуже мала. Розчини з’єднують сифоном і вимірюють ЕРС ГЕ, схема якого має вигляд: .
. . (4.10)
. (4.10) у 0,1-моляльному розчині KHal.
у 0,1-моляльному розчині KHal. і
і  В.
В.

 моль/кг.
моль/кг. моль2/кг2.
моль2/кг2. моль2/дм6.
моль2/дм6. моль/кг.
моль/кг.


