
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічна кінетика. ЕлектрохіміяСтр 1 из 11Следующая ⇒
Фізична хімія Хімічна кінетика. Електрохімія Методичні вказівки до виконання лабораторних робіт для студентів напряму підготовки 6.051301 «Хімічна технологія» усіх форм навчання Рекомендовано Вченою радою хіміко-технологічного факультету НТУУ «КПІ»
Київ НТУУ «КПІ» Фізична хімія. Хімічна кінетика. Електрохімія [Текст]: метод. вказівки до викон. лаборатор. робіт для студ. напряму підготов. 6.051301 «Хімічна технологія» усіх форм навчання / Уклад.: Г.А. Рудницька, Т.А. Каменська, Т.В. Кірсенко. – К.: НТУУ «КПІ», 2012. – 76 с. – 120 пр. Рекомендовано Вченою радою ХТФ НТУУ «КПІ» (Протокол № 1 від 30 січня 2012 р.)
Н а в ч а л ь н е в и д а н н я
Фізична хімія Хімічна кінетика. Електрохімія Методичні вказівки до виконання лабораторних робіт для студентів напряму підготовки 6.051301 «Хімічна технологія» усіх форм навчання
Укладачі: Рудницька Ганна Анатоліївна,канд. хім. наук, доц. Каменська Тетяна Анатоліївна,канд. хім. наук, доц. Кірсенко Тетяна Володимирівна,канд. хім. наук, доц.
Відповідальний редактор М.Є. Пономарьов, канд. хім. наук, доц.
Рецензент Т.І. Дуда, канд. хім. наук, доц.
За редакцією укладачів Надруковано з оригінал-макета замовника
ВСТУП Значна роль в опануванні теоретичними основами курсу фізичної хімії та в ознайомленні з різними фізико-хімічними методами дослідження хімічних систем належить лабораторним заняттям. Лабораторний практикум є однією з найважливіших ланок навчально-методичного процесу засвоєння природничо-наукової дисципліни. Виконуючи лабораторні завдання, студенти набувають навичок експериментальної роботи, навчаються самостійно обробляти та аналізувати дослідні дані, робити за отриманими результатами висновки і узагальнення. Дані методичні вказівки створено на базі багаторічних методичних розробок викладачів кафедри фізичної хімії Національного технічного університету України «КПІ» у відповідності до діючої робочої навчальної програми кредитного модуля «Фізична хімія 2. Хімічна кінетика. Електрохімія» для студентів напряму підготовки 6.051301 «Хімічна технологія» всіх спеціальностей. Опис кожної лабораторної роботи містить стислі теоретичні відомості. Однак для більш глибокого та усвідомленого засвоєння певної теми студент повинен готуватися до лабораторного заняття за конспектом лекцій та за підручниками, посилання на які наведено після кожної роботи.
Підготовка до виконання лабораторного практикуму крім засвоєння теоретичного матеріалу передбачає також написання протоколу, в якому обов’язково зазначається назва роботи, її мета, описується хід виконання, а у звіті наводяться таблиці для запису експериментальних даних. Для допуску до виконання кожної лабораторної роботи та її захисту необхідно опрацювати контрольні запитання до відповідної теми, які наведено в методичних вказівках [8]. Всі розрахунки, які виконуються на основі експериментальних та довідникових даних, повинні бути представлені у протоколі. Їх результати скорочуються до певної кількості значущих цифр, що відповідають точності досліду. Необхідно зазначати розмірність кожної обчисленої величини. Графіки будують у правильно вибраному масштабі на міліметровому папері або за допомогою комп’ютера. У багатьох випадках експериментальне значення певної властивості порівнюють з теоретичним, обчислюючи відносну похибку експерименту за формулою:
де Перед початком роботи в лабораторіях кафедри фізичної хімії кожен студент проходить інструктаж з питань охорони праці та протипожежної безпеки, що відображено у відповідному журналі реєстрації. Крім того, безпосередньо перед виконанням лабораторної роботи викладач нагадує студентам про необхідність дотримання загальних заходів безпеки та тих, що відповідають особливостям виконуваної роботи. Звіт 1. Дані експерименту:
Таблиця 1.1. Залежність об’єму кисню, що виділився внаслідок перебігу реакції, від часу
2. Обчислення концентрації КІ у реакційній суміші:
3. Побудова за даними табл. 1.1 графіка 4. Розрахунки для табл. 1.2: Таблиця 1.2. Дані для визначення константи швидкості та порядку реакції
5. Побудова за даними табл. 1.2. графіка за ним 6. Кінетичне рівняння реакції: 7. Визначення часу напівперетворення: а) за формулою б) за графіком 8. Побудова графіка Таблиця 1.3. Залежність константи швидкості реакції від концентрації
9. Розрахунок питомої активності каталізатора:
10. Висновок. ЛІТЕРАТУРА: [1, с. 523 – 527, 533 – 542, 616 – 623; 2, с. 290 – 293, 297 – 310, 427 – 433; 3, с. 318 – 329, 401 – 406; 4, с. 322 – 338, 344, 365 – 367; 5, с. 195 – 201, 204 – 205; 6, с. 217 – 225, 229 – 233; 8, с. 43 – 46]. Звіт 1. Дані експерименту: температура досліду Таблиця 1.4. Залежність об’єму кисню, що виділився наслідок перебігу реакції, від часу
2. Побудова за даними табл. 1.4 графіка 3. Розрахунки для табл. 1.5: Таблиця 1.5. Дані для визначенняконстанти швидкості та порядку реакції
4. Кінетичне рівняння реакції: 5. Дані для графічного визначення енергії активації реакції: Таблиця 1.6. Залежність константи швидкості реакції від температури
6. Побудова графіка 7. Висновок. ЛІТЕРАТУРА: [1, с. 528 – 531; 2, с. 313 – 315; 3, с. 337 – 341; 4, с. 338 – 346; 5, с. 202 – 205; 6, с. 235 – 236; 7, с. 217; 8, с. 46 – 47]. Звіт 1. Дані експерименту: температура досліду Таблиця 1.7. Залежність об’єму Na2S2O3, який витрачено на титрування реакційної проби, від часу
2. Побудова за даними табл. 1.7 графіка 3. Обчислення за формулою (хв.-1):
4. Висновок стосовно частинного порядку реакції за К2S2O8 та її кінетичне рівняння: 5. Дані для графічного визначення енергії активації досліджуваної реакції: Таблиця 1.8. Залежність константи швидкості реакції від температури
6. Побудова графіка
7. Висновок. ЛІТЕРАТУРА: [1, с. 523 – 542, 616 – 623; 2, с. 290 – 310, 313 – 315, 427 – 433; 3, с. 318 – 329, 337 – 341, 402 – 406; 4, с. 322 – 346; 5, с. 195 – 206; 6, с. 217 – 225, 229 – 236; 8, с. 43 – 47]. Звіт 1. Пункти 1 – 6 оформлюються так само, як у роботі 1.3. 2. Обчислення загальної константи швидкості, написання загального кінетичного рівняння реакції, визначення загального порядку реакції. ЛІТЕРАТУРА: [1, с. 523 – 542, 616 – 623; 2, с. 290 – 310, 313 – 315, 427 – 433; 3, с. 318 – 329, 337 – 341, 402 – 406; 4, с. 322 – 346; 5, с. 195 – 206; 6, с. 217 – 225, 229 – 236; 8, с. 43 – 47].
Звіт 1. Розміри циліндра бензойної кислоти: висота 2. Результати титрування насиченого розчину бензойної кислоти:
3. Результати кінетичних досліджень: а) побудова графіка залежності б) обчислення за формулою (2.12) для табл. 2.1. Таблиця 2.1. Дані для визначення константи швидкості процесу розчинення бензойної кислоти у воді та порядку цього процесу
4. Побудова на основі даних табл. 2.1 графіка розчинення: 5. Розрахунок за рівнянням (2.6) товщини дифузійного шару: 6. Кінетичне рівняння процесу: 7. Висновок. ЛІТЕРАТУРА: [1, с. 531 – 532; 2, с. 384 – 393; 3, с. 341 – 343; 5, с. 225 – 233; 6, с. 276 – 277, 285 – 287; 7, с. 117; 8, с. 48]. Звіт 1. Розміри циліндра бензойної кислоти: висота 2. Результати титрування вихідного розчину КОН:
3. Результати кінетичних досліджень: а) побудова графіка залежності б) обчислення за формулами (2.15, 2.16) для табл. 2.2. Таблиця 2.2. Дані для визначенняконстанти швидкості реакції
4. Побудова на основі даних табл. 2.2 на одному графіку залежностей
реакції за різних режимів перемішування:
5. Розрахунок товщини дифузійного шару за різних режимів перемішування:
6. Кінетичні рівняння процесу: 7. Висновок. ЛІТЕРАТУРА: [1, с. 531 – 532; 2, с. 384 – 393; 3, с. 341 – 343; 5, с. 225 – 233; 6, с. 276 – 277, 285 – 287; 7, с. 117; 8, с. 48]. Звіт 1. Температура досліду: 2. Питома електропровідність стандартного розчину КСl:
3. Опір стандартного розчину КСl: 4. Обчислення константи комірки за рівнянням (3.12): Звіт 1. Температура досліду: 2. Таблиця 3.2. Результати експерименту та обчислень
Обчислення для сильного електроліту:
Обчислення для слабкого електроліту: 3. Висновок. Звіт 1. Температура досліду: 2. Електроліт:_____; гранична молярна електропровідність: 3. Таблиця 3.3. Експериментальні дані та розраховані величини
4. Довідникове значення константи дисоціації електроліту за температури 25 о С: 5. Побудова графіків: 6. Висновок. ЛІТЕРАТУРА: [1, с. 429 – 437, 458 – 463; 2, с. 226 – 233, 235 – 243; 3, с. 222 – 225, 245 – 253, 257 – 258; 4, с. 268 – 281; 5, с. 249 – 255, 262 – 263; 6, с. 182 – 194; 7, с. 123 – 124, 136 – 137; 8, с. 51 – 52]. Звіт 1. Досліджуваний розчин:___; об’єм досліджуваного розчину: 2. Титрант:____; концентрація титранту: 3. Рівняння реакції при титруванні: 4. Результати експерименту: Таблиця 3.4. Результати кондуктометричного титрування
5. Побудова графіків 6. Визначення еквівалентного об’єму за зламом на графіку 7. Обчислення концентрації досліджуваного розчину: 8. Висновок.
ЛІТЕРАТУРА: [1, с. 465 – 466; 2, с. 247 – 248; 3, с. 258 – 260; 5, с. 266 – 270; 6, с. 194 – 196; 7, с. 123 – 124; 8, с. 52 – 53]. ЕЛЕКТРОРУШІЙНІ СИЛИ Електрод – це електрохімічна система, що складається мінімум з двох фаз, одна з яких зазвичай є провідником 1-го роду (метал або графіт), а друга – провідником 2-го роду (розчин або розплав електроліту). На межі поділу фаз перебігає рівноважний електродний процес переносу заряду з однієї фази до іншої, внаслідок чого виникає подвійний електричний шар, якому відповідає певний стрибок потенціалу – електродний потенціал. Цей стрибок потенціалу безпосередньо виміряти неможливо, проте можна виміряти різницю потенціалів між електродами. Електрод називається хімічно оборотним, якщо внаслідок зміни напряму струму на ньому перебігає у протилежних напрямках та ж сама реакція (наприклад, мідна пластинка, яка занурена в розчин з іонами З двох оборотних електродів можна скласти оборотний електрохімічний ланцюг або гальванічний елемент (ГЕ). В ГЕ катодом (+) є електрод з більшим значенням потенціалу, а анодом (–) – з меншим. На катоді завжди перебігає процес відновлення, а на аноді – окислення. Електрорушійною силою (ЕРС) гальванічного елементу називається різниця рівноважних потенціалів його електродів за умови відсутності струму в ланцюгу:
де Правила запису схем гальванічних елементів такі: - ліворуч розташовують анод, а праворуч – катод; - схема починається і закінчується символом металу; - розчини електролітів відокремлюються вертикальною пунктирною лінією у разі їх контакту через порувату мембрану і суцільною подвійною лінією, якщо між ними розміщено сольовий місток; - якщо в однаковому агрегатному стані перебувають декілька речовин, то їх відокремлюють комою;
- необхідно зазначати концентрацію електроліту (або активності іонів) та парціальні тиски газів, які визначають потенціал електродів; - схему можна спростити, записуючи замість електроліту тільки іони, від яких залежить потенціал певного електрода. Прикладом хімічно оборотного ГЕ може бути елемент Даніеля-Якобі, який складається з цинкового та мідного електродів, що занурені відповідно у водні розчини сульфату цинку та сульфату міді:
або
При роботі цього гальванічного елементу перебігають такі електрохімічні реакції: на аноді (–) на катоді (+) сумарна реакція в ГЕ Якщо в ГЕ перебігає реакція
де Активність окремих іонів у складі сильного електроліту розраховують за рівнянням:
де Вираз для обчислення ЕРС елементу Даніеля-Якобі за (4.2) має вигляд:
Рівноважні потенціали окремих електродів
де Наприклад, для кобальтового електрода
Оскільки, як вже зазначалось раніше, потенціал електрода відносно розчину виміряти неможливо, то електродні потенціали у водних розчинах виражають в умовній водневій шкалі, в якій за будь-якої температури за нуль прийнято потенціал стандартного водневого електрода. Він являє собою покриту платиновою черню платинову пластину, яка занурена в розчин з одиничною активністю іонів водню. Електрод насичують очищеним та висушеним воднем з парціальним тиском 1 атм. На водневому електроді, схема якого записується як На практиці електродний потенціал визначають, користуючись (4.1), за виміряною ЕРС елементу, який складається з досліджуваного електрода та електрода порівняння з відомим значенням потенціалу. Найчастіше електродом порівняння обирають хлорсрібний Вимірювання ЕРС ГЕ повинно проводитись у термодинамічно оборотних умовах, тобто таких, за яких струм через ланцюг не проходить. Для цього використовують компенсаційний метод, в якому відома ЕРС еталонного гальванічного елементу (зазвичай елемент Вестона) врівноважує ЕРС досліджуваного ГЕ. Прилади для вимірювання ЕРС компенсаційним методом називаються потенціометрами. На теперішній час доволі часто замість потенціометрів застосовують високоомні вольтметри. За причиною виникнення струму в ланцюгу гальванічні елементи поділяють на хімічні та концентраційні. В хімічних гальванічних елементах ЕРС виникає внаслідок перебігу хімічної реакції. Електроди такого елементу мають різну хімічну природу. Прикладом хімічного ланцюга може слугувати елемент Даніеля-Якобі. Концентраційні ГЕ складаються з двох однакових за хімічною природою електродів, які відрізняються один від одного активностями (парціальними тисками) учасників електродних реакцій. Електричний струм в таких ланцюгах виникає внаслідок вирівнювання зазначених активностей (парціальних тисків). Стандартна ЕРС, яка дорівнює різниці стандартних потенціалів електродів
для концентраційного ГЕ дорівнює нулю. Якщо однакові електроди мають розчини з різними активностями іонів
Звіт 1. Схема досліджуваного гальванічного елементу (ГЕ 1): а) рівняння анодного процесу: б) рівняння катодного процесу: в) рівняння сумарної реакції в ГЕ 1: г) експериментальне значення ЕРС ГЕ 1: 2. Теоретичне і експериментальне визначення потенціалу катода ГЕ 1: а) дані для теоретичного обчислення потенціалу катода ГЕ 1: електроліт: концентрація електроліту концентрація іонів, які визначають потенціал електрода, середній іонний коефіцієнт активності електроліту активність іонів, які визначають потенціал електрода, за (4.3) стандартний потенціал катода б) розрахунок теоретичного значення рівноважного потенціалу катода за (4.4): в) схема ланцюга для експериментального визначення потенціалу катода (ГЕ 2): г) експериментальне значення ЕРС ГЕ 2: д) розрахунок на основі е) обчислення відносної похибки визначення потенціалу катода: 3. Теоретичне і експериментальне визначення потенціалу анода ГЕ 1: а) дані для теоретичного обчислення потенціалу анода ГЕ 1: електроліт: концентрація електроліту концентрація іонів, які визначають потенціал електрода, середній іонний коефіцієнт активності електроліту активність іонів, які визначають потенціал електрода, за (4.3) стандартний потенціал анода б) розрахунок теоретичного значення рівноважного потенціалу анода за (4.4): в) схема ланцюга для експериментального визначення потенціалу анода (ГЕ 3): г) експериментальне значення ЕРС ГЕ 3: д) розрахунок на основі е) обчислення відносної похибки визначення потенціалу анода: 4. Розрахунок теоретичного значення ЕРС ГЕ 1 з використанням визначених у пп. 2 і 3 теоретичних величин потенціалів окремих електродів: 5. Обчислення відносної похибки визначення ЕРС ГЕ 1: 6. Висновок. Звіт 1. Схема гальванічного елементу: анодний процес: катодний процес: 2. Концентрації електролітів: середні іонні коефіцієнти активності електролітів:
3. Обчислення активностей іонів за (4.3):
4. Розрахунок теоретичного значення ЕРС ГЕ: 5. Експериментальне значення ЕРС ГЕ: 6. Обчислення відносної похибки вимірювання ЕРС ГЕ: 7. Висновок. Робота 4.3. Визначення добутку розчинності галогеніду Мета роботи: визначити розчинність і добуток розчинності галогеніду арґентуму у водному розчині потенціометричним методом. У насиченому водному розчині малорозчинного галогеніду арґентуму AgHal за певної температури встановлюється рівновага
Добуток розчинності (ДР) малорозчинного електроліту – це добуток активностей іонів у насиченому розчині, на які дисоціює сполука, з показниками степенів, що дорівнюють стехіометричним коефіцієнтам в рівнянні (4.7). ДР за Для галогеніду арґентуму добуток розчинності виражається формулою
а розчинність
Для експериментального визначення ДР AgHal складають концентраційний гальванічний елемент. Для цього в одну пробірку за вказівкою викладача наливають 0,1-моляльний розчин галогеніду калію, до якого піпеткою додають декілька крапель AgNO3 до появи каламуті (активність іонів арґентуму в утвореному розчині складає
Електрорушійна сила цього ланцюга за стандартної температури виражається рівнянням:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 336; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.228.95 (0.188 с.) |
 ,
, і
і  – експериментальне та теоретичне значення, відповідно. Дослід можна вважати якісним, якщо відносна похибка не перевищує 10 %.
– експериментальне та теоретичне значення, відповідно. Дослід можна вважати якісним, якщо відносна похибка не перевищує 10 %.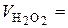 4 см3;
4 см3; 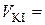 см3;
см3; 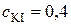 моль/дм3.
моль/дм3.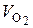 , см3
, см3
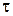 , с
, с
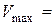 см3.
см3. моль/дм3.
моль/дм3.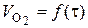 .
.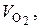 см3
см3

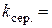 с -1
с -1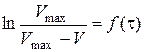 та обчислення
та обчислення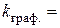 с -1.
с -1.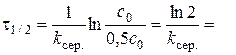 с;
с;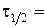 с.
с.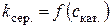 за даними табл. 1.3 та визначення константи швидкості реакції без каталізатора:
за даними табл. 1.3 та визначення константи швидкості реакції без каталізатора: 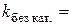 с -1.
с -1.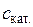 , моль/дм3
, моль/дм3
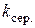 , с -1
, с -1
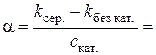
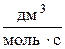 .
.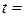 о С;
о С;  см3;
см3;  см3.
см3. , К-1
, К-1
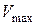 , см3
, см3
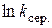
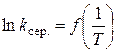 та визначення на його основі за формулою (1.13) енергії активації реакції.
та визначення на його основі за формулою (1.13) енергії активації реакції.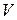 , см3
, см3
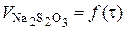 .
.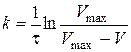 констант швидкості реакції
констант швидкості реакції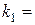 ;
; 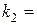 ;
;  ; ……..
; …….. 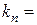 ;
; 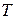 , K
, K
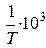 , К-1
, К-1
 см; діаметр
см; діаметр  см; площа поверхні
см; площа поверхні  см2.
см2. см3,
см3,  см3,
см3,  см3.
см3. ;
; , см3
, см3

 , хв.-1
, хв.-1
 хв.-1
хв.-1 та визначення за ним (формула (2.14)) константи швидкості процесу
та визначення за ним (формула (2.14)) константи швидкості процесу см.
см. см3,
см3,  см3,
см3, 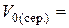 см3.
см3. ;
; , см3
, см3
 ,
, 
 хв.-1
хв.-1 хв.-1
хв.-1 та
та 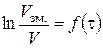 і визначення за ними констант швидкості
і визначення за ними констант швидкості хв.-1;
хв.-1;  хв.-1
хв.-1 см;
см;  см.
см. См/см.
См/см. Ом.
Ом. см -1.
см -1. ,
См/см
,
См/см
 ,
См×см2/моль
,
См×см2/моль
 , См×см2/моль
, См×см2/моль
 або
або 
 См×см2/моль.
См×см2/моль. ,
моль/дм3
,
моль/дм3
 ,
дм3/моль
,
дм3/моль
 ,
Ом
,
Ом
 ,
моль/дм3
,
моль/дм3

 моль/дм3.
моль/дм3. ,
,  ,
,  ,
,  .
. см3.
см3. моль/дм3.
моль/дм3. , см3
, см3
 , Ом-1
, Ом-1
 і
і  .
. см3.
см3.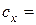 моль/дм3.
моль/дм3. ).
). , (4.1)
, (4.1) – ЕРС ГЕ;
– ЕРС ГЕ;  – рівноважні потенціали катода і анода, відповідно.
– рівноважні потенціали катода і анода, відповідно.  вимірюються у вольтах (В).
вимірюються у вольтах (В).
 .
. ;
; ;
; .
. , то його ЕРС можна обчислити за формулою:
, то його ЕРС можна обчислити за формулою: , (4.2)
, (4.2) – стандартна ЕРС ГЕ (ЕРС за умови одиничних активностей та парціальних тисків учасників реакції);
– стандартна ЕРС ГЕ (ЕРС за умови одиничних активностей та парціальних тисків учасників реакції);  – стала Фарадея;
– стала Фарадея;  – число електронів, що беруть участь у реакції;
– число електронів, що беруть участь у реакції;  – нерівноважні (вихідні) активності реагентів;
– нерівноважні (вихідні) активності реагентів;  (за стандартної температури
(за стандартної температури  ).
). , (4.3)
, (4.3) – моляльна концентрація іонів даного типу
– моляльна концентрація іонів даного типу  ;
;  – середній іонний коефіцієнт активності електроліту з моляльною концентрацією
– середній іонний коефіцієнт активності електроліту з моляльною концентрацією  , до складу якого входить іон
, до складу якого входить іон  .
. , (4.4)
, (4.4)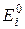 – стандартний електродний потенціал, тобто потенціал електрода за умови, що активності (парціальні тиски) всіх учасників електродної реакції дорівнюють одиниці;
– стандартний електродний потенціал, тобто потенціал електрода за умови, що активності (парціальні тиски) всіх учасників електродної реакції дорівнюють одиниці;  ,
,  – відповідно добутки нерівноважних активностей з урахуванням стехіометричних коефіцієнтів вихідних речовин та продуктів у реакції відновлення.
– відповідно добутки нерівноважних активностей з урахуванням стехіометричних коефіцієнтів вихідних речовин та продуктів у реакції відновлення. процес відновлення запишеться як
процес відновлення запишеться як  , а рівняння (4.4) матиме вигляд:
, а рівняння (4.4) матиме вигляд:
 , може перебігати в протилежних напрямках реакція
, може перебігати в протилежних напрямках реакція  . Отже, для експериментального визначення потенціалу електрода у водневій шкалі необхідно скласти гальванічний елемент з досліджуваного (в схемі він може бути як анодом, так і катодом) та стандартного водневого електродів і виміряти його ЕРС. Тоді з формули (4.1) випливає, що електродний потенціал – це ЕРС (або ЕРС з протилежним знаком) гальванічного елементу, який складається з досліджуваного та стандартного водневого електродів. Стандартні електродні потенціали у водневій шкалі за стандартної температури наведено у довідниках.
. Отже, для експериментального визначення потенціалу електрода у водневій шкалі необхідно скласти гальванічний елемент з досліджуваного (в схемі він може бути як анодом, так і катодом) та стандартного водневого електродів і виміряти його ЕРС. Тоді з формули (4.1) випливає, що електродний потенціал – це ЕРС (або ЕРС з протилежним знаком) гальванічного елементу, який складається з досліджуваного та стандартного водневого електродів. Стандартні електродні потенціали у водневій шкалі за стандартної температури наведено у довідниках. або каломельний
або каломельний  . Потенціал нормального каломельного електрода з концентрацією КСl 1 моль/дм3 за стандартної температури становить 0,281 В.
. Потенціал нормального каломельного електрода з концентрацією КСl 1 моль/дм3 за стандартної температури становить 0,281 В. , (4.5)
, (4.5) і
і  (
( ), які визначають потенціал, то теоретичне значення ЕРС концентраційного елементу можна розрахувати за рівнянням:
), які визначають потенціал, то теоретичне значення ЕРС концентраційного елементу можна розрахувати за рівнянням: . (4.6)
. (4.6) В.
В. моль/кг;
моль/кг; моль/кг;
моль/кг; ;
; моль/кг;
моль/кг; В;
В; В;
В; В;
В; експериментального значення потенціалу катода ГЕ 1 за (4.1):
експериментального значення потенціалу катода ГЕ 1 за (4.1):  В;
В; %.
%. В;
В; В;
В; В;
В; експериментального значення потенціалу анода ГЕ 1 за (4.1):
експериментального значення потенціалу анода ГЕ 1 за (4.1):  В;
В; %.
%. В.
В. %.
%. моль/кг;
моль/кг;  моль/кг;
моль/кг; ;
;  .
. моль/кг;
моль/кг;  моль/кг.
моль/кг. В.
В. В.
В. . (4.7)
. (4.7) є сталою величиною.
є сталою величиною. , (4.8)
, (4.8)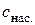 такого бінарного електроліту дорівнює:
такого бінарного електроліту дорівнює: . (4.9)
. (4.9) і дорівнює
і дорівнює  в рівнянні (4.8)), та занурюють срібний електрод. В іншу пробірку наливають 0,1-моляльний розчин AgNO3 з активністю іонів арґентуму
в рівнянні (4.8)), та занурюють срібний електрод. В іншу пробірку наливають 0,1-моляльний розчин AgNO3 з активністю іонів арґентуму  і також занурюють в нього срібний електрод. Зрозуміло, що
і також занурюють в нього срібний електрод. Зрозуміло, що  , оскільки внаслідок утворення в першій пробірці малорозчинного AgHal концентрація Ag+ в ній дуже мала. Розчини з’єднують сифоном і вимірюють ЕРС ГЕ, схема якого має вигляд:
, оскільки внаслідок утворення в першій пробірці малорозчинного AgHal концентрація Ag+ в ній дуже мала. Розчини з’єднують сифоном і вимірюють ЕРС ГЕ, схема якого має вигляд: .
. . (4.10)
. (4.10)


