
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ТЕМА: Нітросполуки. Аміни. Реакції діазотування і азосполучення.Содержание книги
Поиск на нашем сайте
2. МЕТА: Порівняти умови нітрування бензену, нітробензену і фенолу. Добути метиламін і вивчити його властивості. Вивчити властивості аніліну. Д обути метилоранж (геліантин) і вивчити його властивості. 3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1. Бензен, нітробензен, фенол, азотна кислота (ρ = 1,4 г/см3 ). 3.2. Водяна баня, термометр, газовідвідна трубка. 3. 3. Ацетамід (порошок), розчин брому, їдкий натр 2н і концентрований р-ни, розчин хлорного вапна. 3.4. Купрум (ІІ) сульфат, хлоридна кислота концентрована, ферум (ІІІ) хлорид, анілін. 3.5. Велика пробірка, лакмусовий папір червоний. 3.6. Сульфанілова кислота. 3.7. Натрію нітрит 0,5н розчин. 3.8. Натрію гідроксид (1 н і 2н р-ни). 3.9. Сульфатна кислота (ρ = 1,84 г/см3). 3.10. Диметиланілін, оцтова (льодяна) кислота.
ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ. Одержання нітробензену. 4.1.1 Хід роботи: в суху пробірку поміщають 2 краплі концентрованої нітратної кислоти і 3 краплі концентрованої сульфатної кислоти. Одержану нітруючу суміш охолоджують і додають 2 краплі бензену. Пробірку поміщають у водяну баню, яка нагріта до 50-55°С, на 2-3 хв, постійно збовтують вміст пробірки. Після цього виливають реакційну суміш в приготовлену пробірку з водою. 4.1.2 Спостереження: на дно опускається крапля жовтуватого нітробензену.
НО – NO2 + 2H2SO4 = NO2+ + 2HSO4- + [H3O]+
4.1.4 Висновок: швидкість реакції нітрування залежить від об’єму нітрування і складу нітруючої суміші.
Одержання динітробензену. 4.2.1 Хід роботи: в пробірку поміщають 2 краплі HNO3 і 3 краплі H2SO4. До гарячої нітруючої суміші додають 2 краплі нітробензену і нагрівають на водяній бані, яка кипить, при постійному збовтуванні 3-4 хв. Потім реакційну суміш охолоджують і виливають в пробірку з водою. Для одержання мононітробензену потрібно температуру 50°С, а для одержання динітробензену - 90°С. 4.2.2 Спостереження: динітробензен спочатку виділяється у вигляді тяжкої маслянистої краплі, потім швидко переходить в кристалічний стан.
4.2.3 Хімізм реакцій: + HO – NO2 → + H2O
4.2.4 Висновок: нітрогрупа відноситься до замісників ІІ роду. Нітрування фенолу. 4.3.1.Хід роботи: в пробірку поміщають декілька кристалів фенолу, 2-3 краплі води і мішають до утворення однорідного розчину. В круглу пробірку поміщають 3 краплі НNО3 (конц.) і 3 краплі води. Розбавлену НNО3 краплинами додають до рідкого фенолу, весь час взбовтуючи і охолоджуючи реакційну пробірку. Потім реакційну суміш виливають в пробірку з декількома краплями води. Отвір пробірки закривають корком з газовідвідною трубкою і відганяють о-нітрофенол в чисту, суху пробірку-приймач. 4.3.2. Спостереження: мутний розчин має гіркий запах.
NO2 4.3.4.Висновок: реакції заміщення фенолів проходять значно легше, ніж у ароматичних вуглеводнів. Одержання метиламіну з ацетаміду. 4.4.1. Хід роботи: в пробірку з газовідвідною трубкою помістити на кінчику мікролопатки ацетамід, 4 краплі води і 2 краплі брому. Вміст пробірки обережно збовтати, охолодити водою і доливати по краплині концентрований розчин лугу до знебарвлення брому. Потім добавити таку ж кількість крапель 1н розчину лугу. Вміст пробірки нагрівати в полум’ї пальника, занурити кінець газовідвідної трубки в пробірку з водою, що охолоджується льодом. 4.4.2. Спостереження: відгін має характерний для метиламіну запах сирої риби і аміаку. 4.4.3. Хімізм реакцій:
NH2 NHBr
NHBr CH3 – N = C = O + H2O → CH3 – NH2 + CO2 4.4.4. Висновок: розпад амідів протікає через декілька стадій.
Властивості амінів жирного ряду. 4.5.1. Хід роботи: перевірка водного розчину на індикатори: а) До отвору газовідвідної трубки приладу для отримання метиламіну піднести вологий червоний лакмусовий папірець. б) В пробірку поміщаємо 2 краплі водного розчину метиламіну і добавити 1 краплю розчину фенолфталеїну. 4.5.2. Спостереження: рожевий колір та характерний запах.
СН3NH2 + HOH D [CH3NH3]+OH- D [CH3NH3]+ + OH-
H Cl Cl CH3 – N = C + HCl + 2H2O → [CH3NH3]+ Cl- + HCOOH 4.5.4. Висновок: ця реакція є специфічною для первинних амінів.
|
||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 329; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.45.82 (0.007 с.) |

 NO2
NO2
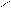



 OH
OH


 ОН NO2
ОН NO2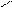 4.3.3. Хімізм реакцій: + НО – NO2 – + H2O
4.3.3. Хімізм реакцій: + НО – NO2 – + H2O

 OH
OH


 O O
O O
 СН3 – С + Вr2 + NaOH → CH3 – C + NaBr + H2O
СН3 – С + Вr2 + NaOH → CH3 – C + NaBr + H2O
 O
O CH3 – C → CH3 – N = C = O
CH3 – C → CH3 – N = C = O 4.5.3. Хімізм реакцій:
4.5.3. Хімізм реакцій:
 H Cl H
H Cl H


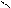 CH3 – N + C → CH3 – N = C + 3HCl
CH3 – N + C → CH3 – N = C + 3HCl


