
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Виявлення Карбону та ГідрогенуСодержание книги Поиск на нашем сайте
Лабораторна робота № 1
1. ТЕМА: Якісний елементний аналіз органічних сполук. Алкани. 2. МЕТА: Виявити Карбон, Гідроген, Нітроген, Сульфур і Хлор в органічних речовинах. Добути метан і вивчити властивості насичених вуглеводнів.
3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1 Глюкоза, купруму (ІІ) оксид (порошок); баритова вода; купруму (ІІ) сульфат (безводний); велика пробірка; газовідвідна трубка; штатив. 3.2 Сечовина; натрій металічний; феруму (ІІІ) сульфат (1%-ий розчин); феруму (ІІІ) хлорид (1%-ий розчин), хлоридна кислота (2%-ий розчин); етиловий спирт. 3.3 Тіосечовина; натрій металічний; етиловий спирт; плюмбуму (ІІ) ацетат (0,1н розчин); фільтрувальний папір; скляна паличка. 3.4 Хлороформ; мідна дротина. 3.5 Натрію ацетат (плавлений); натронне вапно; розчин калію перманганату; розчин брому; велика пробірка; газовідвідна трубка; штатив. 3.6 Рідкі алкани; лакмусовий папір синій. 3.7 Сульфатна кислота концентрована.
ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ. Виявлення Карбону та Гідрогену 4.1.1 Хід роботи: в пробірку насипають чорний порошок купруму (ІІ) оксиду (шар висотою 5 мм). Додають 1-2 г сахарози і ретельно перемішують. У верхню частину пробірки на невеликий шматочок вати насипають безводного купруму (ІІ) сульфату. Пробірку закріплюють у штативі в горизонтальному положенні і закривають корком з газовідвідною трубкою, кінець якої занурюють в пробірку з баритовою водою. Суміш поступово нагрівають, починаючи з кінця, закритого корком. Із газовідвідної трубки починають виходити бульбашки газу і баритова вода мутніє, так як виділяється білий осад барію карбонату. 4.1.2 Спостереження: безводний CuSO4 синіє, а баритова вода мутніє, внаслідок утворення кристалогідрату синього кольору CuSO4 • 5H2O і білого осаду ВаСО3. 4.1.3 Хімізм реакцій: С6Н12О6 + 12СuО ® 6СО2 + 6Н2О + 12 Сu СО2 + Ва(ОН)2 ® ВаСО3¯ + Н2О CuSO4 + 5H2O ® CuSO4 • 5H2O 4.1.4 Висновок: При прожарюванні органічної речовини в суміші з окисником (СuО) відбувається окислення Карбону органічної речовини в вуглекислий газ, а Гідрогену - у воду. Воду в продуктах згорання виявляють по утворенню синіх кристалів мідного купоросу. Виявлення Нітрогену 4.2.1 Хід роботи: в суху пробірку з сечовиною (0,1г) додають шматочок металічного натрію завбільшки з горошину і ще приблизно 0,1г сечовини. Спробу проводять у витяжній шафі. Суміш обережно нагрівають на невеликому полум’ї до розплавлення натрію, після чого нагрівання продовжують до зруйнування речовини. Спостерігається спалах. Пробірку тримати отвором в бік від працюючих. Суміш охолодити, додати 3 краплі етилового спирту (якщо залишився кусочок металічного натрію), 5 крапель дистильованої води, 1 краплю залізного купоросу, 1 краплю феруму (ІІІ) хлориду і 1 краплю хлоридної кислоти. Якщо до складу досліджуваної речовини входив Нітроген, то розчин забарвлюється в синій колір, але з часом з нього випадає осад берлінської лазурі. При дуже малих кількостях Нітрогену розчин забарвлюється в зелений колір, і тільки через деякий час забарвлення змінюється до синього. 4.2.2 Спостереження: розчин забарвлюється в синій колір, але з часом з нього випадає осад берлінської лазурі. 4.2.3 Хімізм процесу: 2С2Н5ОН + 2Na ® 2C2H5ONa + H2 Na + [C] + [N] ® Na CN FeSO4 + 2NaOH ® Fe(OH)2 + Na2SO4 FeCl3 + 3NaOH ® Fe(OH)3 + 3NaCl 2NaCN + FeSO4 ® Fe(CN)2 + Na2SO4 Fe(CN)2 + 4NaCN ® Na4 [Fe(CN)6] 3Na4 [Fe(CN)6] + 4FeCl3 = Fe4[ Fe(CN)6]3↓ + 12NaCl 4.2.4 Висновок Утворений комплекс з солями оксиду феруму (ІІІ) може дати синій осад Fe4 [Fe(CN)6]3. Отже утворення ціанатів свідчить про наявність в органічних сполуках Нітрогену.
Виявлення Сульфуру. 4.3.1 Хід роботи: в суху пробірку з тіосечовиною 0,1г додають шматочок металічного натрію завбільшки з горошину. Суміш обережно нагрівають на невеликому полум’ї до розплавлення натрію. Спостерігається спалах. Суміш охолодити, додати 3 краплі етилового спирту (якщо не прореагував в суміші весь натрій), 5 крапель дистильованої води. На фільтрувальний папір наносять 2 краплі того розчину. Туди ж наносять краплю плюмбуму (ІІ) ацетату. 4.3.2 Спостереження: утворився коричневий осад, спостерігається спалах. 4.3.3 Хімізм реакцій: Na2S + Pb(CH3COO)2 = 2NaCH3COO + PbS↓ 4.3.4 Висновок: В досліді час від часу змінюється забарвлення. Це свідчить про наявність плюмбуму (ІІ) ацетату.
Виявлення Хлору. Реакція Ф.Ф. Бейльштейна. 4.4.1 Хід роботи: мідну дротину з загнутим у вигляді петлі кінцем прожарюють у полум’ї. Після охолодження кінець почорнілого дроту занурюють в пробірку з хлороформом і вводять у полум’я. 4.4.2 Спостереження: полум’я набуває зеленого забарвлення. 4.4.3 Хімізм реакцій: 2СН3СІ + CuO ® CuCI2 + 4CuCI + 2CO2 + H2O 4.4.4 Висновок: Внаслідок окисленнякупруму оксиду з хлороформом полум’я набуває синього забарвлення, що свідчить про наявність хлору в органічній речовині.
Одержання метану і вивчення його властивостей. 4.5.1 Хід роботи: В пробірку 1 закриту корком з газовідвідною трубкою, поміщають суміш безводного натрію ацетату і натронного вапна (1:2). Потім закріплюють пробірку в штатив і нагрівають. Підпалюють газ на кінці газовідвідної трубки. 4.5.2 Спостереження: метан горить голубим полум’ям. 4.5.3 Хімізм реакцій: CH3COONa + NaОН® CH4+ Na2СО3 CH4 + 2О2 ® СО2 + 2Н2О 4.5.4 Висновок: При нагріванні натрію ацетату з натронним вапном проходить розщеплення солі з одержанням метану. Нагрівання солей карбонових кислот з натронним вапном являється лабораторним способом одержання ненасичених вуглеводнів.
4.6 Відношення метану до бромної води і калію перманганату. 4.6.1 Хід роботи: В пробірку 2 поміщають 5 крапель розчину калію перманганату і в пробірку 3 наливаємо 3-5 крапель бромної води. Не припиняючи нагрівання опускаємо кінець газовідвідної трубки в пробірки 2 і 3. 4.6.2 Спостереження: не відбувається знебарвлення розчинів калію перманганату і бромної води. 4.6.3 Хімізм реакцій: СН4 + Br2 ≠ СН4 + КМnO4 ≠ 4.6.4 Висновок: У звичайних умовах алкани стійкі до дії окисників. Реакції заміщення в них проходять за досить складних умов, до реакції приєднання алкани не здатні.
Відношення рідких алканів до окисників. 4.7.1 Хід роботи: В суху пробірку наливаємо 0,5 мл рідких алканів і додаємо 1 краплю розчину калію перманганату. Вміст енергійно збовтують. 4.7.2 Спостереження: фіолетове забарвлення не зникає. 4.7.3 Хімізм реакцій: R-H + КМnO4 ≠ 4.7.4 Висновок: рідкі алкани за даних умов не окислюються.
4.8 Дія концентрованої сульфатної кислоти на насичені вуглеводні. 4.8.1 Хід роботи: В пробірку поміщаємо 2 краплі рідких алканів і 2 краплі H2SO4 (конц.), перемішуємо 1-2 хвилини. 4.8.2 Спостереження: В пробірці не відбувається ніяких змін 4.8.3 Хімізм реакцій: R-H + НОSO2OH® R-SO2OH + H2O 4.8.4 Висновок: В умовах досліду алкани з сульфатною кислотою не реагують. При невеликому нагріванні концентрована сульфатна кислота утворює з алканами, що містять третинний атом Карбону, сульфокислоту. При високих температурах сульфатна кислота діє як окисник.
КОНТРОЛЬНІ ЗАПИТАННЯ: 1. Написати рівняння реакцій відкриття Нітрогену, Карбону, Гідрогену і Сульфуру. 2. Знайти молекулярну формулу речовини, яка містить 92,3% Карбону і 7,7% Гідрогену. Густина пари за воднем 13. 3. Які застережливі заходи при роботі з металічним натрієм? 4. Описати хімічні властивості алканів на прикладі ізобутану. 5. Добути різними шляхами пропан. 6. Написати структурні формули і дати назви усім ізомерам складу С7Н16.
ЛІТЕРАТУРА · А.В.Аверина, А.Я.Снегирева Лабораторный практикум по органической химии М.: “ВШ” 1980. Гл. 2. Досл. 2, 3, 4,5. · А.В.Аверина, А.Я.Снегирева Лабораторный практикум по органической химии М.: “ ВШ” 1980. Гл.3. Досл.7,9,10.
Лабораторна робота № 2
ТЕМА: Алкени. Алкіни. 2. МЕТА: Добути етилен і вивчити властивості ненасичених вуглеводнів. Добути ацетилен і вивчити властивості ацетиленових вуглеводнів.
3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1 Етиловий спирт 96%-ий, сульфатна кислота (ρ = 1,84 г/см3); 3.2 Бромна вода, насичений розчин; 3.3 Калію перманганат, 0,1 н.; 3.4 рідкі алкени (керосин); 3.5 велика пробірка, газовідвідна трубка, кристалізатор, штатив. 3.6 кальцію карбід (шматочками), хлоркальцієва трубка, склянка, скловата, пінцет; 3.7 аміачний комплекс арґентуму, фільтрувальний папір, лійка. 4. ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ: Приєднання до ацетилену брому. 4.5.1 Хід роботи: пропускаємо газ в пробірку з 5 краплями бромної води. 4.5.2 Спостереження: бромна вода знебарвлюється внаслідок приєднання атомів брому по місцю потрійного зв’язку. 4.5.3 Хімізм реакцій: СН ≡ СН + 2Br2 → Br2HC – CHBr2 1,1,2,2, - тетраброметан 4.5.4 Висновок: знебарвлення бромної води доказує ненасиченість ацетилену. ЛАБОРАТОРНА РОБОТА № 3. 1. ТЕМА. Ароматичні вуглеводні. 2. МЕТА: Вивчити властивості бензену, толуену і нафталену.
3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1 Бензен, толуен, нітробензен, нафтален; 3.2 Бромна вода, КМnO4 0.1 н, H2SO4 2н, HNO3(конц.), 3.3 Фарфорова лодочка, водяна баня, термометр.
4. ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ:
Горіння бензену. 4.1.1. Хід роботи: в фарфорову чашку поміщають 1 краплю бензену і підпалюють. 4.1.2. Спостереження: бензен горить яскравим кіптявим полум’ям. 4.1.3. Хімізм: 2С6Н6 + 15О2 → 12СО2 + 6Н2О 4.1.4. Висновок: бензен - горючий вуглеводень. 4.2. Дія бромної води на бензен. 4.2.1. Хід роботи: в пробірку поміщають 3 краплі бромної води і 2 краплі бензену. Вміст пробірки енергійно збовтують і дають відстоятися. 4.2.2. Спостереження: нижній шар бромної води знебарвлюється, а верхній шар бензену забарвлюється в коричнево-жовтий колір.
4.2.3. Хімізм: + Br2 → + НВr 4.2.4. Висновок: бром легше розчиняється в бензені, ніж у воді, і тому переходить у верхній бензенний шар. Приєднання брому в даних умовах не проходить.
Дія перманганату калію. 4.3.1. Хід роботи: в пробірку поміщають 3 краплі води, 1 краплю розчину перманганату калію і краплю розчину H2SO4. До одержаного розчину додають краплю бензену і збовтують вміст пробірки. 4.3.2. 4.3.3. Хімізм: + 4.3.4. Висновок: бензен, як і всі ароматичні вуглеводні, стійкий до дії окисників. Нітрування бензену. 4.5.1 Хід роботи: В суху пробірку поміщають 2 краплі концентрованої нітратної кислоти, 3 краплі концентрованої сульфатної кислоти. Одержану суміш охолоджують і додають 2 краплі бензену, поміщають на водяну баню, нагріту 50- 55°С на 2 хв. 4.5.2 Спостереження: коли вміст пробірки перелити в іншу пробірку з водою на дно осяде важкий жовтуватий нітробензен.
4.5.3 4.5.4 Висновок: за допомогою даного досліду ми одержали нітробензен. Нітрування нафталену. 4.8.1 Хід роботи: в суху пробірку поміщають кристалик нафталену, 3 краплі нітратної кислоти, 2 краплі сульфатної кислоти. На водяній бані суміш нагрівають 2-3 хв. Гарячий розчин виливають у пробірку з холодною водою. 4.8.2 Спостереження: нафтален опускається на дно у вигляді оранжевої маслянистої рідини, яка твердне при збовтуванні.
4.8.3 Хімізм реакцій: + НО – NO2 → + H2O 4.8.4 Висновок: ми добули нітронафтален. Нітрування нафталену проходить легше, ніж нітрування бензену. ЛАБОРАТОРНА РОБОТА №4 1. Тема: Гідроксильні сполуки і їх похідні. 2. Мета: Вивчити властивості етилового спирту і гліцерину.
3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1 Етиловий спирт, гліцерин. 3.2 СuSO4 2 н розчин 3.3 Фенолфталеїн 1 %-ий розчин, лакмус 1 %-ий розчин. 3.4 Натрій металічний. 3.5 Хромова суміш, Н2SO4 концентрована.
4. ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ:
ЛАБОРАТОРНА РОБОТА № 5. Розчинення фенолу у воді. 4.1.1 Хід роботи: помістити у пробірку 2 краплі рідкого фенолу, добавити 2 краплі води і збовтати. Дати суміші відстоятися. Пізніше суміш у пробірці розшаровується: верхній шар - розчин фенолу у воді, нижній - розчин води у фенолі. Обережно нагріти пробірку над пальником. 4.1.2 Спостереження: утворюється мутна рідина – емульсія фенолу. 4.1.3 Хімізм реакцій: 4.1.4 Висновок: фенол погано розчиняється у холодній воді.
Одержання натрію феноляту. 4.2.1 Хід роботи: в пробірку поміщають 4 краплі емульсії фенолу у воді і добавляють 2 краплі розчину їдкого натрію. Швидко збовтують. 4.2.2. Спостереження: утворюється безбарвний розчин. 4.2.3 Хімізм реакцій: С6Н5 – ОН + NaOH → C6H5 – ONa + H2O 4.2.4 Висновок: феноли володіють кислотними властивостями.
Нітрування фенолу. 4.6.1. Хід роботи: в пробірку поміщають декілька кристалів фенолу, 2-3 краплі води і мішають до утворення однорідного розчину. В другу пробірку поміщають 3 краплі НNО3 (конц.) і 3 краплі води. Розбавлену НNО3 по краплях переливають до рідкого фенолу, весь час збовтуючи і охолоджуючи реакційну пробірку. Потім реакційну суміш виливають в пробірку з декількома краплями води. Отвір пробірки закривають корком з газовідвідною трубкою і відганяють о-нітрофенол в чисту, суху пробірку-приймач. 4.6.2. Спостереження: о-нітрофенол має характерний мигдальний запах.
4.6.3. Хімізм реакцій: + Н NO3 →
ОН 4.6.4. Висновок: Гідроксильна група активує ядро, що її містить.
ЛАБОРАТОРНА РОБОТА № 6
1. ТЕМА: Карбонові кислоти. 2. МЕТА: Вивчити властивості одноосновних та двоосновних карбонових кислот.
3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1 Кислоти: мурашина, стеаринова, олеїнова, щавлева, оцтова (0,1 н розчини). 3.2 Магній; натрію карбонат (кр.); баритова вода. 3.3 Метил оранжевий розчин; лакмус синій розчин, фенолфталеїн 1%-ий спиртовий розчин. 3.4 Натрію форміат; сульфатна кислота 2 н розчин. 3.5 Калію перманганат 1 н розчин; мурашина кислота безводна; сульфатна кислота концентрована. 3.6 Натрію ацетат кристалічний; кальцію хлорид 0,1 н розчин; феруму (ІІІ) хлорид 0,1 н розчин. 3.7 Дерев’яні скалки.
4. ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ: ЛАБОРАТОРНА РОБОТА № 7
1. ТЕМА: Похідні карбонових кислот. 2. МЕТА: Вивчення властивостей ангідридів, естерів, мила. 3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1 Натрію ацетат (плавлений). 3.2 Етиловий спирт, H2SO4 (ρ =1.84 г/см3),їдкий натр 2н. 3.3 Оцтовий і фталевий ангідриди. 3.4 Мило(тверде), мило концентрований розчин, сульфатна кислота 2н р-н, фенолфталеїн 1%-ий спирт. р-н. 3.5 CaCl2 0,1 н р-н.
4. Порядок проведення роботи: Розчинність мила у воді. 4.5.1. Хід роботи: в пробірку поміщають кусочок мила (10мг) і добавляють 5 крапель води, збовтують вміст пробірки протягом 1-2 хв. Після цього вміст пробірки нагрівають у полум’ї пальника. Нагрівають також інші лужні мила (калієві, алюмінієві), які добре розчиняються у воді. 4.5.2. Спостереження: мило добре розчинне у воді. 4.5.3. Хімізм реакцій: 4.5.4. Висновок: натрієве та інші лужні мила добре розчинні у воді.
ЛАБОРАТОРНА РОБОТА № 8.
ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ. Одержання нітробензену. 4.1.1 Хід роботи: в суху пробірку поміщають 2 краплі концентрованої нітратної кислоти і 3 краплі концентрованої сульфатної кислоти. Одержану нітруючу суміш охолоджують і додають 2 краплі бензену. Пробірку поміщають у водяну баню, яка нагріта до 50-55°С, на 2-3 хв, постійно збовтують вміст пробірки. Після цього виливають реакційну суміш в приготовлену пробірку з водою. 4.1.2 Спостереження: на дно опускається крапля жовтуватого нітробензену.
НО – NO2 + 2H2SO4 = NO2+ + 2HSO4- + [H3O]+
4.1.4 Висновок: швидкість реакції нітрування залежить від об’єму нітрування і складу нітруючої суміші.
Одержання динітробензену. 4.2.1 Хід роботи: в пробірку поміщають 2 краплі HNO3 і 3 краплі H2SO4. До гарячої нітруючої суміші додають 2 краплі нітробензену і нагрівають на водяній бані, яка кипить, при постійному збовтуванні 3-4 хв. Потім реакційну суміш охолоджують і виливають в пробірку з водою. Для одержання мононітробензену потрібно температуру 50°С, а для одержання динітробензену - 90°С. 4.2.2 Спостереження: динітробензен спочатку виділяється у вигляді тяжкої маслянистої краплі, потім швидко переходить в кристалічний стан.
4.2.3 Хімізм реакцій: + HO – NO2 → + H2O
4.2.4 Висновок: нітрогрупа відноситься до замісників ІІ роду. Нітрування фенолу. 4.3.1.Хід роботи: в пробірку поміщають декілька кристалів фенолу, 2-3 краплі води і мішають до утворення однорідного розчину. В круглу пробірку поміщають 3 краплі НNО3 (конц.) і 3 краплі води. Розбавлену НNО3 краплинами додають до рідкого фенолу, весь час взбовтуючи і охолоджуючи реакційну пробірку. Потім реакційну суміш виливають в пробірку з декількома краплями води. Отвір пробірки закривають корком з газовідвідною трубкою і відганяють о-нітрофенол в чисту, суху пробірку-приймач. 4.3.2. Спостереження: мутний розчин має гіркий запах.
NO2 4.3.4.Висновок: реакції заміщення фенолів проходять значно легше, ніж у ароматичних вуглеводнів. Розчинність аніліну у воді. 4.9.1. Хід роботи: в пробірку поміщаємо 5 крапель води, 1 краплю аніліну і енергійно збовтуємо. 4.9.2. Спостереження: анілін погано розчиняється у воді. 4.9.3. Хімізм реакцій: 4.9.4. Висновок: Aнілін погано розчиняється у воді.
Утворення солі аніліну. 4.10.1. Хід роботи: до розчину з попереднього досліду додаємо по краплях концентровану хлоридну кислоту. 4.10.2. Спостереження: утворився прозорий розчин.
4.10.4. Висновок: анілін утворює солі тільки з сильними мінеральними кислотами.
Бромування аніліну. 4.12.1. Хід роботи: в пробірку поміщаємо 3 краплі бромної води і 1 краплю анілінової води. 4.12.2. Спостереження: випадає білий осад. 4.12.3. Хімізм реакцій:
+ 3Br2 → + 3НВr
Br 4.12.4. Висновок: бромування аніліну проходить легко.
Одержання геліантину. 4.14.1. Хід роботи: в першій пробірці знаходиться розчин діазосульфанілової кислоти з попереднього досліду. В другій пробірці змішують 3 краплі диметиланіліну і 5 крапель льодяної оцтової кислоти до одержання однорідного розчину. До розчину додають шматочок льоду і при помішуванні додають суміш діазобензенсульфокислоти (з попереднього досліду). потім додають декілька крапель розчин їдкого натру до лужної реакції на лакмус. Виділяється оранжевий осад натрієвої солі геліантину (метилоранжу). 4.14.2. Спостереження: виділяється оранжевий осад. 4.14.3. Хімізм реакцій:
NH2 NH2 N2 N(CH3)2 N = N
N(CH)3 Властивості геліантину. 4.15.1. Хід роботи: у пробірку поміщають 2 краплі геліантину і 10 крапель води. Вміст пробірки ретельно перемішують і ділять на 2 пробірки: в одну додають 2 краплі кислоти, в другу - 2 краплі лугу. 4.15.2. Спостереження: в пробірці з кислотою з’являється червоний колір, а в пробірці з лугом – жовтий. 4.15.3. Хімізм реакцій:
[ NaSO3 NH – N = = N(CH3)2]+ Cl- 4.15.4. Висновок: геліантин – добрий індикатор.
КОНТРОЛЬНІ ЗАПИТАННЯ: 1. Навести приклади різних нітросполук. 2. З бензену добути пікринову кислоту, м- нітробензойну кислоту. 3. Порівняйте умови нітрування бензену, толуену і бензенсульфокислоти. 4. При відновленні 61,5 г нітробензену одержано 44 г аніліну. Розрахувати вихід аніліну у % до теоретично можливого виходу. 5. Навести приклади реакцій амінування, умови проведення. 6. Здійснити синтези: а) з СН2 = СН2 à анілін б) з СН2 =СН2 à сульфанілову кислоту в) з С6Н6 à 2,4,6–триброманілін. 8. Який об’єм аніліну (ρ = 1,02 г/см3) можна одержати із нітробензену масою 9,2 г. 9. Яку масу нітробензену треба взяти, щоб відновленням одержати анілін масою 186 г, вихід якого складає 92% від теоретичного. 10. Опишіть хімічні властивості діазосполук на прикладі о-толілдіазоній хлориду. 11.З бензену добудьте: а) о-нітробензендіазоний хлорид; б) м-нітробензендіазоній гідроксид; в).метилоранж. ЛІТЕРАТУРА: А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980. Досліди 136, 137, 62. А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980.Досліди 139, 140 (1,3,4,5), 142, 143, 144 (2), 145. А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980. Гл.10, Досліди 153, 155.
ЛАБОРАТОРНА РОБОТА № 9. 1.ТЕМА: Вуглеводи (Моносахариди). 2. МЕТА: Вивчити властивості цукрів. 3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1. Глюкоза 0,5 % р-н, сахароза 0,5 % р-н. 3.2. Їдкий натр 2н і концентрований р-ни, СuSO4 2н р-н; 3.3. Купрум (ІІ) сахарату 0,2н р-н, хлорид на кислота концентрований і 2н р-ни; 3.4. Реактив Фелінга, Ag NO3 0,2 н р-н, аміак 0,2 н р-н. 3.5. Лакмус, лактоза 1% р-н.
ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ.
4.1Окислення глюкози реактивом Фелінга. 4.1.1 Хід роботи: у пробірку вводять 3 краплі розчину глюкози і 1 краплю реактиву Фелінга (лужний розчин мідного алкоголяту сегнетової солі). Тримаючи пробірку під кутом, уважно нагрівають верхню частину розчину. 4.1.2. Спостереження: з’являється синє забарвлення 4.1.3. Хімізм реакцій: 4.1.4. Висновок: це є якісною реакцією на глюкозу.
4.2. Окислення глюкози амоніачним розчином арґентум оксиду (реакція срібного дзеркала). 4.2.1. Хід роботи: в пробірку поміщають 1 краплю розчину нітрату срібла, 2 краплі розчину їдкого натрію і доливають по краплях розчин амоніаку до розчинення утвореного осаду арґентум гідроксиду. Потім добавляють 1 краплю розчину глюкози і легко підігрівають склад пробірки над полум’ям пальника до початку почорніння розчину. Далі реакція проходить без нагрівання. 4.2.2. Спостереження: утворюється осад.
4.2.3. Хімізм реакцій:
Н – ОН Н – ОН OH – Н [O] НО – Н
Н – ОН Н – ОН СН2ОНСН2ОН 4.2.4. Висновок: відбулось окислення глюкози арґентум оксидом в лужному середовищі. Пройшла якісна реакція. Окислення глюкози лугом. 4.3.1.Хід роботи: в пробірку поміщають 4 краплі розчину глюкози і добавляють 2 краплі розчину їдкого натру. Нагрівають суміш до кипіння і кип’ятять 2-3 хв. 4.3.2. Спостереження: розчин жовтіє, а потім коричневіє. 4.3.3. Хімізм реакцій: 4.3.4. Висновок: Пройшла якісна реакція
4.4.Доведення наявності гідроксильних груп в сахарозі. Відсутність відновлюючої здатності у сахарози. 4.4.1. Хід роботи: в пробірку поміщають 1 краплю сахарози, 5 крапель розчину лугу, 4 краплі води і 1 краплю сульфату міді. З’являється синє забарвлення сахарату міді. Розчин сахарату міді нагрівають до кипіння (нагрівають тільки верхню частину).Сахароза в цих умовах не окислюється, що вказує на відсутність в її молекулі альдегідної групи. 4.4.2. Спостереження: з’являється синє забарвлення купром (ІІ) сахарату. 4.4.3. Хімізм реакцій: 4.4.4. Висновок: сахароза в цих умовах не окислюється.
ЛАБОРАТОРНА РОБОТА № 10. 1.ТЕМА: Вуглеводи (Полісахариди). 2. МЕТА: Вивчити властивості крохмалю і клітковини. 3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1. Крохмальний клейстер 2% р-н; 3.2. Йод 0,1 н водний р-н; 3.3. H2SO4 (2н), реактив Швейцера; 3.4. Р-н йоду в KJ, фільтр, папір, вата, соляна кислота 2н і конц.; 3.5. HNO3 (r=1,4 г/см3), С2Н5ОН; 3.6. Фарфорова чашка, термометр, пінцет, водяна баня, піпетка.
ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ. Реакція крохмалю з йодом. 4.1.1.Хід роботи: в пробірку поміщають 2 краплини крохмального клейстеру і 1 краплину розчину йоду. Нагрівають до кипіння, а потім охолоджують. 4.1.2.Спостереження: при нагріванні темно синє забарвлення зникає. 4.1.3. Хімізм реакцій: 4.1.4. Висновок: амілоза дає з йодом синє забарвлення.
4.2. Кислотний гідроліз крохмалю. 4.2.1. Хід роботи: в сім пробірок поміщають по 3 кр. дуже розбавленої, майже без кольору йодної води. У фарфорову чашку наливають 10 мл крохмального клейстеру, добавляють 5 мл р-ну H2SO4 і перемішують скляною паличкою. Ставлять чашку з розчином на азбестову сітку і повільно нагрівають. Через кожних 30 сек. відбирають піпеткою з капілярним отвором 1 краплю розчину і переносять в іншу пробірку з йодною водою. Розчин охолоджують, нейтралізують розчином лугу до сильнолужної реакції, добавляють 1 каплю реактиву Фелінга і нагрівають. 4.2.2. Спостереження: з’являється оранжеве забарвлення. 4.2.3. Хімізм реакцій: (С6Н10О5)х + хН2О → хС6Н12О6 4.2.4. Висновок: поява оранжевого забарвлення доводить, що продуктом гідролізу є глюкоза.
4.3.Розчинення клітковини в реактиві Швейцера. 4.3.1. Хід роботи: в пробірку поміщають маленький кусочок гігроскопічної вати і добавляють 6 крапель реактиву Швейцера (аміачного розчину СuO). Вміст пробірки перемішують паличкою для розчинення вати. До одержаного в’язкого розчину доливають 4 каплі води і перемішують. При додаванні 1-2 крапель HCI(конц.) утворюється гідратцелюлоза. 4.3.2. Спостереження: випадає білий осад. 4.3.3. Хімізм реакцій: 4.3.4. Висновок: клітковина, що виділилась, аналогічна вихідній.
Лабораторна робота № 1
1. ТЕМА: Якісний елементний аналіз органічних сполук. Алкани. 2. МЕТА: Виявити Карбон, Гідроген, Нітроген, Сульфур і Хлор в органічних речовинах. Добути метан і вивчити властивості насичених вуглеводнів.
3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1 Глюкоза, купруму (ІІ) оксид (порошок); баритова вода; купруму (ІІ) сульфат (безводний); велика пробірка; газовідвідна трубка; штатив. 3.2 Сечовина; натрій металічний; феруму (ІІІ) сульфат (1%-ий розчин); феруму (ІІІ) хлорид (1%-ий розчин), хлоридна кислота (2%-ий розчин); етиловий спирт. 3.3 Тіосечовина; натрій металічний; етиловий спирт; плюмбуму (ІІ) ацетат (0,1н розчин); фільтрувальний папір; скляна паличка. 3.4 Хлороформ; мідна дротина. 3.5 Натрію ацетат (плавлений); натронне вапно; розчин калію перманганату; розчин брому; велика пробірка; газовідвідна трубка; штатив. 3.6 Рідкі алкани; лакмусовий папір синій. 3.7 Сульфатна кислота концентрована.
ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ. Виявлення Карбону та Гідрогену 4.1.1 Хід роботи: в пробірку насипають чорний порошок купруму (ІІ) оксиду (шар висотою 5 мм). Додають 1-2 г сахарози і ретельно перемішують. У верхню частину пробірки на невеликий шматочок вати насипають безводного купруму (ІІ) сульфату. Пробірку закріплюють у штативі в горизонтальному положенні і закривають корком з газовідвідною трубкою, кінець якої занурюють в пробірку з баритовою водою. Суміш поступово нагрівають, починаючи з кінця, закритого корком. Із газовідвідної трубки починають виходити бульбашки газу і баритова вода мутніє, так як виділяється білий осад барію карбонату. 4.1.2 Спостереження: безводний CuSO4 синіє, а баритова вода мутніє, внаслідок утворення кристалогідрату синього кольору CuSO4 • 5H2O і білого осаду ВаСО3. 4.1.3 Хімізм реакцій: С6Н12О6 + 12СuО ® 6СО2 + 6Н2О + 12 Сu СО2 + Ва(ОН)2 ® ВаСО3¯ + Н2О CuSO4 + 5H2O ® CuSO4 • 5H2O 4.1.4 Висновок: При прожарюванні органічної речовини в суміші з окисником (СuО) відбувається окислення Карбону органічної речовини в вуглекислий газ, а Гідрогену - у воду. Воду в продуктах згорання виявляють по утворенню синіх кристалів мідного купоросу. Виявлення Нітрогену 4.2.1 Хід роботи: в суху пробірку з сечовиною (0,1г) додають шматочок металічного натрію завбільшки з горошину і ще приблизно 0,1г сечовини. Спробу проводять у витяжній шафі. Суміш обережно нагрівають на невеликому полум’ї до розплавлення натрію, після чого нагрівання продовжують до зруйнування речовини. Спостерігається спалах. Пробірку тримати отвором в бік від працюючих. Суміш охолодити, додати 3 краплі етилового спирту (якщо залишився кусочок металічного натрію), 5 крапель дистильованої води, 1 крап
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 795; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.105.152 (0.011 с.) |




 Br
Br Спостереження: розчин калію перманганату зберігає своє забарвлення.
Спостереження: розчин калію перманганату зберігає своє забарвлення. ≠
≠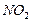




 NO2
NO2




 →
→ NO2 + Н2О
NO2 + Н2О
 →
→
 NO2
NO2



 OH
OH


 ОН NO2
ОН NO2 4.3.3. Хімізм реакцій: + НО – NO2 – + H2O
4.3.3. Хімізм реакцій: + НО – NO2 – + H2O

 OH
OH

 NH2 NH3
NH2 NH3
 4.10.3. Хімізм реакцій: + НСl → [ ]+ Cl-
4.10.3. Хімізм реакцій: + НСl → [ ]+ Cl- NH2 NH2
NH2 NH2


 Br Br
Br Br







 + NaОН → + →
+ NaОН → + →

 -Н2О -Nа2SO4 – 2H2O
-Н2О -Nа2SO4 – 2H2O


 4.14.4. Висновок: ми одержали геліантин.
4.14.4. Висновок: ми одержали геліантин.


 NaSO3 N = N N(CH3)2 + HCl →
NaSO3 N = N N(CH3)2 + HCl →
 СНО СООН
СНО СООН Н – ОН Н – ОН
Н – ОН Н – ОН


