
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Бромування ароматичних вуглеводнів.Содержание книги
Поиск на нашем сайте
4.6.1 Хід роботи: для проведення досліду беруть 2 сухі пробірки. В одну пробірку поміщають 2 краплі бензену, в другу -2 краплі толуену. В обидві пробірки додають по краплі розчину брому і збовтують протягом 1-2 хв. Вміст обидвох пробірок нагрівають до кипіння. 4.6.2 Спостереження:в пробірці з толуеном р-н з бромом знебарвлюється СН3 СН3
4.6.4 Висновок: група - СН3 є замісником І роду. Вплив каталізатора на бромування ароматичних вуглеводнів. 4.7.1 Хід роботи: в 3 пробірки наливаємо досліджуваного вуглеводню (дослід проводимо з бензеном і толуеном паралельно). В першу пробірку поміщаємо кристалик йоду, в другу - залізних ошурок, в третю - каталізатора не даємо.В пробірках з бензеном на холоді змін не відбувається, тому їх нагрівають на водяній бані до кипіння. Пробірки з толуеном лишаємо при кімнатній температурі,часто збовтуючи. 4.7.2 Спостереження: В трьох пробірках з бензином за звичайних умов зміни не відбуваються. Після нагрівання виділення бромоводню спостерігається в присутності заліза. Бромування толуолу проходить значно легше.
Br
+ НВr
4.7.4 Висновок: Бромування толуолу проходить значно легше, ніж бромування бензолу.
Нітрування нафталену. 4.8.1 Хід роботи: в суху пробірку поміщають кристалик нафталену, 3 краплі нітратної кислоти, 2 краплі сульфатної кислоти. На водяній бані суміш нагрівають 2-3 хв. Гарячий розчин виливають у пробірку з холодною водою. 4.8.2 Спостереження: нафтален опускається на дно у вигляді оранжевої маслянистої рідини, яка твердне при збовтуванні.
4.8.3 Хімізм реакцій: + НО – NO2 → + H2O 4.8.4 Висновок: ми добули нітронафтален. Нітрування нафталену проходить легше, ніж нітрування бензену. Возгонка нафталену (сублімація). 4.9.1 Хід роботи: в суху пробірку поміщають кристалик нафталену і закріплюють її у штативі. Верхню половину пробірки обгортають вологим фільтрувальним папером і починають обережно нагрівати дно пробірки. 4.9.2 Спостереження: у охолоджуваній частині пробірки утворяться кристали нафталену. 4.9.3 Хімізм реакцій: - 4.9.4 Висновок: сублімація нафталену є одним із способів його очистки.
КОНТРОЛЬНІ ЗАПИТАННЯ: 1. Методи одержання гомологів бензену. 2. Написати рівняння реакцій хімічних властивостей бензену, толуену, нафталену. 3. Здійснити синтези · З метану ® 2,4,6-тринітротолуен. · З етилену ® бромбензен. · З ацетилену ® нітробензен. 4. Скільки літрів Гідрогену необхідно для перетворення 100 г нафталену в декалін? 5. Із 78 г толуену при реакції нітрування було одержано 69 г о-нітротолуену. Скільки відсотків це становить від теоретичного виходу?
ЛІТЕРАТУРА:
· А.В.Аверина, А.Я.Снегирева. Лабораторный практикум по органической химии. М.: “ВШ”. 1980. Глава 3. Досл. 26,27,31,33. Глава 8. Досл. 136. ЛАБОРАТОРНА РОБОТА №4 1. Тема: Гідроксильні сполуки і їх похідні. 2. Мета: Вивчити властивості етилового спирту і гліцерину.
3. МАТЕРІАЛИ І ОБЛАДНАННЯ: 3.1 Етиловий спирт, гліцерин. 3.2 СuSO4 2 н розчин 3.3 Фенолфталеїн 1 %-ий розчин, лакмус 1 %-ий розчин. 3.4 Натрій металічний. 3.5 Хромова суміш, Н2SO4 концентрована.
4. ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ:
Відношення спиртів до індикатора. 4.1.1 Хід роботи: в пробірку дають 3 краплі води і додають 2 краплі етанолу. Перевіряємо на фенолфталеїн і лакмус. 4.1.2 Спостереження: забарвлення індикаторів не змінюється 4.1.3 Хімізм реакцій: 4.1.4 Висновок: спирти – практично нейтральні речовини.
Утворення і гідроліз алкоголятів. 4.2.1 Хід роботи: в суху пробірку поміщають металічний натрій, додають 3 краплі етилового спирту і закривають пробірку пальцем. По закінченню реакції підносять пробірку до полум’я пальника і забирають палець. В отворі пробірки загоряється водень, який виділяється. Залишок натрію етилату розчиняють в 2-3 краплях дистильованої води і додають 1 краплю фенолфталеїну. 4.2.2 Спостереження: з’являється малинове забарвлення 4.2.3 Хімізм реакцій: С2Н5ОН + Na → C2H5ONa + ½H2 C2H5ONa + H – OH → C2H5OH + NaOH 4.2.4 Висновок: атоми водню гідроксильних груп в спиртах проявляють певну активність. В спиртах слабо виражені кислотні властивості.
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 640; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.82.108 (0.009 с.) |




 4.7.3 Хімізм реакцій: 2Fe + 3Br2 = 2 FeBr3
4.7.3 Хімізм реакцій: 2Fe + 3Br2 = 2 FeBr3


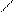
 СН3Вr
СН3Вr
 + Br2 →
+ Br2 →
 → СН3 Вr
→ СН3 Вr




