
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекція № 1 . Вступ до біонеорганічної хіміїСодержание книги
Поиск на нашем сайте
Лекція № 1. Вступ до біонеорганічної хімії
1.1 Загальні відомості про біогенні елементи. Якісний та кількісний вміст біогенних елементів в організмі людини. Макроелементи, мікроелементи та домішкові елементи. Вчення В.І. Вернадського про біосферу та роль живої речовини (живих організмів). Зв'язок між вмістом біогенних елементів в організмі людини та їхнім вмістом у довкіллі. 1.2 Періодичний закон і періодична система елементів. 1.3 Знаходження в періодичній системі біоелементів, будова атомів біоелементів. 1.1 Загальні відомості про біогенні елементи. Якісний та кількісний вміст біогенних елементів в організмі людини. Макроелементи, мікроелементи та домішкові елементи. Вчення В.І. Вернадського про біосферу та роль живої речовини (живих організмів). Зв'язок між вмістом біогенних елементів в організмі людини та їхнім вмістом у довкіллі. По В. І. Вернадському, біосфера - це певним чином організоване середовище, перероблене живими організмами, космічними випромінюваннями і пристосована до життя. Її верхня межа (тропосфера) знаходиться на висоті 12-15 км., нижня (літосфера) - на глибині до 5 км. Отже, сфера включає нижню частину атмосфери, всю гідросферу і верхню частину літосфери, поширеність хімічних елементів в земній корі різноманітна. Порівняльне невелике число елементів складають земну кору. Близько 50 % маси земної кори доводиться на кисень, більше 25 % - на кремній. Вісімнадцять елементів - кисень, кремній, алюміній, залізо, кальцій, натрій, калій, магній, водень, титан, вуглець, хлор, фосфор, сіра, азот, марганець, фтор, барій - складають 99,8 % маси земної кори. На долю решти всіх елементів доводиться лише 0,2 %. Згідно В. І. Вернадському, живі організми (жива речовина) беруть активну участь в перерозподілі хімічних елементів в земній корі. Мінерали, природні хімічні речовини утворюються в біосфері в різних кількостях завдяки діяльності живої речовини. Прикладом геохімічної ролі живої речовини є кальцієва функція, характерна для всіх організмів, що мають кальций-фосфатний (карбонатний) скелет. Концентруючи кальцій в своїх тілах, живі організми енергійно витягують його з навколишнього середовища. Іншим прикладом геохімічної ролі живої речовини є утворення гірських порід, наприклад залізняку, в результаті діяльності мікроорганізмів. Вивчаючи геохімічні перетворення в земній корі, В. І. Вернадській встановив, що зміни, що відбуваються у верхніх шарах земної кори, надають певний вплив на хімічний склад живих організмів. Дослідження хімічного складу земної кори, ґрунту, морської води, рослин, тварин, людини показали, що в живих організмах, у тому числі і у людини, можна виявити майже всі ті ж елементи, які є в земній корі і морській воді. Таким чином, були підтверджені припущення В. І. Вернадського про схожість хімічного складу земної кори і живих організмів. В процесі еволюції від неорганічних речовин до біоорганічних основою використання тих або інших хімічних елементів при створенні біосистем є природний відбір. У таблиці 1 приведені дані про вміст хімічних елементів в земній корі, морській воді, рослинних, тваринних організмах. З таблиці 1 видно, що велику частку речовини живих організмів складають елементи, які мають досить високу поширеність в земній корі. Проте ця закономірність дотримується не завжди. Так, в земній корі міститься багато кремнію (27,6%), а в живих організмах його мало. Аналогічно і для алюмінію, який у великих кількостях міститься в земній корі (7,45 %) і в дуже незначних (1 • 10-5%), - в живих організмах. Таблиця № 1 Вміст хімічних елементів в земній корі, ґрунтах, морській воді, рослинах та тваринах. (за А.П. Виноградову).
Таблиця № 2
В.В.Ковальський по вивченості і значенню поділяє хімічні елементи на три групи. I група: О, С, Н, N, Са, Р, К, S, Сl, Nа, Мg, Zn, Fе, Сu, І, Мn, V, Мо,Со, Sе. Ці елементи постійно знаходяться в живих організмах, приймають участь в обміні речовин і є незамінними; II група: Sr, Cd, Вr, F, В, Sі, Сг, Ве, Nі, Li, Сs, Sn, А1, Ва, Rb, Ті, Аg,Gа, Gе, As, Нg, Рb, Ві, Sb, U, Тh, Rа. Вони також постійно містяться в живих організмах, але їхня біологічна роль або мало вивчена, або невідома; III група: Sс, Тl, Nb, Те, Lа, W, Аu, Іn, Nd, Sm і ін. Постійно знаходяться в живих організмах, але їхня біологічна роль не з'ясована.
1.2 Періодичний закон і періодична система елементів.
1 березня 1869 року Д.І. Менделєєва сформулював свій закон і графічно зобразив його у вигляді Періодичної системи елементів: Квантових чисел. Тому на одній орбіталі не може бути більше двох електронів; ці два електрони мають однаковий набір трьох квантових чисел (n, l, mi) і повинні відрізнятися спинами (квантовим числом спину ms): ↑↓ (таблиця 3)
Таблиця 3 Таблиця 1. Розчинність кожного з компонентів газової суміші при постійній температурі пропорційна парціальному тиску компоненту над рідиною і не залежить від загального тиску суміші і індивідуальності інших компонентів.
Інакше кажучи, у разі розчинення суміші газів в рідині математичний вираз закону Генрі замість р (X) підставляють парціальний тиск рi, даного компоненту. Під парціальним тиском компоненту розуміють частку тиску компоненту від загального тиску газової суміші:
рi / рзагальний Парціальний тиск компонента розраховують за формулою:
рi = рзагальн. . х(Х i)
де рi - парціальний тиск компоненту Xi; рзагальн. - загальний тиск газової суміші; х(Хi) - молярна частка 1-го компоненту.
Приклад. Повітря є сумішшю, що полягає, в основному, з трьох газів: 78% азоту, 21 % кисню і 1 % аргону (за об'ємом). Визначите концентрацію азоту у воді при 298 К, якщо постійна Генрі рівна 6,13.10-9 моль . л-1 . Па-1. Оскільки повітря містить 78 % азоту за об'ємом, парціальний тиск азоту в повітрі при 101 325 Па складає 79033,5 Па (об'ємна частка азоту рівна молярній частці азоту, звідси р(N2)= рзагальн 0,78). З рівняння (2.1) слідує с (N2) = Kr( N2 ) р (N2), звідси с (N2) = 6,13. 10-9. 79033,5 = 4,84 . 10-4 моль/л.
Вивчаючи розчинність газів в рідинах у присутності електролітів, російський лікар-фізіолог І. М. Сєченов (1829 - 1905) встановив наступну закономірність (закон Сєченова):
Чинник еквівалентності fекв(Х) - число, що позначає, яка частка реальної частинки речовини X еквівалентна одному іону водню в даній кислотний-основній реакція або одному електрону в даній окислювально-відновній реакції, або одиниці заряду в даній обмінній реакції між солями. Чинник еквівалентності розраховують на основі стехиометрії даної реакції з рівності:
fэкв(Х) = 1/z де z - основність кислоти або кислотність підстави, даній кислотний-основній реакції, а також число електронів, що приєднуються або втрачаються частинкою в даній окислювально-відновній реакції. У обмінних реакціях без участі протонів z - сумарний заряд іонів, що обмінюються, в молекулі речовини, що бере участь в конкретній хімічній реакції; z - величина безрозмірна. Рідинах 3.1 Розчини електролітів. 3.2 Електроліти, в організмі людини. 3.3 Ступінь та константа дисоціації слабких електролітів. 3.4 Властивості розчинів сильних електролітів. 3.5 Активність та коефіцієнт активності. Йона сила розчину. Водно-електролітний баланс - необхідна умова гомеостазу.
Реакції гідролізу У загальному випадку під гідролізом розуміють реакції розкладання речовини водою. Гідроліз - окремий випадок сольволізу - взаємодії розчиненої речовини і розчинника. Гідролізу можуть піддаватися хімічні сполуки різних класів: білки, жири, вуглеводи, ефіри, соли і т.д. В неорганічній хімії найчастіше зустрічаються з гідролізом солей: ! гідролізом солі називають взаємодію соли з молекулами води, що приводить до утворення малодисоційованих сполук.
З погляду протеолітичної теорії кислот і основ гідроліз є окремий випадок оборотної рівноваги. Процес гідролізу полягає в переході іона від молекули води до даного іона
(СО32- + НОН ↔ НСО3- + ОН-) або від данного йона (NН4 + НОН ↔ NH3 + Н3О+), зокрема від гідратованого катіона металу [(Fе...ОН2)3+ + НОН ↔ (FеОН) 2+ + Н3О+)] до молекули води.. Залежно від природи соли вода виступає або як кислота, або як основа, а сіль є відповідно зарядженою основою або зв'язаною кислотою. Наприклад, при гідролізі Nа2СОз:
CO32- + HOH ↔ HCO3- + OH- Іонні реакції Багато хімічних реакцій протікають у водних розчинах. Якщо в цих реакціях беруть участь електроліти, то слід враховувати, що вони знаходяться у водному розчині в дисоційованому стані, т.т. або тільки і вигляді іонів (сильні електроліти) і частково у вигляді молекул (слабкі електроліти). Таким чином, реакції між водними розчинами електролітів - це реакції, в яких беруть участь іони. Тому такі реакції називаються іонними реакціями. Ці реакції можливі тільки в тому випадку, якщо між іонами відбувається хімічна взаємодія, тобто які-небудь іони одного електроліту і які-небудь іони іншого електроліту зв'язуються один з одним і утворюють: а) нерозчинна речовина; б) газоподібна речовина; в) мало дисоціююча речовина (слабкий електроліт). г) комплексні сполуки. При складанні іонних рівнянь реакцій слід керуватися тим, що речовини мало дисоційовані, малорозчинні (випадні в осад) і газоподібні зображуються в молекулярній формі. Стрілка вниз ↓, що стоїть при формулі речовини, означає, що речовина йде з сфери реакції у вигляді осаду, а стрілка вгору↑означає, що речовина віддаляється з сфери реакції у вигляді газу. Сильні розчинні електроліти, як повністю дисоційовані, пишуться у вигляді іонів. Сума електричних зарядів в лівій частині рівняння повинна бути рівна сумі електричних зарядів в правій частині. Напишемо рівняння реакції взаємодії розчинів хлориду барію і сульфату натрію в молекулярній, іонній і скороченій іонній формах. Розіб'ємо рішення задачі на чотири етапи. 1. Записуємо рівняння реакції в молекулярній формі:
ВаС12 + Nа2SO4 = ВаSО4↓ + 2NаСl
2. Переписуємо це рівняння, зобразивши добре диссоціюючі речовини у вигляді іонів, а реакції, що йдуть з сфери, - у вигляді молекул:
Ва2+ + 2С1- + 2Nа+ + SО42- = ВаSO4↓ + 2Nа+ + 2С1- Це іонне рівняння реакції. 3. Виключаємо з обох частин рівності однакові іони, тобто іони, що не беруть участь в реакції (підкреслені):
Ва2+ + 2С1 - + 2Nа + + SО42- = ВаSO4↓ + 2Nа + + 2С1 -
4. Виписуємо рівняння реакції в остаточному вигляді:
Ва2+ + SО42- = ВаSO4↓ Це скорочене іонне рівняння реакції. Як видно з цього рівняння, суть реакції зводиться до взаємодії іонів Ва2+ і SО42- внаслідок чого утворюється осад ВаSO4↓. При цьому зовсім не має значення, до складу яких електролітів ці іони входили до їх взаємодії. Іонними рівняннями можуть бути зображені будь-які реакції, що протікають в розчинах між електролітами. Якщо при таких реакціях не відбувається зміни зарядів іонів (не змінюється ступінь окислення), то вони називаються обмінними. Численні реакції обміну в розчинах електролітів діляться на необоротні і оборотні. Необоротними є реакції, якщо вони протікають по наступних схемах:
1. Реакція з відтворенням осадів, наприклад: AgNO3 + HCl = AgCl ↓ + HNO3
Ag+ + NO3- + H+ + Cl- = AgCl ↓ + H+ + NO3-
Ag+ + Cl- = AgCl ↓ 2. Реакція з утворенням газоподібних малорозчинних речовин, наприклад:
Nа2СO3 + Н2SO4 = Na2SO4 + СO2↑ + Н2О 2Nа+ + СО3- + 2Н+ + SО42- = 2Nа+ + SО42- + СO2↑ + Н2О СО3- + 2Н+ = СO2↑ + Н2О
3. Реакції з утворенням малодисоційованих речовин (слабких електролітів), наприклад:
НСl + КОН = КС1 + Н2О Н+ + С1- + К+ + ОН- = К+ + С1- + Н2О Н+ + ОН- = Н2О Таким чином, реакції обміну в розчинах електролітів практично необоротно протікають у бік утворення осадів (малорозчинних речовин), газів (легколетючих речовин), слабких електролітів (малодисоціюючих сполук). Решта реакцій обміну є оборотними.
Роль гидролиза в биохимических процессах трудно переоценить. Прежде всего необходимо отметить ферментативный гидролиз, благодаря которому три основных компонента пищи — жиры, белки, углеводы — в желудочно-кишечном тракте расщепляются водой на более мелкие фрагменты. В общем виде гидролиз пищевых компонентов описывается уравнением R1—О—R2 + Н2О → R1—ОН + R2—ОН Где R1,R2 — фрагменты биоорганической молекулы, связанные через кислород. Без этого процесса не было бы возможно усвоение пищевых продуктов, так как всасываться в кишечнике способны только относительно небольшие молекулы. Так, например, усвоение полисахаридов и дисахаридов становится возможным лишь после полного их гидролиза ферментами до моносахаридов. Точно так же белки и липиды гидролизуются до веществ, которые лишь потом могут усваиваться. Гидролиз АТФ. Для роста и нормального функционирования всем животным необходима энергия. Человек получает энергию как за счет многостадийного процесса окисления пищи — белков, жиров и углеводов, так и за счет гидролиза некоторых сложных эфиров, амидов, пептидов и гликозидов. Однако главным источником энергии для многих биологических процессов — биосинтеза белка, ионного транспорта, сокращения мышц, электрической активности нервных клеток — является аденозинтрифосфат (АТФ). АТФ принадлежит к бионеорганическим соединениям, так как состоит из органической части — аденозина и неорганической части — трех связанных в цепь фосфатных групп. Энергия, необходимая для жизнедеятельности, высвобождается вследствие гидролиза АТФ. При рН ≥7,0 АТФ существует в виде аниона АТФ4-, так как все фосфатные группы при этом значении рН ионизированы. Гидролиз АТФ записывают в виде кислотно-основного равновесия: АТФ4- + Н20 ↔ АДФ3- + НРО42- + Н+; ΔG° = —30,5 кДж/моль где АДФ3- — анион аденозиндифосфата. Реакция сопровождается убылью энергии Гиббса ΔG0 Роль гідролізу в біохімічних процесах важко переоцінити. Перш за все необхідно відзначити ферментативний гідроліз, завдяки якому три основні компоненти пищи, - жири, білки, вуглеводи - в шлунково-кишковому тракті розщеплюються водою на дрібніші фрагменти. У загальному вигляді гідроліз харчових компонентів описується рівнянням R1-О-R2 + Н2О → R1-ОН + R2-ОН Де R1,R2 - фрагменти біоорганічної молекули, зв'язані через кисень. Без цього процесу не було б можливе засвоєння харчових продуктів, оскільки всмоктуватися в кишечнику здатні тільки відносно невеликі молекули. Так, наприклад, засвоєння полісахаридів і дисахаридів стає можливим лише після повного їх гідролізу ферментами до моносахаридів. Так само білки і ліпіди гідролізуються до речовин, які лише потім можуть засвоюватися. Гідроліз АТФ. Для зростання і нормального функціонування всією твариною необхідна енергія. Людина отримує енергію як за рахунок багатостадійного процесу окислення їжі - білків, жирів і вуглеводів, так і за рахунок гідролізу деяких складних ефірів, амідів, пептидів і глікозидів. Проте головним джерелом енергії для багатьох біологічних процесів - біосинтезу білка, іонного транспорту, скорочення м'язів, електричній активності нервових клітин - є аденозинтрифосфат (АТФ). АТФ належить до біонеорганічних сполук, оскільки складається з органічної частини - аденозіна і неорганічної частини - трьох зв'язаних в ланцюг фосфатних груп. Енергія, необхідна для життєдіяльності, вивільняється унаслідок гідролізу АТФ. При рн ≥7,0 АТФ існує у вигляді аніона АТФ4-, оскільки всі фосфатні групи при цьому значенні рН іонізовані. Гідроліз АТФ записують у вигляді кислотний-основної рівноваги: АТФ4- + Н20 ↔ АДФ3- + НРО42- + Н+; ΔG° = -30,5 кдж/моль де АДФ3- - аніон аденозіндифосфату. Реакція супроводжується спадом енергії Гіббса ΔG0
Ступенем окислення елементу в сполуці називають формальний заряд атома елементу, обчислений з припущення, що валентні електрони переходять до атомів з більшою відносною електронегативністю (ВЕН) і всі зв'язки в молекулі сполуки є іонними. Ступінь окислення елементу Е указують вгорі над символом елементу із знаком
+7 «-» або «+» перед цифрою, наприклад Мn. Ступінь окислення іонів, що реально існують в розчині або кристалах, співпадає з їх зарядовим числом і позначається аналогічно із знаком «+» або «-» після цифри, наприклад Сl-, Са2+. Застосовують також метод Штока позначення ступеня окислення римськими цифрами після символу елементу: Мn(VII), Fе (III). Питання про знак ступеня окислення атомів в молекулі вирішується на підставі зіставлення електронегативностей зв'язаних між собою атомів, які утворюють молекулу. При цьому атом з меншою електронегативністю має позитивний ступінь окислення, а з більшою електронегативністю - негативну. Слід зазначити, що не можна ототожнювати ступінь окислення з валентністю елементу. Валентність, визначувана як число хімічних зв'язків, якими даний атом сполучений з іншими атомами, не може дорівнювати нулю і не має знаку «+» або «-». Ступінь окислення може мати як позитивні, так і негативні значення, а також приймати нульове і навіть дробне значення. Так, в молекулі СО2 ступінь окислення С рівна +4, а в молекулі СН4 ступінь окислення С рівна -4. Валентність же вуглецю і в тому і в іншому з'єднанні рівна 4. При окисленні елементу ступінь окислення збільшується, інакше кажучи, відновник при реакції підвищує ступінь окислення: + 2 +7 Мп = Мп + 5е- Навпаки, при відновленні елементу ступінь окислення знижується, тобто при реакції окислювач зменшує ступінь окислення:
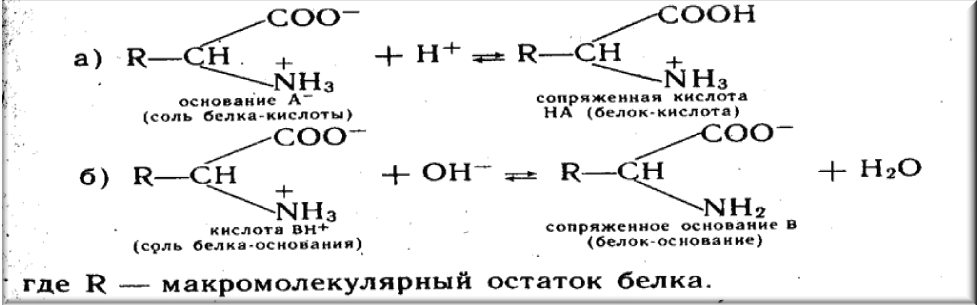
+5 -1 С1 + 6е- = С1 Таким чином, можна дати і таке формулювання окислювально-відновним реакціям: Буферними системами (буферами) називають розчини, що володіють властивістю достатньо стійко зберігати постійність концентрації водневих іонів як при додаванні кислот або лугів, - так і при розведенні. З погляду протонної теорії буферна дія розчинів обумовлена наявністю кислотно-основної рівноваги загального типу: В + Н+ ↔ ВН+. Основа зв'язана кислота
НА ↔ Н+ + А-. кислота зв'язана основа
Зв'язані кислотний-основні пари В/ВН+ і А- / НА називають буферними системами. Буферні розчини грають велику роль в життєдіяльності. До виняткових властивостей живих організмів належить їх здатність підтримувати постійність рн біологічних рідин, тканин і органів - кислотний-основний гомеостаз. Ця постійність обумовлена наявністю декількох буферних систем, що входять до складу цих тканин. Класифікація кислотний-основних буферних систем. Буферні системи можуть бути чотирьох типів. 1. Слабка кислота і її аніон А-/НА. Наприклад, ацетатна буферна система СН3СОО-/СН3СООН в розчині СН3СОONa і СНЗСООН, область дії - інтервал рН 3,8-5,8. Водень - карбонатна система НСО3-/Н2СОЗ в розчині NaНСОЗ і Н2СОЗ, область її дії - рН 5,4-7,4. 2. Слабка основа і її катіон В/ВН+. Наприклад, аміачна буферна система NНЗ/NН4+ в розчині NН3 і NН4Сl область її дії - рН 8,2-10,2. 3.Аніони кислої і середньої солі або двох кислих солей. Наприклад, карбонатна буферна система СОЗ2- /НСО3- в розчині Nа2СО3 і NаНСО3 (область її дії рН 9,3-11,3). Фосатная буферна система НРО42-/Н2РО4- в розчині Na2НРО4 NаН2РО4, область її дії рН 6,2-8,2. Ці сольові буферні системи можна віднести і до 1-го типу, оскільки одна з солей цих буферних систем виконує функцію слабкої кислоти. Так, у фосфатній буферній системі аніон Н2РО4- є слабкою кислотою. 4.Іони і молекули амфолітів. До них відносять амінокислотні і білкові буферні системи. Якщо амінокислоти або білки знаходяться в ізоелектричному стані (сумарний заряд молекули рівний нулю), то розчини цих сполук не є буферними. Вони починають проявляти буферну дію, коли до них додають деяку кількість кислоти або лугу. Тоді частина білка (амінокислоти) переходить з ізоелектричного стану у форму «білок-кислота» або відповідно у форму «білок-основа». При цьому утворюється суміш двох форм білка: а) слабка «білок - кислота» + сіль цієї слабкої кислоти; б) слабка «білок-основа» + сіль цієї слабкої основи:
Склад буферних сумішей. Буферні системи (суміші або розчини) по складу бувають двох основних типів: а) із слабкої кислоти і солі, утвореною слабкою кислотою і сильною основою; б) із слабкої основи і солі утвореною слабкою основою і сильною кислотою. Як приклад приводяться наступні буферні суміші:
СН3СООН + СН3СООNа — ацетатний буфер;
Н2СO3+NаНСО3 — бікарбонатний буфер;
NН4ОН + NH4С1 — аміачний буфер;
Білок-кислота (Рt —СООН) + білок-сіль (Pt -— СООNа) — білковий буфер;
NaН2РО4 + Nа2НРО4 — фосфатний буфер. Фосфатна буферна суміш складається з двох солей, одна з яких є однометалевою, а друга - двохметалевою сіллю фосфорної кислоти. Потрібно вказати, що буферні розчини можуть носити і змішаний характер, включаючи аніони різних слабких кислот, наприклад фосфатно - цитратний NaН2РО4 + С6Н8О7 (лимонна кислота). Визначення кислотний-основної рівноваги. На практиці порушення кислотний-основної рівноваги класифікують на підставі їх вимірювань в системі гідрокарбонат-вугільна кислота (основна буферна система позаклітинної рідини). Оскільки унутрі- і позаклітинна буферні системи функціонально зв'язані між собою, вимірювання тільки концентрації гідрокарбонату в плазмі дозволяє отримати інформацію про загальну буферну систему організму. Взаємозв'язок окремих елементів гідрокарбонатної системи зазвичай описують рівнянням Гендерсона-Гассельбаха: [НСО3-] рН = рК + lg ------------- [Н2СО3]
де рK (від’ємний десятинний логарифм константи дисоціації)вугільної кислоти складає 6,1. Величина [Н2СОЗ] розраховується як добуток a•ρСO2, де а-коеффіциент розчинності двоокису вуглецю в рідких середовищах організму, рівний 0,031 ммоль/л на 1 мм рт. ст. парціального тиску двоокису вуглецю. При нормальному ρСО2 (тобто 40 мм рт. ст.) розрахункова величина [Н2СО3] складатиме 40•0,031=1,2 ммоль/л.
5.2 Механізм буферної дії. Лужний резерв виміряється об'ємом хімічно зв'язаної СО2 (головним чином, у вигляді гідрокарбонатів) з 100 мл плазми крові, насиченої газом з парціальним тиском СО2 53,3 кПа (як в альвеолярному повітрі). Резервну лужність виражають в об'ємних частках хімічно зв'язаного в крові диоксида вуглецю, у нормі вона відповідає об'ємній частці 50-70% (або 25-30 моль/м3). Буферні системи, що перешкоджають різкому зниженню рН крові при надходженні в неї кислот, обмежують також і зростання рН у випадку надходження в кров лугів. У цьому випадку іони гідроксилу, що утворюються при дисоціації лугів або при гідролізі відповідних солей, взаємодіють з вільними кислотами Н2СО3, ННb і ННbО2 і іонами дигідрофосфата по схемах: Н2СО3 + NаОН ↔ NаНСО3 + Н2О NаН2РО4 + NаОН ↔ Nа2НРО4 + Н2О ННb + NаОН ↔ NaНb + Н2О ННbО2 + NaОН ↔ NаНbО2 + Н2О зі зрушенням рівноваг (1), (3) - (8) справа наліво. (див. пункт 5,3) З останніх двох співвідношень випливає, що при нормальному значенні рН крові тільки 13% із загального числа молекул гемоглобіну дисоційовано на іони Н+ і Нb-, у той час як оксигемоглобін у тих же самих умовах дисоційований на 72%. У більшій мірі буферним системам крові приходиться протидіяти зміні рН убік зменшення його значення, оскільки в процесі засвоєння їжі в організмі генерується значна кількість диоксида вуглецю (550-775 г/добу), при взаємодії якого з вологою утворюється вугільна кислота в кількості, еквівалентній надходженню від 25 до 35 моль/добу іонів гідрогену. Зниження рН у крові з відповідним зменшенням її лужного резерву сприяє також процес, який відбувається в легенях при перетворенні гемоглобіну в оксигемогло-бін: ННb + О2 ↔ ННbО2, оскільки ННbО2 більш сильна кислота, ніж ННb. Протидіє цьому збільшенню кислотності зворотний процес перетворення оксигемоглобіну в гемоглобін, що відбувається в капілярах тканин організму і спрямований на збільшення лужного резерву. Таким чином, буферні системи дозволяють живому організму, як відкритій стаціонарній системі, реалізувати принцип консервативності Ле Шателье - Брауна, протидіяти впливу зовнішніх факторів, спрямованих як на зниження, так і на збільшення рН рідких середовищ, тобто зберігати гомеостазис. Усі буферні системи крові і тканинних рідин утворюють єдину взаємозалежну систему. З огляду на цей взаємозв'язок, можна, наприклад, пояснити, чому на процеси поглинання кисню гемоглобіном і звільнення його оксигемоглобіном істотний вплив має диоксид вуглецю. Усередині еритроцитів існують рівноваги, які безпосередньо впливають одна на одну: ННbО2 ↔ ННb + О2 (9) ННbO2 ↔ Н+ + НbО2 (10) НbО2 ↔ Нb- + О2 (11)
Недисоційовані молекули ННbО2 віддають кисень (9) легше, ніж утворені ними іони НbО2 (11). Тому, коли у внутрішньому рідкому середовищі еритроцита через поглинання СО2 і утворення Н2СО3, що відбувається в тканинах, зростає концентрація Н+-іонів, це приводить до зрушення рівноваги (10) уліво - убік збільшення концентрації недисоційованих молекул ННbО2, і виділення в газову фазу О2 (9) підсилюється. Наявні в цьому ж водному середовищі іони Нb- реагують з вугільною кислотою з утворенням малодисоційованих молекул ННb і гідрокарбонат-іонів
Нb- + Н2СО3 ↔ ННb + HCO3-, причому останні, дифундуючи через оболонку еритроцитів у плазму, виносяться зі струмом крові. Коли венозна кров, збагачена гемоглобіном і містить в собі надлишок розчиненого диоксида вуглецю, повертається в легені, гемоглобін реагує з киснем і утворює оксигемоглобін. Причому Н+-іони, порівняно легко звільняються від оксигемоглобіну і зв'язуються з бікарбонат-іонами, утворюючи вільну вугільну кислоту. Значна частина цієї кислоти розпадається потім (термічна дисоціація) на воду і диоксид вуглецю:
ННbО2 + НСО3- ↔ НbО2 + Н2СО3 Н2СО3 ↔ СО2 + Н2О Із легень СО2 видаляється в атмосферу за рахунок легеневої вентиляції.
5.3 Буферна ємність. Буферні системи організму. Кислотно - основний стан крові. Буферна суміш підтримує постійним рН тільки при умові, що кількість сильної кислоти або сильної основи, що додаються до розчину, не перевищує визначеної фізичної величини. Межа, в якій виявляється буферна дія, називається буферною ємністю. Чисельне значення буферної ємності (В) визначається числом моль-еквівалентів сильної кислоти або основи, яку необхідно додати до 1 м3 буферної суміші, щоб змінити значення рН на одиницю, що можна виразити рівнянням:
С В = ----------------- рН2 - рН1
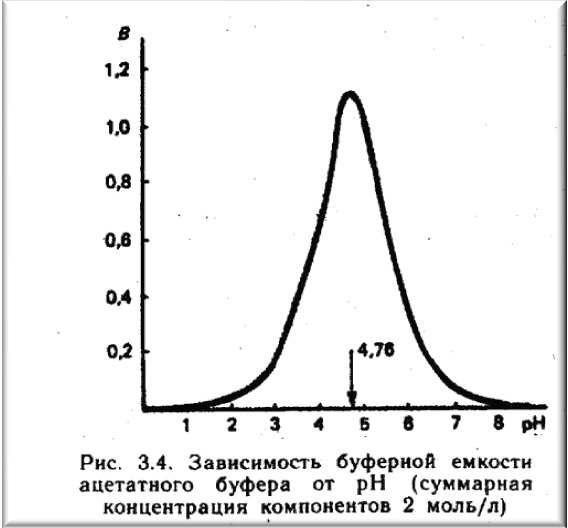
Величину, що характеризує здатність буферного розчину протидіяти зсуву реакції середовища при додаванні сильних кислот або сильних підстав, називають буферною ємністю розчину. На мал. 3.4 показаний типовий графік залежності буферної ємності від рН на прикладі ацетатної кислотно-основної системи СНЗСОО-/СНЗСООН. З даних, представлених на мал. 3.4, видно, що максимальна буферна емність, т. т. найбільша здатність цієї системи протистояти зміні рН, відповідає значенню рН = рКа = 4,76. Це витікає з рівняння Гендерсона - Гассельбаха. При рН == рКа відношення с (сіль) / с (кисл.) = 1, тобто в розчині є однакова кількість соли і кислоти. При такому співвідношенні концентрацій рН розчину змінюється у меншій мірі, чим при інших, і, отже, буферна ємність максимальна при рівних концентраціях компонентів буферної системи і зменшується з відхиленням від цього співвідношення. Мал. 3.4 демонструє і інший важливий момент. Робоча ділянка буферної системи, тобто здатність протидіяти зміні рН при додаванні кислот і лугів, має протяжність приблизно одну одиницю рН з кожного боку від точки рН = рКа. Поза цим інтервалом буферна ємність швидко падає до 0. Інтервал рН= рКа ± 1 називається зоною буферної дії.
Величина буферної ємності залежить від: а) концентрації компонентів буферної суміші; б) співвідношення між цими концентраціями. Зі збільшенням концентрації компонентів буферної суміші збільшується резерв, за допомогою якого утримується сталість рН. Найбільша величина буферної ємності будь-якої буферної суміші досягається при рівності еквівалентних концентрацій обох компонентів:
С солі = С кислоти або Ссолі = С лугу
У такому буферному розчині концентрація іонів гідрогену дорівнює константі дисоціації [Н+] = К або рН = рК. Стійкість буферного розчину, де [Н+] = К, визначається тим, що перехід визначеної кількості С лугу або кислоти з чисельника у знаменник або навпаки у цих умовах викликає мінімальну зміну у співвідношенні С кислота/Ссіль Таким чином, буферні суміші мають наступні властивості: 1. Концентрація іонів гідрогену буферних сумішей мало 2. Додавання до буферних сумішей невеликих кількостей 3. Величина буферної ємності залежить від концентрації ком- 4. Максимальна буферна дія виявляється у випадку, якщо кис- Буферні суміші мають велике значення для живих організмів, підтримуючи сталість рН у крові і тканинах. Буферною сумішшю крові є карбонатна суміш, що складається з NaНСО3 і СO2; фосфатна суміш, що складається з дигідрофосфату і гідрофосфату (NaН2РО4 + Na2НРО4); білкові буферні суміші - гемоглобін, альбуміни, глобуліни тощо. Велике значення для організмів має також сталість рН розчинів зовнішнього середовища Ґрунтові розчини також мають буферність, обумовлену вмістом у них гідрокарбонатів, фосфатів і ін. Буферні суміші знаходять застосування в хімічних лабораторіях при визначенні рН розчинів колориметричним (індикаторним) методом. Кислотно-лужна рівновага і головні буферні системи в організмі людини Організм людини має у своєму розпорядженні тонкі механізми координації фізіологічних і біохімічних процесів, що відбуваються в ньому, і підтримки сталості внутрішнього середовища (оптимальних значень рН і рівнів вмісту різних речовин у рідинах організму, температури, кров'яного тиску і тощо). Ця координація названа, за пропозицією В.Кеннона (1929), гомеостазисом (з грецької "гомео" - подібний; "стазис" - сталість, стан). Вона здійснюється шляхом гуморальної регуляції (з лат. "гумор" - рідина), тобто через кров, тканинну рідину, лімфу і т.д. за допомогою біологічно активних речовин (ферментів, гормонів і ін.) при участі нервових регулюючих механізмів. Гуморальні і нервові компоненти тісно взаємозалежні між собою, утворюючи єдиний комплекс нейрогуморальної регуляції Деякі сторони гомеостазису були вже розглянуті. Наприклад, прагнення організму до збереження сталості температури, ентропії, енергії Гіббса, вмісту в крові і міжтканинних рідинах різних катіонів, аніонів, розчинених газів, величини осмотичного тиску тощо. Зупинимося на ще одній з найважливіших сторін гомеостазису - на прагненні організму підтримувати для кожної з його рідин визначену оптимальну концентрацію іонів гідрогену Н+ (вірніше іонів гідроксонію Н3О+). Збереження сталості кислотності рідких середовищ має для життєдіяльності людського організму першорядне значення, тому що, по-перше, іони Н+ діють каталітичне на багато біохімічних перетворень; по-друге, ферменти і гормони виявляють біологічну активність тільки в строго визначеному інтервалі значень рН середовища; по-третє, навіть невеликі зміни концентрації іонів гідрогену в крові і міжтканинних рідинах відчутно впливають на величину осмотичного тиску в цих рідинах. Нерідко відхилення рН крові від нормального для неї значення 7,36 усього лише на декілька сотих призводить до неприємних наслідкіа При відхиленнях порядку 0,3 одиниці в ту або іншу сторону може наступити важкий коматозний стан, а відхилення порядку 0,4 одиниці можуть спричинити навіть смертельний результат. Утім, у деяких випадках, при ослабленому організмі, для цього виявляються достатніми і відхилення порядку 0,1 одиниці рН. Підтримка постійного рівня рН у крові і тканинних рідинах досягається за допомогою регуляторних механізмів, що включають кілька буферних систем. Самими головними з них є наступні. 1. Гідрокарбонатна (бікарбонатна) буферна система, що характеризується рівновагою між молекулами слабкої вугільної кислоти з утвореними при її дисоціації гідрокарбонат-іонами: Н2СО3 ↔ НСОз - + Н+ (1)
НСОз - + Н2О ↔ Н2СО3 + Н+ (2) В організмі вугільна кислота виникає в результаті гідратації диоксиду вуглецю - продукту окиснення вуглеводів, білків і жирів. Причо
|
||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 792; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.107.159 (0.013 с.) |

 Непропорційний вміст елементів в організмі пояснюється тим, що на засвоєння елементів впливає розчинність їх природних з'єднань у воді. Природні сполуки кремнію SiО2, алюмінію Аl2О3 практично нерозчинні, тому вони не засвоюються живими організмами. Спостерігається і зворотна картина, наприклад, вуглець в незначних кількостях міститься в земній корі (0,35%), а по вмісту в живих організмах займає 2-е місце (21 %).
Непропорційний вміст елементів в організмі пояснюється тим, що на засвоєння елементів впливає розчинність їх природних з'єднань у воді. Природні сполуки кремнію SiО2, алюмінію Аl2О3 практично нерозчинні, тому вони не засвоюються живими організмами. Спостерігається і зворотна картина, наприклад, вуглець в незначних кількостях міститься в земній корі (0,35%), а по вмісту в живих організмах займає 2-е місце (21 %).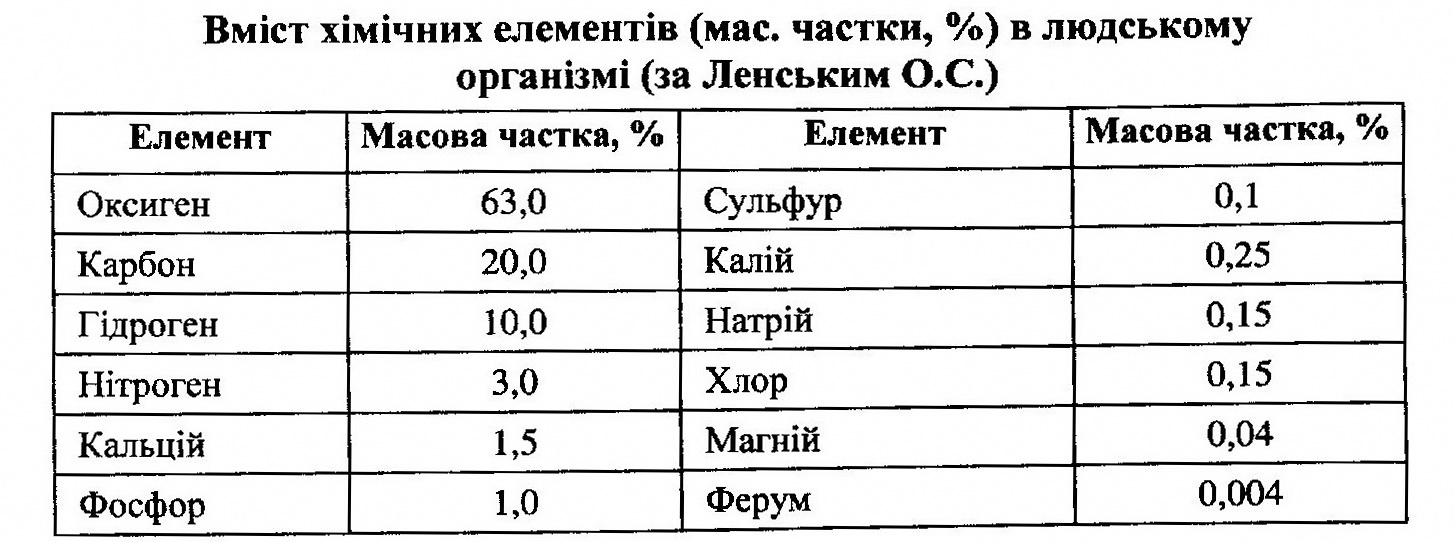
 де С - кількість лугу або кислоти (кмоль-екв/м3), що додається до буферного розчину, а рН2 – рН1 - водневий показник до і після додавання кислоти або лугу.
де С - кількість лугу або кислоти (кмоль-екв/м3), що додається до буферного розчину, а рН2 – рН1 - водневий показник до і після додавання кислоти або лугу.


