
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослiд 2. Приготування розчинiв заданої молярної або нормальної концентрацiї.Содержание книги
Поиск на нашем сайте
а) З твердої речовини i води: ü Одержати вiд викладача завдання, яке заключається в приготуваннi певного об’єму V (мл) розчину солi вказаної концентрацiї СМ або Cн. ü Розрахувати, яка маса солi необхiдна для приготування такого розчину. ü Вiдважити в попередньо зваженому стаканчику цю масу солi на вагах з точнiстю до 0,01 г. ü Взяту наважку висипати через лійку в мiрну колбу необхiдної ємностi i змити дистильованою водою з лійки сiль, що в нiй залишилася. ü Наважку солі в колбi розчинити спочатку в малому об’ємі води, потiм долити воду до мiтки на колбi, закрити пробкою i добре перемiшати. ü Перенести одержаний розчин в сухий високий цилiндр i визначити ареометром його густину i w (%). Потiм розчин вилити в склянку. ü Обчислити молярну i нормальну концентрацiю одержаного розчину. Встановити розходження значень концентрацiї одержаного розчину з заданою. б) З концентрованого розчину i води: ü Одержати завдання вiд викладача, яке заключається в приготуваннi певного об’єму (мл) розчину сiрчаної (або соляної) кислоти вказаної молярної чи нормальної концентрацiї з розчину, що є в наявностi в лабораторiї. ü Виміряти ареометром густину розчину кислоти, яка є в лабораторiї. По таблицi 2 знайти w (%), що відповідає виміряній густині. ü Розрахувати масу, а потiм об’єм цього розчину, який необхiдний для приготування заданого розчину. ü Вiдмiряти мiрним цилiндром розрахований об’єм розчину кислоти. В мiрну колбу відповідної ємностi налити води (близько половини її об’єму), а потім влити у воду (у випадку сiрчаної кислоти тонким струменем) через лійку розчин кислоти, відміряний мiрним цилiндром. Змити кислоту з лійки водою, сколотити розчин i охолодити його до кiмнатної температури. Долити воду в колбу до мiтки, закрити пробкою i перемiшати. ü Вилити одержаний розчин в сухий високий цилiндр, визначити ареометром його густину i потiм вилити в склянку для здачi лаборанту. ü Знайти w (%), молярну i нормальну концентрацiю розчину. Порiвняти розраховану молярну концентрацiю з заданою, встановити точнiсть виконання дослiду.
Дослiд 3. Буфернi розчини. а) Приготуйте по 5 мл ацетатної буферної сумiшi (CH3COOH+CH3COONa) та амонiйної буферної сумiшi (NH4OH+NH4Cl) з концентрацiєю компонентiв 0,1 моль/л. В окремих пробах визначте рН цих розчинiв з допомогою унiверсального iндикатору i порiвняйте результати з розрахованими значеннями. б) Вiзьмiть двi пробiрки i помiстiть в кожну по 1 мл виготовленої ацетатної буферної сумiшi. В одну пробiрку помiстiть 1 краплю 1 н. розчину HCl, а в другу – 1 краплю 1 н. розчину NaOH. Визначте рН цих розчинiв з допомогою унiверсального iндикатора. Аналогiчний дослiд проведiть з чистою водою. в) Налийте в одну пробiрку 1 мл ацетатної, а в другу – 1 мл амонiйної буферної сумiшi. Розбавте водою вмiст пробiрок в 100 раз. Чи міняється рН при розведеннi розчину?
Дослiд 4. Гiдролiз солей. а) Визначте рН i концентрацiю Н+-iонiв в 0,1 н. розчинах солей Na2CO3, Al2(SO4)3, NH4CH3COO, NaCl. Напишiть рiвняння гiдролiзу цих солей. Вкажiть характер середовища (кисле, нейтральне, лужне). Результати зведiть в табличку:
Визначення рН розчину проводіть наступним чином: налийте в пробiрку 5-6 крапель дослiджуваного розчину i добавте туди 2 краплi фенолфталеїну, при цьому розчин або забарвиться в червоно-малиновий колiр, або залишиться незабарвленим. Якщо розчин забарвився в червоно-малиновий колiр, то його рН>10 (при свiтло-рожевому забарвленнi розчину рН=9). Щоб бiльш точно встановити рН, потрiбно в окремi проби дослiджуваного розчину добавляти 1-2 краплi унiверсального iндикатору. Якщо пiсля добавлення крапель фенолфталеїну розчин залишається безбарвним, то його рН<8. Тодi до окремих порцiй розчинiв слiд добавляти по 1-2 краплi метилоранжу, який при рН>4 забарвлює розчин в жовтий колiр, а при рН<3 – в червоний. Для бiльш точного встановлення рН слiд скористатися унiверсальним iндикатором. б) Залежнiсть гiдролiзу вiд температури проiлюструйте наступним чином. В пробiрку з розчином ацетату натрію добавте двi краплi фенолфталеїну, а потiм нагрiйте пробiрку, помiстивши її в стакан з киплячою водою. Нагрiвання проводьте до появи забаврвлення. Який висновок можна зробити на основi проведеного дослiду? в) В пробiрку з розчином Al2(SO4)3 долийте розчин (NH4)2S, а в пробiрку з розчином FeCl3 – Na2CO3. Нагрiйте пробiрку, не доводячи до кипiння. Пояснiть причину появи осадiв. г) Визначте рН насиченого розчину CuSO4. Інтерпретуйте результат. д) Контрольне завдання: Колбу на 25-50 мл здайте викладачу для одержання розчину, рН якого необхiдно визначити. Результат дослiдження вкажiть викладачу.
ОКИСНО-ВІДНОВНІ ПРОЦЕСИ ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ КОРОЗІЯ
Програмні вимоги до теми: Хімічні реакції та принципи їх класифікації. Ступінь окиснення, окисник, відновник, процес окиснення, процес відновлення. Окисно-відновні реакції. Класифікація окисно-відновних реакцій. Зміна окисно-відновних властивостей простих речовин в залежності від положення відповідних елементів в періодичній системі Д.І.Менделєєва. Правила розстановки коефіцієнтів методом електронного та електронно-іонного балансу. Вплив середовища на протікання окисно-відновних реакцій. Визначення еквівалентних мас окисника і відновника. Поняття про електродні потенціали і методи їх визначення. Ряд стандартних електродних потенціалів. Водневий електрод і вимірювання електродних потенціалів металів. Залежність електродного потенціалу від концентрації і температури. Рівняння Нернста. Будова і принцип роботи гальванічних елементів. Електроліз. Поняття “катод”, “анод”, “катіон”, “аніон”, “катодний процес”, “анодний процес”. Електроліз розплавів солей Електроліз водних розчинів солей на інертних та розчинних електродах. Фактори, що визначають характер катодного та анодного процесів при електролізі водних розчинів електролітів. Закони Фарадея. Вихід по струму. Визначення і класифікація корозійних процесів. Хімічна корозія. Електрохімічна корозія. Захист металів від корозії.
Короткий виклад теоретичних питань:
Фізичний зміст поняття ступеня окиснення (с.о.): · с.о. якогось елементу в сполуці +n означає, що атом даного елементу віддав n електронів на утворення зв’язків (нестача електронів); · с.о. якогось елементу в сполуці –n означає, що атом даного елементу при утворенні зв’язків прийняв n електронів (надлишок електронів); · с.о. 0 означає, що кількість протонів і електронів у атому рівна, а молекула утворена за рахунок ковалентних неполярних зв’язків (такий ступінь окиснення властивий простим речовинам). Правила встановлення с.о. елементу в сполуці: · молекула в цілому електронейтральна (алгебраїчна сума позитивних та негативних зарядів атомів в молекулі дорівнює нулю); · алгебраїчна сума позитивних і негативних с.о. всіх атомів, що утворюють складний іон, дорівнює заряду іона; · с.о. елементу в простих речовинах дорівнює нулю; · с.о. Оксигену в усіх сполуках дорівнює –2 (крім пероксидів типу · с.о. Гідрогену в усіх сполуках дорівнює +1 (крім гідридів типу Na · с.о. катіонів металів в основах та солях співпадає з зарядом катіону; · с.о. елементів, що входять в склад аніону солі, така ж, як і у аніоні відповідної кислоти; · с.о. лужних металів в сполуках завжди +1, лужноземельних – +2, Алюмінію – +3; · с.о. Флуору в сполуках завжди –1. Слід мати на увазі, що позитивний ступінь окиснення не може перевищувати величину, що дорівнює номеру групи періодичної системи.
Користуючись цими правилами, в результаті нескладних арифметичних підрахунків можна оцінити с.о. атомів, які утворюють молекули чи іони. Алгебраїчний спосіб визначення ступеня окиснення показано на прикладі відомих сполук Сульфуру: H2S: SО2: H2SО4: Йон SО42–: Na2S2O7: З розглянутих прикладів видно, що виконується така послідовність операцій: 1) над символами елементів проставляють відомі з правил с.о.; при цьому визначуваний с.о. позначають x; 2) складають рівняння з одним невідомим x: для цього заряд кожного елементу (вказаний в круглих дужках) множиться на кількість атомів цього елементу, складається алгебраїчна сума цих зарядів в сполуці, яка прирівнюється до 0 для сполуки або дорівнює його заряду для іона. 3) розв’язують рівняння з одним невідомим і визначають x, тобто значення с.о. елементу.
Нижче в таблиці приведено відповідні приклади реакцій:
У процесі окисно-відновної реакції частина електронів від атомів одного елементу переміщується до атомів іншого елементу. Це означає, що в процесі реакції одні атоми віддають електрони, а інші – їх приймають. У відповідності з хімічною термінологією процес віддачі електронів прийнято називати процесом окиснення, а процес приймання електронів – процесом відновлення. Речовини, що містять атоми, які в процесі реакції віддають електрони, прийнято називати відновниками, а речовини, що містять атоми, які в процесі реакції приймають електрони, прийнято називати окисниками. а) процеси окиснення
таким чином, при окисненні ступінь окиснення атома-відновника підвищується; б) процеси відновлення:
таким чином, при відновленні ступінь окиснення атома-окисника понижується. Окиснення і відновлення – це такі два напівпроцеси, одночасне протікання яких забезпечує реалізацію єдиного окисно-відновного процесу. З приведених прикладів видно, що в рівняннях напівпроцесів переходу електронів прийнято зображати цілу молекулу, якщо всі її атоми є учасниками окисно-відновного процесу (O2, Br2).
Сполуки, що містять атоми з максимальним ступенем окиснення атома елемента можуть бути тільки окисниками, тому що вони уже віддали усі свої валентні електрони і здатні тільки приймати електрони. Максимальний ступінь окиснення атома елемента дорівнює номеру групи в періодичній таблиці, до якої відноситься даний елемент. Мінімальний ступінь окиснення атомів металів дорівнює 0, а неметалів – (n-8) (де n – номер групи періодичної системи). Сполуки, що містять атоми елементів із проміжним ступенем окиснення, можуть бути як окислювачами, так і відновниками в залежності від сполуки, з якою взаємодіють, та від умов реакції. Нижче в таблиці вказані найважливіші відновники й окисники:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 439; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.33 (0.012 с.) |

 Ступенем окиснення прийнято називати заряд атома в молекулі, розрахований на основі припущення, що всі зв’язки в молекулі носять іонний характер, тобто, що зв’язок між атомами в молекулі виникає за рахунок переходу електрона від менш електронегативного до більш електронегативного атома. У простих речовинах ступінь окиснення завжди дорівнює нулю, оскільки всі атоми мають одинакову електронегативність. У сполуках ступені окиснення елементу можуть мати як позитивні значення (у випадку зміщення електронів від даного атома), так і негативні (у випадку зміщення електронів до даного атома). Тому в сполуці негативний ступінь окиснення мають елементи, електронегативнь яких більша, а позитивний – ті елементи, електронегативність яких менша. Ступінь окиснення не завжди співпадає з валентністю. Наприклад, у гідразині
Ступенем окиснення прийнято називати заряд атома в молекулі, розрахований на основі припущення, що всі зв’язки в молекулі носять іонний характер, тобто, що зв’язок між атомами в молекулі виникає за рахунок переходу електрона від менш електронегативного до більш електронегативного атома. У простих речовинах ступінь окиснення завжди дорівнює нулю, оскільки всі атоми мають одинакову електронегативність. У сполуках ступені окиснення елементу можуть мати як позитивні значення (у випадку зміщення електронів від даного атома), так і негативні (у випадку зміщення електронів до даного атома). Тому в сполуці негативний ступінь окиснення мають елементи, електронегативнь яких більша, а позитивний – ті елементи, електронегативність яких менша. Ступінь окиснення не завжди співпадає з валентністю. Наприклад, у гідразині  ступінь окиснення Нітрогену +2, а валентність 3.
ступінь окиснення Нітрогену +2, а валентність 3.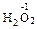 , Na2
, Na2  , надпероксидів типу
, надпероксидів типу  , сполук Оксигену з Флуором (
, сполук Оксигену з Флуором ( F2,
F2,  F2);
F2); );
); (+1)·2 + (x)·1 = 0 x = –2 Н2
(+1)·2 + (x)·1 = 0 x = –2 Н2 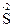

 (x)·1 + (–2)·2 = 0 x = +4
(x)·1 + (–2)·2 = 0 x = +4  О2
О2
 (+1)·2 + (x)·1 + (–2)·4 = 0 x = +6 Н2
(+1)·2 + (x)·1 + (–2)·4 = 0 x = +6 Н2  О4
О4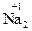

 (+1)·2 + (x)·2 + (–2)·7 = 0 x = +6 Na2
(+1)·2 + (x)·2 + (–2)·7 = 0 x = +6 Na2  Одні хімічні реакції відбуваються із зміною ступенів окиснення елементів вихідних речовин, інші – без такої зміни. Реакції, що супроводжуються зміною ступенів окиснення елементів називають окисно-відновними.
Одні хімічні реакції відбуваються із зміною ступенів окиснення елементів вихідних речовин, інші – без такої зміни. Реакції, що супроводжуються зміною ступенів окиснення елементів називають окисно-відновними.
 CuO + H2O
CuO + H2O



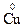 – 2
– 2  ®
® 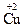
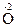 – 2
– 2  º 2
º 2  – 1
– 1  º 2
º 2  + 2
+ 2  ®
® 


