
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічна кінетика і рівновагаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Програмні вимоги до теми: Термодинамічні системи. Параметри, що характеризують стан системи. Поняття про функцію стану системи. Фізичний зміст внутрішньої енергії системи як функції стану. Ентальпія системи. Тепловий ефект реакції. Одиниці вимірювання теплового ефекту реакції. Термохімічні рівняння реакції. Екзотермічний та ендотермічний процес. Стандартна ентальпія утворення хімічної сполуки. Закон Гесса і наслідки з нього. Ентропійний фактор процесу. Стандартна ентропія речовини. Ізобарно-ізотермічний потенціал та енергія Гіббса. Швидкість хімічної реакції. Середня і дійсна швидкість хімічної реакції. Гомогенні та гетерогенні хімічні реакції. Фактори, що впливають на швидкість хімічних реакцій. Закон діючих мас. Константа швидкості хімічної реакції. Фізичний зміст константи швидкості. Закон діючих мас для гетерогенних реакцій. Залежність швидкості хімічної реакції від температури. Температурний коефіцієнт швидкості хімічних реакцій. Активні молекули. Енергія активації хімічної реакції. Вплив величини енергії активації на швидкість реакції. Класифікація хімічних реакцій по числу часток, що приймають участь в ній участь. Ланцюгові реакції. Механізм їх проходження. Каталіз. Каталізатори та інгібітори. Вплив каталізатора на енергію активації хімічної реакції. Гомогенний і гетерогенний каталіз. Вибіркова дія каталізатора. Механізм гомогенного і гетерогенного каталізу. Роль адсорбції в гетерогенному каталізі. Каталітичні отрути і промотори. Оборотні та необоротні хімічні реакції. Стан хімічної рівноваги. Константа хімічної рівноваги. Особливості вираження константи рівноваги для гетерогенних хімічних реакцій. Зв’язок константи рівноваги з енергією Гіббса. Умови, що впливають на зміну хімічної рівноваги. Принцип Ле-Шательє. Вплив зміни температури, тиску і концентрації на зміщення рівноваги.
Короткий виклад теоретичних питань:
Важливим завданням хімії є вивчення процесів перетворення речовин – хімічних реакцій. Хімічна термодинаміка вивчає переходи хімічної енергії в інші форми – теплову, електричну і т.п., встановлює кількісні закони для переходів, а також напрямок і межі самовільного протікання хімічних реакцій при заданих умовах.
Об’єктом вивчення в термодинаміці є система. Системою називають сукупність речовин, що знаходяться у взаємодії, відокремлену від навколишнього середовища. Розрізняють гомогенні і гетерогенні системи. Гомогенні системи складаються з одної фази, гетерогенні – з двох або декількох фаз. Фаза – це частина системи, однорідна у всіх точках по складу і властивостях і відділена від інших частин системи поверхнею розділу. Одна і та ж система може знаходитися в різних станах. Кожен стан системи характеризується певним набором значень термодинамічних параметрів. До термодинамічних параметрів належать температура, тиск, концентрація і т.п. Зміна хоча б тільки одного термодинамічного параметру приводить до зміни стану системи в цілому. Термодинамічний стан системи називають рівноважним, якщо вона характеризується сталістю термодинамічних параметрів у всіх точках системи і самовільно не змінюється. В хімічній термодинаміці властивості системи розглядаються в її рівноважних станах. Уявимо, що деяка система У переходить із рівноважного стану 1, що характеризується температурою Т 1 і тиском р 1 в рівноважний стан 2, що характеризується температурою Т 2 і тиском р 2. Вивчення швидкості процесу переходу системи У із рівноважного стану 1 в рівноважний стан 2 і його молекулярного механізму – область хімічної кінетики. Хімічна термодинаміка вивчає систему в двох рівноважних станах (кінцевому і початковому) і на цій основі визначає можливість (або неможливість) самовільного проходження процесу при заданих умовах у вказаному напрямку, характеризує енергетику змін, що відбуваються в результаті переходу, встановлює значення температури, тиску, концентрації речовин у системі, при яких досягається максимальний вихід продуктів реакції. В залежності від умов переходу системи з одного стану в інший в термодинаміці розрізняють ізотермічні (протікають при постійній температурі), ізобаричні (протікають при постійному тиску), ізохоричні (протікають при постійному об’ємі), адіабатичні (протікають в умовах відсутності обміну теплотою між системою і навколишнім середовищем) процеси. Хімічні реакції часто протікають в ізобарно-ізотермічних умовах (р = const; T = const). Такі умови дотримуються, коли взаємодія між речовинами відбувається у відкритих посудинах без нагрівання.
Внутрішня енергія (U) системи – це її повна енергія, яка включає кінетичну і потенціальну енергію молекул, атомів, ядер і електронів. Вона включає в себе енергію поступального, обертального та коливного рухів, а також енергію, обумовлену силами притягання й відштовхування, що діють між молекулами, атомами і внутрішньоатомними частками. Вона не включає потенціальну енергію положення системи в просторі і кінетичну енергію руху системи як цілого. Абсолютна внутрішня енергія системи не може бути визначена, але можна виміряти її зміну D U при переході з одного стану в інший. Внутрішня енергія є термодинамічною функцією стану системи. Це значить, що всякий раз, коли система знаходиться в даному стані, її внутрішня енергія приймає властиве даному стану значення. Тому зміна внутрішньої енергії не залежить від шляху і способу переходу системи з одного стану в інший і визначається різницею значень внутрішньої енергії системи в цих двох станах D U = U 2– U 1,де U 2 і U 1 – внутрішня енергія системи в кінцевому і початковому станах відповідно.
Система може обмінюватися із зовнішнім середовищем речовиною і енергією у формі теплоти Q і роботи А. Якщо цього обміну нема, то систему називають ізольованою. Теплота і робота характеризують якісно і кількісно дві різні форми передачі енергії від одного тіла до іншого. Теплота є мірою енергії, що передається від одного тіла до іншого за рахунок різниці температур цих тіл. Переносу речовини при цьому не відбувається. Робота є мірою енергії, що передається від одного тіла до іншого за рахунок переміщення мас під дією яких-небудь сил. У хімічній термодинаміці додатними вважають теплоту, яку підводять до системи, і роботу, яку здійснює система проти зовнішніх сил. Теплота і робота не є функціями стану системи і мають значення тільки в процесі переходу системи з одного стану в інший. Теплота і робота є функціями шляху переходу. Перший закон термодинаміки: Теплота, підведена до системи, витрачається на збільшення її внутрішньої енергії чи здійснення системою роботи над зовнішнім середовищем: Q = D U + А (1). Оскільки величини Q і А піддаються безпосередньому вимірюванню, то з допомогою рівняння (1) можна розрахувати значення D U.
У зв’язку з тим, що для хімічних взаємодій найбільш характерною є робота розширення, її виділяють із загальної суми всіх видів роботи: А = А ¢+ р D V (р = const) (2), де А ¢ – всі види роботи, крім роботи розширення; р – зовнішній тиск; D V – зміна об’єму системи (D V = V 2– V 1), де V 2 – об’єм продуктів реакції; V 1 – об’єм вихідних речовин. Якщо при проходженні того чи іншого процесу робота розширення є єдиним видом роботи, то рівняння 2 матиме вигляд А = р D V (3). Тоді Q Р = D U + р D V (4), де Q Р – теплота, підведена до системи при сталому тиску. З врахуванням того, що D U = U 2– U 1 і D V = р (V 2– V 1), рівняння (4) можна записати так: Q Р = U 2– U 1+ р (V 2– V 1) = (U 2+ рV 2)–(U 1+ рV 1) (5). Суму (U + рV) називають ентальпією системи і позначають буквою Н. Н = U + рV (6), тоді Q Р = Н 2– Н 1 = D Н, тобто теплота, підведена до системи при постійному тиску, витрачається на приріст ентальпії системи. Як і для внутрішньої енергії, абсолютне значення ентальпії визначити експериментально неможливо, але можна, вимірявши Q Р, знайти зміну ентальпії D Н при переході системи з одного стану в інший. Оскільки значення D Н визначається різницею (Н 2– Н 1) і не залежить від шляху і способу проведення процесу, ентальпію, як і внутрішню енергію, відносять до термодинамічних функцій стану системи. Поряд з внутрішньою енергією U та ентальпією Н до термодинамічних функцій стану системи відносять ентропію (S), енергію Гіббса (G) та енергію Гельмгольца (F). Якщо хімічна реакція відбувається в автоклаві (ізохоричний процес, V = сonst), і система не виконує роботи, в тому числі і роботи розширення, тобто D V = 0, то вся підведена до системи теплота витрачається на приріст її внутрішньої енергії: Q V = D U (7).
Тепловим ефектом хімічної реакції називають алгебраїчну суму поглинутої при реакції теплоти і здійсненої роботи без врахування роботи проти сил зовнішнього тиску (р D V). Якщо реакція проходить в ізохорно-ізотермічних умовах і при цьому не здійснюється робота (А = 0), то тепловий ефект реакції дорівнює зміні внутрішньої енергії системи, і, відповідно, не залежить від шляху процесу: Q Р,Т = D U = U 2– U 1 (8), де U 2 – внутрішня енергія продуктів реакції; U 1 – внутрішня енергія вихідних речовин. Якщо реакція проходить в ізобарно-ізотермічних умовах і при цьому виконується тільки робота розширення, то тепловий ефект реакції дорівнює зміні ентальпії системи, і, відповідно, не залежить від шляху процесу: Q Р,Т = D Н = Н 2– Н 1, де Н 2 – ентальпія продуктів реакції; Н 1 – ентальпія вихідних речовин
Незалежність теплоти хімічної реакції від шляху процесу при р = const і Т = const була висловлена в першій половині ХІХ століття Г.І.Гессом: Тепловий ефект хімічної реакції не залежить від шляху її протікання, а залежить тільки від природи і фізичного стану вихідних речовин і продуктів реакції. Закон Гесса справедливий для процесів, які протікають в ізобарно-ізотермічних або ізохорно-ізотермічних умовах при умові, що єдиним видом роботи є робота проти сил зовнішнього тиску. Розділ хімічної термодинаміки, що вивчає теплові ефекти реакцій, називається термохімією. Якщо теплота підводиться до системи (Q Т > 0), реакцію називають ендотермічною, якщо ж теплота виділяється в навколишнє середовище (Q Т < 0), реакцію називають екзотермічною.
Рівняння хімічних реакцій, в яких наведені їх теплові ефекти і агрегатний стан речовин, що приймають участь в реакціях, називаються термохімічними рівняннями. В термохімії використовують дві форми запису термохімічних рівнянь: 1) коли теплота реакції вказується в правій частині термохімічного рівняння, наприклад, С6Н6(р)+7 2) коли тепловий ефект реакції записують у вигляді зміни ентальпії D Н, наприклад, 2С6Н6(р)+15О2 = 12СО2+6Н2О(р) D Н = –6535,4 кДж; тоді при D Н < 0 – реакція екзотермічна; при D Н > 0 – реакція ендотермічна. Щоб тепловий ефект реакції був віднесений до кількості 1 моль однієї з вихідних речовин або продуктів реакції, в термохімічних рівняннях допускається використання дробових коефіцієнтів. Ентальпією (теплотою) утворення хімічної сполуки D Н Т називається зміна ентальпії в процесі одержання одного моля цієї сполуки з простих речовин, стійких при даній температурі.
Стандартним станом газоподібної речовини при даній температурі є стан газу, тиск якого рівний 101 кПа, при умові, що газ має властивості, характерні для нього при тій же температурі і нескінчено малому тиску. Стандартним станом розчиненої речовини при даній температурі буде його стан, що відповідає концентрації 1 моль/л, при умові, що розчин має властивості, якими він володів би при тій же температурі і нескінчено великому розведенні. Стандартною ентальпією (теплотою) утворення хімічної сполуки називають зміну ентальпії в процесі утворення одного моля цієї сполуки з простих речовин, що знаходяться в стандартних станах і термодинамічно стійкі при даній температурі. Стандартні ентальпії утворення простих речовин приймають рівними нулю.
В основі більшості термохімічних розрахунків лежить наслідок із закону Гесса – тепловий ефект хімічної реакції дорівнює сумі теплот (ентальпій) утворення продуктів реакції мінус сума теплот (ентальпій) утворення вихідних речовин. При проведенні розрахунків необхідно враховувати стехіометричні коефіцієнти в рівняннях реакцій. Так, для реакції aА+bB = cC+dD D Н = (cD Н утв.(С) +dD Н утв.(D))–(аD Н утв.(А)+bD Н утв.(В))
При вивченні хімічних взаємодій дуже важливо оцінити можливість чи неможливість їх самовільного протікання при заданих умовах. Повинен існувати критерій, з допомогою якого можна було би встановити можливість принципового здійснення реакції, її напрямок і межу самовільного протікання при тих чи інших температурах і тисках. Перший закон термодинаміки такого критерію не дає. Тепловий ефект реакції не визначає напрямок процесу: самовільно можуть проходити як екзо-, так і ендотермічні реакції. Критерій самовільного проходження процесу в ізольованих системах дає другий закон термодинаміки. Для характеристики стану деякої кількості речовини, що є сукупністю дуже великого числа молекул, можна вказати температуру, тиск або інші термодинамічні параметри стану системи або вказати миттєві координати кожної молекули (xi,, yi,, zi) і швидкості їх руху по трьох напрямках (v
Ізольовані системи не обмінюються з зовнішнім середовищем ні теплотою, ні роботою. В ізольованих системах самовільно проходять тільки ті процеси, які супроводжуються ростом ентропії системи: D S > 0 (D S = S 2– S 1). Рушійною силою процесу, що проходить в ізобарно-ізотермічних умовах, може бути прагнення системи перейти в стан з мінімальною енергією, тобто зменшити ентальпію (D Н < 0), або намагання системи перейти в стан з найбільшою термодинамічною імовірністю, тобто збільшити ентропію (D S > 0). Якщо процес проходить таким чином, що D Н = 0, то зростання ентропії є його єдиною рушійною силою. І навпаки, якщо D S = 0, то рушійною силою процесу є зменшення ентальпії. В зв’язку з цим можна говорити про ентальпійний D Н і ентропійний Т D S фактори процесу. Найбільш стійкий стан системи відповідає D Н = Т D S. В якості хімічної спорідненості використовують максимальну роботу А Максимальна робота А При р,T = const самовільно проходять хімічні реакції, для яких D Gр,T < 0. При V,T = const самовільно протікають реакції, для яких D FV,T < 0. Cтан рівноваги хімічної реакції характеризується D G Р,T = 0. Константа рівноваги К Р зв’язана з D G Р,T таким співвідношенням: D G
Розділ хімії, що вивчає механізм молекулярних хімічних реакцій і швидкість їх проходження, називається хімічною кінетикою. В хімічній кінетиці взаємодії класифікують або по принципу молекулярності або по принципу порядку реакцій. Молекулярність реакцій визначається числом молекул, які одночасно приймають участь в елементарній хімічній реакції. По цьому принципу розрізняють мономолекулярні, бімолекулярні, тримолекулярні реакції. Реакції більш високої молекулярності невідомі. Мономолекулярна: I2 Þ 2I Бімолекулярна: 2HI Þ H2+I2 Тримолекулярна: 2NO+H2 Þ N2O+H2O Порядок реакції визначається залежністю швидкості реакції від концентрації кожної з вихідних речовин в умовах сталості температури. Загальним порядком реакції є сума показників ступенів при концентраціях в кінетичному рівнянні реакції.
Швидкістю хімічної реакції (v) називають зміну кількості реагуючих речовин за одиницю часу в одиниці реакційного простору. В гомогенній системі реакційним простором є об’єм. Швидкість реакції вимірюється зміною концентрації однієї з речовин, що приймають участь у реакції за одиницю часу: v = ±
П ри постійній температурі швидкість гомогенної хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, взятих у степенях, рівних стехіометричним коефіцієнтам в рівнянні реакції (закон діючих мас). Так, швидкість реакції a A+ b B = m M+ n N v = kC A a·C B b, де v – швидкість реакції; k – константа швидкості реакції (при C A = C B = 1 моль/л v = k); C a і C B– концентрації речовин А і В; a і b – стехіометричні коефіцієнти в рівнянні реакції. Константа швидкості (k) визначається природою реагуючих речовин і залежить від температури і каталізатору і не залежить від концентрації речовин, що приймають участь в реакціях. При розгляді залежності швидкості хімічних реакцій від концентрації реагуючих речовин слід мати на увазі, що парціальний тиск кожного газу при постійній температурі пропорційний його концентрації. Тому швидкість реакції, що відбувається між газами, можна вимірювати зміною їх парціальних тисків за одиницю часу. Наприклад, швидкість реації H2+I2 Þ 2HI v = kC Н
Багато хімічних реакцій є гетерогенними, тобто реакціями в гетерогенних системах. Вони проходять на поверхні розділу фаз. У цьому випадку концентрацію газоподібних і рідких речовин, що приймають участь у взаємодії, вимірюють кількістю моль цих речовин, що припадають на одиницю реакційної поверхні (моль/м2 або моль/см2); її називають поверхневою концентрацією СS. Швидкість гетерогенної хімічної реакції Залежність швидкості гетерогенної хімічної реакції визначається законом діючих мас, але в кінетичне рівняння не включається концентрація твердої фази. Наприклад, при T = const швидкість реакції Si (крист.)+O2 (газ) Þ SiO2 (крист.) v = kCS (O2), де v – швидкість реакції; k– константа швидкості; CS (O2)– поверхнева концентрація кисню, моль/м2. Швидкість гетерогенної реакції залежить від величини поверхні зіткнення. Чим більша площа твердої фази, тим більша швидкість проходження гетерогенної хімічної реакції.
Рис.3. Графічна залежність ln k = – Еа / RT + ln A |
Залежність швидкості реакції від температури визначається правилом Вант-Гоффа: п ри підвищенні температури на кожні десять градусів швидкісь більшості реакцій збільшується в 2-4 рази: v  = v
= v 
 , де v
, де v  і v
і v  – швидкості реакції при температурах t 2 і t 1, g – температурний коефіцієнт швидкості. g =
– швидкості реакції при температурах t 2 і t 1, g – температурний коефіцієнт швидкості. g =  , коли різниця температур t 2– t 1 = 10, тобто коефіцієнт g показує, у скільки разів збільшиться швидкість реакції при підвищенні температури на 10 градусів. При концентраціях реагуючих речовин 1 моль/л швидкість реакції чисельно рівна константі швидкості k, тоді k
, коли різниця температур t 2– t 1 = 10, тобто коефіцієнт g показує, у скільки разів збільшиться швидкість реакції при підвищенні температури на 10 градусів. При концентраціях реагуючих речовин 1 моль/л швидкість реакції чисельно рівна константі швидкості k, тоді k  = k
= k  ·
·  .
.
Функціональну залежність константи швидкості хімічної реакції k від температури встановив шведський вчений Ареніус (1889 р.); рівняння Ареніуса: k = А · е  , де А – передекспоненціальний множник; Еа – енергія активації, Т – температура.
, де А – передекспоненціальний множник; Еа – енергія активації, Т – температура.
Графічно виразити залежність можна так:
ln k = – Еа / RT + ln A, тобто tg j = –  (рис.3).
(рис.3).
| Енергія активації хімічної реакції |
Хімічна взаємодія між молекулами, що стикаються, відбувається лише в тому випадку, коли енергія, якою вони володіють, вище певної енергії, характерної для даної реакції, тобто вище її так званого енергетичного бар’єру. Всі молекули, запас енергії яких нижче енергетичного бар’єру реакції, знаходяться в особливому стані, який прийнято називати перехідним або станом активованого комплексу. Система, що складається з активованого комплексу, характеризується тим, що в ній уже немає вихідних речовин, але ще немає і продуктів реакції. Схематично перехід вихідних речовин А і В в продукти реакції С і D через стан активованого комплексу А…...В представлений на рис.4,5.
 Рис.4. Енергетична діаграма
для екзотермічної реакції
Рис.4. Енергетична діаграма
для екзотермічної реакції
|  Рис.5. Енергетична діаграма
для ендотермічної реакції
Рис.5. Енергетична діаграма
для ендотермічної реакції
|
Для того, щоб молекули вступили у взаємодію, необхідно не тільки щоб вони мали надлишок енергії, рівний Еа, але і певну взаємну орієнтацію. Вплив просторової орієнтації молекул на швидкість реакції (або на константу швидкості) можна врахувати з допомогою так званого стеричного (імовірнісного) фактора Р: А = Р·z, А – множник в рівнянні Ареніуса; z – загальне число молекул реагуючих речовин, що стикаються.
| Фотохімічні реакції |
Реакції, що проходять під дією світла, називають фотохімічними. Молекули реагуючих речовин поглинають енергію випромінювання квантами h n (h – cтала Планка; n – частота) і переходять в активний стан. Кожен квант поглинутого світла викликає елементарну хімічну реакцію. Закон фотохімічної еквівалентності: n = E / h n, де Е – кількість енергії, поглинутої речовиною; n – число молекул, що прореагували. Відношення E / h n називають квантовим виходом хімічної реакції.
Радіаційно-хімічні реакції проходять під дією іонізуючого випромінювання (g-випромінювання, потік нейтронів). Ці реакції вивчає радіаційна хімія. Механохімія вивчає хімічні перетворення, що ініціюються або прискорюються механічними діями (ультразвукова обробка, надвисокі тиски, ударні хвилі твердих тіл і рідин).
| Ланцюгові реакції |
Молекула А:В з ковалентним типом зв’язку між атомами в активованому стані може розпадатися: а) на іони: А:В ® А+ +:В–; б) на атоми (чи вільні радикали): А:В ® А· + В·. В реакції (а) розрив зв’язку називається гетеролітичним або іонним, в реакції (б) – гомолітичним або радикальним.
При гомолітичному розриві ковалентного зв’язку утворюються атоми або групи атомів (вільні радикали) з підвищеною реакційною здатністю, обумовленою наявністю неспарених електронів •. Ланцюгова реакція завжди починається гомолітичним розривом зв’язку в одній із реагуючих молекул. Для ланцюгових реакцій характерні три стадії:
1) стадія зародження ланцюга:
Cl2 + h n® Cl• + Cl•
2) cтадія розвитку ланцюга:
 Рис.6. Схема реакції
з розгалуженими ланцюгами
Рис.6. Схема реакції
з розгалуженими ланцюгами
|
Cl• + Н2 ® Н Cl + Н•
Н• + Cl2 ® НCl + Cl• і т.д.
3) стадія обриву ланцюга (зіткнення двох атомів):
Н• + Н• ® Н2
Cl• + Cl• ® Cl2
Н• + Cl• ® НCl
Існують два типи ланцюгових реакцій: з нерозгалуженим і розгалуженим ланцюгами. При розгалуженні ланцюгові реакції проходять так, що кожна активна частка (атом або вільний радикал) породжує не одну, як в нерозгалуженому ланцюгу, а мінімум дві нові активні частки.. Схема розгалуженої ланцюгової реакції приведена на рис.6.
| Оборотні та необоротні реакції |
Хімічні реакції можна розділити на необоротні і оборотні. Необоротними називають реакції, що проходять в одному напрямку: з вихідних речовин утворюються продукти реакції. Ознаками необоротності є: виділення газу, випадання осаду, утворення малодисоційованої речовини і виділення великої кількості тепла. Оборотними називаються хімічні реакції, що проходять в двох взаємно протилежних напрямках. Їх особливість полягає в тому, що вони не йдуть до кінця, в системі завжди знаходяться як вихідні речовини, так і продукти реакції:

| хімічна рівновага |
Якщо в системі швидкість прямої реакції ( пр.) дорівнює швидкості оборотної реакції (
пр.) дорівнює швидкості оборотної реакції ( об.), то такий стан системи називають хімічною рівновагою:
об.), то такий стан системи називають хімічною рівновагою:  пр. =
пр. =  об. – конечна умова хімічної рівноваги; D Gp,T = 0 – термодинамічна умова хімічної рівноваги.
об. – конечна умова хімічної рівноваги; D Gp,T = 0 – термодинамічна умова хімічної рівноваги.
Величина, що дорівнює відношенню добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин у степенях їх стехіометричних коефіцієнтів, називається константою хімічної рівноваги (КС). КС =  для реакції, рівняння якої має вигляд а А+ b B Û m M+ n N. Константа рівноваги залежить від природи реагуючих речовин; час, необхідний для досягнення рівноваги, залежить від температури і концентрації вихідних речовин.
для реакції, рівняння якої має вигляд а А+ b B Û m M+ n N. Константа рівноваги залежить від природи реагуючих речовин; час, необхідний для досягнення рівноваги, залежить від температури і концентрації вихідних речовин.
Концентрації речовин у випадку реакції між газоподібними речовинами можуть бути замінені рівноважними тисками газів: Кр =  ;
;
Якщо оборотна реакція проходить в гетерогенній системі (FeO(кр.)+CO(газ) Û Fe(кр.)+CO2(газ)), то Кр рівна відношенню рівноважних парціальних тисків газоподібних речовин (CO2 і CO) і не залежить від кількості речовин, що знаходяться в кристалічній (твердій) фазі і Кр = р СО  / р СО.
/ р СО.
| Зміщення хімічної рівноваги |
Рівноважний стан системи при заданих умовах є найбільш стійким. Але при зміні умов рівновага порушується і зміщується або в напрямку прямої або в напрямку зворотньої реакції. Через деякий час система знову стає рівноважною, тобто вона переходить з одного рівноважного стану в інший. Якщо  пр. >
пр. >  об., то рівновага зміщується вправо; якщо
об., то рівновага зміщується вправо; якщо  пр. <
пр. <  об., то рівновага зміщується вліво.
об., то рівновага зміщується вліво.
Зміна рівноваги в загальному випадку визначається принципом Ле-Шательє: якщо на систему, що перебуває у стані хімічної рівноваги, подіяти ззовні (змінити концентрацію, тиск, температуру), то рівновага зміститься в тому напрямку, який послаблює ефект зовнішньої дії.
Приклади зміщення рівноваги:
а) збільшення концентрації вихідних речовин або зменшення концентрації продуктів реакції зміщує рівновагу вправо;
б) збільшення концентрації продуктів реакції або зменшення концентрації вихідних речовин зміщує рівновагу вліво;
в) якщо пряма реакція іде з поглинанням тепла, то підвищення температури зміщує рівновагу вправо;
г) якщо пряма реакція йде з виділенням тепла, то підвищення температури зміщує рівновагу вліво.
Якщо в оборотних реакціях приймають участь гази, то хімічну рівновагу можна зміщувати, змінюючи парціальні тиски газоподібних речовин. Підвищення тиску завжди зміщує реакцію в бік утворення меншої кількості молей газоподібних речовин.
| Фазові рівноваги |
Гетерогенні рівноваги, що пов’язані з переходом речовини з однієї фази в іншу без зміни хімічного складу, називаються фазовими. Наприклад, Н2О(крист.) «Н2О(рідина).
Одним з найбільш загальних законів гетерогенних (в тому числі і фазових) рівноваг є правило фаз: в рівноважній системі число фаз (Ф), число незалежних компонентів (К), число ступенів волі (С) зв’язано співвідношенням: С+Ф = К+2, де 2 – число зовнішніх факторів (температура і тиск), що впливають на рівновагу.
Компонент – яка-небудь речовина, що входить до складу системи і може бути виділена з неї у вільному стані. Якщо в системі між речовинами відбувається хімічна взаємодія, то число компонентів в ній рівне числу речовин в системі мінус число хімічних реакцій, що відбуваються між ними.
| Каталіз |
Каталіз – метод прискорення хімічних реакцій за допомогою каталізатора. Каталізатор – це речовина, що прискорює хімічну реакцію, але сама не входить в кінцеві продукти реакції. Якщо каталізатор і взаємодіючі речовини перебувають в одній фазі, то каталіз називається гомогенним; якщо каталізатор і реагуючі речовини в різних фазах, то каталіз називається гетерогенним. У присутності каталізатора змінюється механізм хімічної реакції, вона проходить через нові стадії, кожна з яких характеризується невисокими значеннями енергії активації. При каталізі не змінюється тепловий ефект реакції, каталізатор не впливає на зміщення хімічної рівноваги, не змінює константу рівноваги і рівноважні концентрації компонентів системи. Каталізатори як правило діють вибірково (селективно). Речовини, що підвищують активність каталізатору, називають промоторами. Механізм гомогенного каталізу: реакція без каталізатору (К): А+В ® АВ
реакція в присутності каталізатору (К): А+К ® АК (перша стадія)
АК+В ® АВ+К (друга стадія).
Наприклад, у випадку коли А – O2; В – SO2; АВ – SO3; K – NO реакція O2+SO2  SO3 відбувається в дві стадії: 1) O2+2NO Þ 2NO2;
SO3 відбувається в дві стадії: 1) O2+2NO Þ 2NO2;
2) NO2+SO2 Þ SO3+NO.
Гетерогенний каталіз завжди починається з адсорбції молекул вихідних речовин на поверхні каталізатору. При оборотній адсорбції молекул вихідних речовин поверхнею твердого каталізатора проходить послаблення хімічних зв’язків між атомами в молекулах реагуючих речовин, що приводить до пониження енергії активації каталітичної реакції і в результаті до прискорення хімічної взаємодії між речовинами.
Тестові завдання:
1. Коли числове значення швидкостi i константи швидкостi збiгаються?
2. Що можна сказати про хімічний процес, для якого: а) DG<0; б) DG>0; в) DG=0.
3. Енергетичні ефекти яких процесів можна вирахувати за допомогою табличних значень DН298?
4. Визначте знак зміни ентропії в кожній із приведених реакцій:
1) 2KClO3(кр.) = 2KCl(кр.) +3O2(газ)
2) N2(г) + 2O2(г) = 2NO2(г)
3) 3C2H2(г) = C6H6(р)
4) FeO(кр.) + H2(г) = Fe(кр.) + H2O(г)
5. Швидкість яких реакцій (екзотермічних чи ендотермічних) збільшується із підвищенням температури?
6. Написати вираз закону діючих мас для реакцій:
а) 2NO(г) + Cl2(г) ® 2NOCl(г)
б) CaCO3(кр.) ® CaO(
Поделиться:

 О2 = 6СО2+3Н2О(р)+3267,7 кДж; тоді при Q > 0 – екзотермічна реакція; при Q < 0 – ендотермічна реакція;
О2 = 6СО2+3Н2О(р)+3267,7 кДж; тоді при Q > 0 – екзотермічна реакція; при Q < 0 – ендотермічна реакція; , v
, v  , v
, v  ). В першому випадку характеризується макростан системи, у другому – мікростан. Кожному макростану відповідає величезна кількість мікростанів. Число мікростанів, з допомогою яких здійснюється даний макростан, називають термодинамічною імовірністю стану системи і позначають W. Для переходу до зручних розрахунків в термодинаміці використовують не величину W, а її логарифм ln W. Щоб цій величині надати розмірність Дж/К, її помножують на сталу Больцмана k: k ln W = S. Величину S називають ентропією. Ентропія – термодинамічна функція стану системи. Її величина залежить від кількості речовини, тому величину ентропії відносять до одного моля речовини (Дж/моль·К) і виражають як R ln W = S, де R = kN A – молярна газова стала; N A – стала Авогадро. Ентропія є мірою невпорядкованості стану системи. Зміна ентропії (D S) при хімічних реакціях визначається різницею S 2– S 1, де S 2– сума ентропій всіх продуктів реакції, а S 1– сума ентропій всіх вихідних речовин.
). В першому випадку характеризується макростан системи, у другому – мікростан. Кожному макростану відповідає величезна кількість мікростанів. Число мікростанів, з допомогою яких здійснюється даний макростан, називають термодинамічною імовірністю стану системи і позначають W. Для переходу до зручних розрахунків в термодинаміці використовують не величину W, а її логарифм ln W. Щоб цій величині надати розмірність Дж/К, її помножують на сталу Больцмана k: k ln W = S. Величину S називають ентропією. Ентропія – термодинамічна функція стану системи. Її величина залежить від кількості речовини, тому величину ентропії відносять до одного моля речовини (Дж/моль·К) і виражають як R ln W = S, де R = kN A – молярна газова стала; N A – стала Авогадро. Ентропія є мірою невпорядкованості стану системи. Зміна ентропії (D S) при хімічних реакціях визначається різницею S 2– S 1, де S 2– сума ентропій всіх продуктів реакції, а S 1– сума ентропій всіх вихідних речовин. або А
або А  для реакцій, що проходять при V , T = const або р , T = const. Максимальна робота рівна енергії, яку необхідно прикласти до системи, щоб зупинити реакцію, тобто перемогти сили хімічної спорідненості: А
для реакцій, що проходять при V , T = const або р , T = const. Максимальна робота рівна енергії, яку необхідно прикласти до системи, щоб зупинити реакцію, тобто перемогти сили хімічної спорідненості: А  = RТ ln k Р, де R – універсальна газова стала (Дж/моль·К); Т – температура; k Р – константа рівноваги гомогенної реакції, що проходить в газовій фазі при температурі Т.
= RТ ln k Р, де R – універсальна газова стала (Дж/моль·К); Т – температура; k Р – константа рівноваги гомогенної реакції, що проходить в газовій фазі при температурі Т.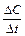 .
. вимірюється зміною поверхневої концентрації однієї з реагуючих речовин за одиницю часу. Вимірюють швидкість гетерогенної реакції в моль/м2·с або в моль/см2·с.
вимірюється зміною поверхневої концентрації однієї з реагуючих речовин за одиницю часу. Вимірюють швидкість гетерогенної реакції в моль/м2·с або в моль/см2·с.



