
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічна рівновага в гомогенних та гетерогенних системах. Добуток розчинності.Содержание книги
Поиск на нашем сайте Коли хімічна реакція завершується за малий проміжок часу, то кажуть, що вона має велику швидкість, і навпаки, якщо перетворення триває довго – воно має малу швидкість. Наприклад, кисень взаємодіє з воднем миттєво (реакція має велику швидкість), а з міддю – повільно (реакція має малу швидкість). Відомі настільки повільні реакції, що людина їх навіть не помічає, зокрема перетворення в гірських породах (відбуваються протягом мільйонів років). Швидкість хімічної реакції залежить від багатьох чинників, серед яких 5 основних: природа реагуючих речовин, їх температура, концентрація, ступінь подрібненості й наявність каталізаторів. Залежність швидкості реакції від концентрації виражається законом діючих мас: швидкість хімічної реакції при даній температурі прямо пропорційна добутку концентрації реагуючих речовин. Наприклад, для реакції А + В = С + Д швидкість реакції пропорційна добутку концентрації речовин А і В. Позначив швидкість даної реакції через υ, молярні концентрації реагуючих речовин через [А] і [В], коефіцієнт пропорційності через К, можна записати закон діючих мас: υ = К [А] ∙ [В] Коефіцієнт пропорційності К називають константою швидкості даної реакції. Значення константи швидкості залежить від природи реагуючих речовин і від температури, но не залежить від концентрації. Реакції, що відбуваються у двох взаємно протилежних напрямках, називаються зворотніми. Ці реакції записуються не двома, а лише одним хімічним рівнянням, у якому позначаються дві стрілки, направлені у протилежні боки. Стрілка направлена вправо, означає пряму реакцію, вліво – зворотню: Н2О + СО2
Хімічні реакції, що відбуваються тільки в одному напрямку, називаються незворотніми. Цих реакцій значно менше, ніж зворотніх. Для них характерні такі ознаки: 1. Виділення газу. Zn + H2SO4 ® ZnSO4 + H2 2. Виділення тепла. 2Mg + O2 ® 2Mg + Q 3. Утворення води або випадання осаду. NaOH + HCl ® NaCl + H2O Стан, коли швидкість прямої і зворотньої реакцій стають однаковими, називається хімічною рівновагою. Вона зовні непомітна. Наприклад, коли дивитися на закриту пляшку з газованою водою, то ніякі ознаки хімічних реакцій не спостерігаються, хоча насправді реакції відбуваються. Стан хімічної рівноваги може зберігатися як завгодно довго в ізольованій системі. Наприклад, в запаяній ампулі. Наприклад, розглянемо рівняння: А + В D С + Д. Швидкість прямої реакції υ1 = К1 [А] ∙ [В], швидкість зворотної реакції υ2 = К2 [С] ∙ [Д] (К1 і К2 – константи прямої і зворотної реакції; [А], [В], [С], [Д] – концентрації взятих та отриманих речовин у відповідності до рівноваги). Коли досягли хімічної рівноваги швидкості прямої і зворотної реакцій дорівнюють, тобто υ1 = υ2 та К1 [А] ∙ [В] = К2 [С] ∙ [Д]. Тоді Так як К1 і К2 – величини постійні при незмінній температурі, то їх співвідношення теж постійне; позначається К і називається константою рівноваги. Дисоціація електроліта – процес зворотній. Використовуючи закон діючих мас до процесу дисоціації, отримаємо наступне рівняння константи рівноваги, яка називається константою дисоціації: Кд = Константа дисоціації даного електроліта дорівнює відношенню добутку концентрації іонів у розчині до концентрації недосоціюючих молекул цього електроліта. Система, яка має в складі одне середовище, тобто розчин-розчин або газ-газ називається гомогенною системою. Система, яка має в складі різні середовища, наприклад: розчин-тверда речовина, називається гетерогенною системою. Гетерогенні системи мають велике значення у аналітичній хімії. З ними стикаєшся у процесі осадження, відділення іонів, розчинення і промивання осадів. Швидкість розчинення твердої фази у стані рівноваги постійна і дорівнює деякій постійній величині К1: υ1 = К1. Швидкість протилежного процесу – осадження – υ2 визначається числом зіткнення іонів з одиницею поверхні кристала. Вона буде пропорційна добутку концентрацій іонів. Звідси υ2 = К2 [Н+] ∙ [ОН-]. де К2 – величина постійна при данній температурі. К1 = К2 [Н+] ∙ [ОН-];
Відношення двух постійних величин ДР Таким чином, добуток концентрації іонів малорозчинного електроліта у насиченому розчині є величина постійна при даній температурі, яка називається добутком розчинності і позначається ДР з індексом того електроліта, про який йде мова.
|
||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 279; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

 Н2СО3
Н2СО3


 .
.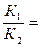 [Н+] ∙ [ОН-]
[Н+] ∙ [ОН-]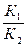 є величина постійна, яка позначається через ДР
є величина постійна, яка позначається через ДР 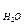 :
:


