
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сутність хроматографічного методу аналізу. Мета і задачі.Содержание книги
Поиск на нашем сайте
Хроматографія - це фізико-хімічний метод поділення сумішів речовин на їх компоненти, оснований на вибірковій адсорбції різних речовин пористими адсорбентами. Хроматографічний метод аналізу був відкритий і теоретични обґрунтований російським вченим М.С. Цветом (1903). М.С. Цветом був сформульований закон адсорбційного заміщення: “Речовини, розчинні у данні рідині, утворюють адсорбційний ряд А < В < С, який виражає відносну адсорбційну подібність його членів до адсорбенту. Кожний із членів адсорбціонного ряду, володіючи великою адсорбційною подібністю, чим послідуючий, витісняє його із сполуки і в свою чергу витісняється попереднім ”. Хроматографічний метод володіє рядом переваг: універсальністю, високою ефективністю, простотою експеримента, селективністю, експресностю, можливістю автоматизації у сполученні з іншими фізико-хімічними методами, високою чутливістю. Хроматографічний метод аналізу знаходить широке використання у різних галузях науки та техніки. Широке використання цей метод знаходить у технохімконтролі харчової рослиної сировини на виробництвах цукрової, бродильної, кондитерської, хлібопекарської та жиропереробної промисловості. Цей метод поділення сумішів речовин знайшов використання для визначення складу вуглеводів, амінокислот, жирних кислот, дубільних речовин і т. п.. Хроматографічні методи класифікують: по механізму розподілу, по типу стаціонарної фази, по агрегатному стану, по способу виконання аналіза. По механізму розподулу, тобто по механізму взаємодії речовин зі стаціонарною фазою розрізняють: адсорбціону, розподільну, іонообмінну, окисно-відновну, осадочну, комплексоутворюючу хроматографію. По типу стаціонарної фази: колоночну (капілярну), паперову, тонкослойну хроматографію. По агрегатному стану: рідкісну, газову та газорідкісну хроматографію. По способу виконання аналіза: фронтальну, витіснительну, елюєнтну. Елюірування - це процес вимивання іонів із колонки, переведення їх у фільтрат, який витікає з колонки. За допомогою хроматографічного аналізу можна виконувати якісні та кількісні визначення. Іонообміна хроматографія Іонообміна хроматографія використовується для очищення цукрових розчинів, плодово-ягідних соків, очистка твердої води та ін.. Способність до іонного обміну була виявлена в багатьох природних органічних та неорганічних речовинах. Явище іонного обміну заключається в тому, що при занурюванні в розчин електроліта деяких твердих речовин ці речовини поглинають із розчину катіони або аніони, виділяя у розчин еквівалентну кількість іонів з зарядом того ж знака. В якості іонообмінних матеріалів використовують природні (глина, цеоліти) та синтетичні матеріали (полімери і похідні целюлози). Найпоширеніше використовують синтетичні смоли, які містять кислотні або основні полярні групи. Іонообмінна смола складається з матриці, на якій фіксується заряджена група, яка визначає знак заряда матриці. В ячейках, які утворила матриця, розташовуються противоіони, з зарядом, протилежним знаку каркаса. Ці противоіони можуть бути замінені на інші іони того ж знака, які містяться на зовнішній рідкій фазі. Заряд каркаса компенсується сумарним зарядом противоіонів. В загалі іоніт - електронейтрален. Іоніти уявляєть з себе високомолекулярні полівалентні сполуки трьохмірної структури, практично нерозчинні у воді, в органічних середовищах і зворотно обмінні іони, які входять до їх складу, на еквівалентну кількість інших іонів того ж знака, які знаходяться у розчині. Фіксовані на каркасі групи визначають тип и активність обмінника. По здібності обміну на іони відрізняють: катіоніти (поглинають із розчину катіони) і аніоніти (поглинают із розчину аніони). По ступені дисоціації функціональних груп іоніти підрозділяють на: сильні, слабкі і середні. До сильнокислотних катионітів відноситься сульфокатионіт, який містить сульфогрупу – SO3H (константа дисоціації К Сильно основні аніоніти – це смоли з четвертичними функціональними алкіламонійними групами R-[N(CH3)3]+OH- або (К Процеси, які протікають на катионітах: 1) R-SO3-H + Na+Cl- ® R-SO3-Na+ + H+Cl- (Cl-- коіон). Процеси, які протікають на аніонітах: 2) R-N+(CH3)3OH- + Na+Cl- ® R- N+(CH3)3Cl- + Na+OH- Процеси, які протікають на амфолітах (Na+- коіон):
N+(CH3)3OH- N+(CH3)3Cl- В залежності від рН амфоліт може працювати як катионіт або аніоніт. Ступень поперечної сполученості іоніта зумовлює ємкість і набрякаємість іоніту. В набряклому іоніті ефективніше відбувається іонний обмін. Тому іоніти завжди знаходяться під шаром розчинника (води). Під ємністю іоніта розуміють кількісну міру його здібності поглинати противоіони. Ємність іоніта відноситься до найважливіших фізико-хімічних характеристик іоніта. Ємкість іоніта виражається числом міліеквівалентів на грам сухого іоніта або на мілілітр повністю набряклого іоніта. Ємкість іоніта– поняття багатогранне та включає: повну ємкість іоніта, робочу єкність іоніта, вагову ємкість іоніта, об’ємну ємкість іоніта, обміну ємкість іоніта, адсорбційну ємкість іоніта. Для визначення ємкість іоніта використовують статичний і динамічний методи. При статичному методі іоніт знаходиться в контакті з постійним об’ємом електроліту. Колбу з розчином струшують до тих пір, поки між розчином та смолою не встановиться рівновага. У присутності великого надлишку смоли іоний обмін відбувається повністю. Визначаєть повну об’ємну ємкість. При динамічному методі досліджуємий розчин пропускають крізь іоніт, розташований в колонку. При цьому більш інтенсивний обмін іонів між розчином та іонітом відбувається в верхньому шарі іоніта. Концентрація визначаємих іонів у розчині по мірі їх пересування крізь іоніт за рахунок обміну іонів між розчином і іонітом. Коефіцієнт розподілення виражає спосібність іонообмінної смоли кількісно обмінювати іони та визначається відношення маси іонів в іоніті до маси їх в розчині. Коефіцієнт розподілення Кр визначають за формулою: Кр = де m - маса іонів, сорбованих іонітом, г.; m1 - маса іонів в вихідному розчині, г.; V - об’єм розчину, мл.; m0 - маса наважки іоніта, г. По значенню коефіцієнт розподілення судять про ступень розподілення компонентів суміші. Підготовка іоніта. Перед проведенням процесу іонного обміну колонку, яка містить іоніт, піддають спеціальній обробці та регенерації (відновленню). Попередня обробка іоніту припускає видалення слідів аналізуємих сполук та перевод його із однієї форми в іншу. Так, катионіти переводять в Н+ – форму. В процесі оброботки іоніта змінюється його структура: стає більш доступна функціональним групам. Щоб перевести катионіт в Н+ форму, його промивають розчином соляної кислоти (С(НСI), eq = 2 моль/л) потім відмивають від соляної кислоти дистильованою водою до нейтральної реакції по метилоранжу. Аніоніт переводять в ОН- форму, промиваючи його розчином гідроксиду натрію (С(NaОН), eq = 2 моль/л), приготовленого з використанням кип’яченої води. Потім промивають аніоніт кип’яченої дистильованої води до повного видалення лугу до нейтральної реакції по фелолфталеїну; щоб перевести аніоніт в солеву форму, його промивають розчином солі. Надлишок реагента вимивають водою. Розподільна хроматографія. Вид хроматаграфічного аналізу, оснований на розподіленні компонентів хроматографіної суміші між рухомим та нерухомим розчинниками називають розподільною хроматографією. Для того, щоб використовувати систему із двух рідких фаз (рухомий та нерухомий розчинники), необхідно, щоб одні із фаз переміщалися відносно другої, а для цього необхідно закріпити одну із фаз. Така закріплена рідка фаза називається нерухомою. Інша фаза повинна повільно передвигатися вдоль поверхності розподілу з первою і вона називається рухомою. В якості носія, який втримує нерухомий розчинник (або фазу), використовують селікагель, крохмаль, целюлозу (гідрофільні носителі) та кизельгур, скляний порошок, поліетилен (гідрофобні носителі). Методом розподільної хроматографії можна розділяти: жирні кислоти, амінокислоти, металоорганічні сполуки, хелати, спирти, вуглеводні, пестициди, гормони, антибіотики, алкалоіди. Паперова хроматографія. Вперше паперову хроматографію в 1944 р. Використав Мартин та Синдж для анализу сумішів амінокислот. Ідентифікацію компонентів хроматографіруємої суміші проводять на смугах фільтровальнго паперу. Ефективність паперової хроматографії залкжить від трьох факторів: типу паперу; складу рухомої фази; виборочності та чутливості реагентів, які використовують для прояви компонентів. Сорт паперу розрізняють по пористості і ступені гідротації. Ці властивості визначають швидкість фаз. На отриманій хроматограмі можливо якісно визначити суміш речовин і дати їх кількісну характеристику. Ідентифікація компонентів суміші продиться за допомогою величини Rf, яка представляє з себе відношення відстані від центра пятна - Х, пройденого речовиною, до відстані Хf, пройденому розчинником: Rf = Чим більше різниця в значеннях Rf, тим краще можна розділити речовину. Но, при дуже великих значеннях Rf речовини не встигають поділитися. На величину Rf впливають: умови проведення експерименту (сорт паперу, склад розчинюючої системы, вологість та насиченість атмосфери камери). Тонкошарова хроматографія. В методі тонкошарової хроматографії (ТШХ) розподіл речовини відбувається у тонкому шарі стаціонарної фази, нанесеної на носитель. Вперше тонкошарову хроматографію для розділення фармацевтичних настойк використав Н.А. Ізмайлов в 1935 році. Якісну оцінку хроматограми проводять по величені Rf, сопоставляючи значення Rf з еталонними. Метод ТШХ використовують для розподілу стероідів, ефірів, холестерину, барвників, неорганічних іонів. Паперова та тонкошарова хроматографії мають наступні переваги: низьку вартість, простота, експресність та широке використання для анализу різних видів речовин і різних розмірів проб. Газова хроматографія Газовою хроматографією називають метод розподілення і ідентифікації компонентів газової суміші, в якій рухомою фазою використовують газ або пар. Вперше метод був предложений Макртином і Джеймсом у 1952 році. Газову хроматографію класифікують: 1. По агрегатному стану нерухомих фаз: газорідка (нерухома фаза, рідина, розподілена тонким шаром по поверхні якого-нибуть твердого матеріалу); газо-тверда (нерухома фаза тверда речовина). 2. По механізму дії: розподільна хроматографія, (газорідка один із варіантів), адсорбціонна хроматографія, (газо-тверда – варіант). 3. По способу переміщення фаз: проявительна або елюєнтна, фронтальна, витесняюча. Газова і газорідка хроматографія широко використовують у різних галузях науки, техніки і медицини. Характеристика еволюційної кривої. Вихідну криву називають еволюційною. Основними її характеристиками або параметрами є час утримання (t) і утримуючий об’єм. Ці параметри служать засобом вираження результатів хроматографічного розподілу суміші речовини. Час втримання характеризується відношенням відстані (мм) на хроматограмі від момента випуска проби речовини в колонку до досягнення визиваємих речовиною на виході із максимальної концентрації (Смакс.). Швидкість руху стрічки самописця (Uл мм/с). Кст = n = де n - число еквівалентних масс речовини; C(A)eq - еквівалентна концентрація розчину, моль/ л; V – об’єм розчина, л; K - об’ємна ємкість іоніта, м×моль/ г. Масову частку речовин, близьких по властивостям, визначають співвідношенням: wі = де mi- маса паперу i- го хроматаграфічного піка; n - число компонентів суміші.
Завдання для виконання самостійної роботи Відповісти на запитання: 1. Сутність хроматографічного методу аналізу? Закон М.С. Цвета. 2. Особеності і задачі іонообмінної хроматографії. Її переваги і недоліки. 3. Структура іонітів і процеси, які відбуваються на них. 4. Ємкість іонітів. Характеристика і різновидності ємкості. 5. Підготовка іоніту до роботи. 6. Розподільна хроматографія. Характеристика. Особливості. Коефіцієнт розподілення. 7. Паперова хроматографія. Особливості проведення якісного та кількісного анализу. 8. Тонкошарова хроматографія. Характеристика. Особливості.Використання. 9. Області використання та переваги газової хроматографії в порівнянні з іншими хроматографічними методами. 10. Особливості якісної газової хроматографії. Час та об’єм втримання. Рекомендована література.
1. Г.Шарло “Методи аналітичної хімії”. 2. Шапиро С.А., Шапиро М.А. Аналитическая химия: Учебник для учасщихся техникумов. – 3-е изд., испр. и доп. – М.: Высш. Школа, 1979. 3. Хомченко Г.П. Севастьянова К.И. Окислительно-востановительные реакции – М.: Образование, 1989г. 4. Хомченко Г.П. Химия К: Высшая школа, 1991г. 5. Крешков А. П. Основы аналитической химии. Том 2. – М.: Химия. 6. Алексеев В. Н. Количественный анализ. – М.: Химия. 7. Фритц Дж., Шек Г. Количественный анализ, - М.: Мир. 8. Лурье Ю. Ю. Справочник по аналитической химии. – М.: Химия.
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 126; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.85.233 (0.01 с.) |

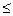 10-1
10-1  10-2 моль/л). До катионітів средньої сили відносяться смоли з групою фосфорної кислоти (К
10-2 моль/л). До катионітів средньої сили відносяться смоли з групою фосфорної кислоти (К  10-1
10-1 
 SO3-H+ SO3-Na+
SO3-H+ SO3-Na+


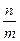 , ммоль/г
, ммоль/г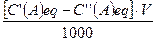 , ммоль
, ммоль , %
, %


