
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика розчинів, які використовують у йодометрії.Содержание книги
Поиск на нашем сайте
Розчин йоду. Кристалічний йод не відповідає вимогам, які пред’являються до стандартних речовин, так як йод містить воду, хлор, бром та інші домішки. Для приготування розчину йоду використовують очищений сублімацією йод. Концентрація розчину йоду, який зберігається при освітленні сонця і на повітрі поступово збільшується. Розчини йоду необхідно зберігати у герметично закритих склянках із темного скла. Розчин тіосульфату натрію. Стандартний розчин тіосульфату не можна готовити по стандартній масі солі, так як вона не відповідає вимогам, які пред’являються до стандартним речовинам. Концентрація розчину тіосульфату натрію не є постійною і в перші 10 днів з моменту приготування – збільшується. Це обусловлено взаємодією тіосульфат-іону з вугільною кислотою, яка розчинна у воді, і утворенням гідросульфіт-іону. Na2S2O3 + Н2СО3 = NaНСО3 + NaНSO3 У свою чергу гідросульфіт-іон також реагує з йодом: NaНSO3 + I2 + H2O = НІ + NaІ + Н2SO4 Потім конценрація розчину повільно зменшується, так як окислюється тіосульфат-іон киснем повітря і разкладання його тіобактеріями: Na2S2O3 + О2 = 2S¯ + Na2SO4 Концетрацію розчину тіосульфату натрію встановлюють кожний раз перед початком роботи по стандартному розчину діхромату калію. Для підвищення стійкості розчину тіосульфату натрію дотиримуються слідуючих вимог: 1. розчини зберігають у посуді із темного скла, закриті пробкою з хлоркальцієвою трубкою, яка заповнена натронним вапном для захисту від СО2; 2. для зменшення розкладу розчину тіобактеріями до нього додають йодид ртуті; 3. додавання до розчину об’ємом 1л Na2СО3 масою 0,2г попереджує почти повним розкладанням його під впливом СО2, так як оксид вуглецю (ІV) реагує головним чином, з карбонат-іоном: СО32- + Н2СО3 = 2НСО3-. Розчин крохмалю. Єдиним і в одночас незвичайно чутливим індикатором в йодометрії є розчин крохмалю. У присутності йодиду калію чутливість крохмалю до водного розчину йоду збільшується. Считається, що водний розчин крохмалю утворює адсорбціонну сполуку синього кольору у присутності полійдид-іону (І3-). Чутливість індикаторної реакції зменшується зі збільшенням температури і залежить від способу приготування індикатору. Правильно приготовлений розчин індикатору повинен забарвлюватися у чисто синій колір від додавання обнієї краплі йоду (С = 0,01 моль/л). Неправильно приготовлений розчин індикатору або розчин, який зберігали тривалий час, утворює з йодом сполуку фіолетового коліру. Він непридатний для йодометричного визначення. Завдання для виконання самостійної роботи Відповісти на запитання: 1. Характеричтика методу перманганатометрії. 2. Приготування та зберігання розчину перманганату калію. 3. Індикатори методу перманганатометрії. 4. Стандартні речовини у методі перманганатометрії. 5. Умови зберігання стандартизованого розчину перманганату калію. 6. Перманганатометричне визначення відновників, окисників та речовин, які не є окисниками і відновниками. 7. Характеристика методу йодометрії. 8. Приготування стандартизованого розчину йоду і тіосульфату. 9. Умови зберігання розчину йоду і тіосульфату. 10. Індикатори методу йодометрії. 11. Йодометричне визначення окисника, відновника і кислот. Скласти рівняння реакцій: 1. Напишіть окисно-відновні реакції метод електронного балансу та напівреакції: Fe + HNO3 ® Fe(NO3)2 + NH4NO3 + H2O KMnO4 + H2O2 + H2SO4 ® K2SO4 + MnSO4 + O2 + H2O Bi2O3¯ + Cl2 + KOH ® Bi2O5¯ + KCl + H2O K2Cr2O7 + FeSO4 + H2SO4 ® K2SO4 + Fe2(SO4)3 + Cr2(SO4)3 + H2O
САМОСТІЙНА РОБОТА № 7. Тема: Комплексонометричний метод аналізу.
Повинні знати: поняття про комплексони, особливість будови молекули трилону Б та механізм його взаємодії з іонами кальцію та магнію, особливості впливу рН середовища на змінення хімічної рівноваги реакції комплексоутворення, вплив буферного розчину та механізм дії індикатора, використання методу для контролю сировини харчових виробництв. Повинні вміти: написати хімізм реакції комплексоутворння, показати особливості будови молекули трилону Б та механізм його взаємодії з іонами кальцію та магнію.
План: 1. Комплексонометричне титрування. 2. Класифікація прийомів комплексонометричного титрування. Стислі теоретичні відомості Комплексонометричне титрування. Титриметричний аналіз, в якому титрантом використовують розчини комплекса, який утворює речовини, називають комплексонометрією. До комплексонів відносяться водно-розчинні органічні полікислоти або їх солі, які містять відкриті ланцюги амінооцетової кислоти. Титриметричне визначення, основане на взаємодії іонів-комплексоноутворювачів з поліпептидними лігандами, які приводять до утворення розчинних хелатів, називають хелатометрією. Із хелатометричних методів найбільш широке використання нашло титрування розчинами комплексонів – комплексонометрія. Комплексонами називають органічні речовини, які містять одну або декілька амінодикарбоксильних груп – N (СН2СООН)2. Найбільше розповсюдження получив комплексон ІІ, який називається етилендиамінтетраоцтова кислота (Н4У) (ЕДТА), Н Н
НО ½ ½ ОН Н Н
Н Н
О ½ ½ О Н Н а також комплексон ІІІ – динатрієва сіль етилендиамінтетраоцтова кислота (Na2Н4У).
Н Н
НО ½ Н Н ½ ОН Н ½ ½ Н
Н ½ ½ Н
О ½ ½ О Н Н Товарна назва кристалогідрату динатрієвої солі етилендиамінтетраоцтової кислоти (Na2Н2С10Н12О8Н2 × 2Н2О) – трилон Б, а метод аналізу, який використовує його водний розчин як титрант – трилонометрією. Н4У – чотирьохосновна кислота і дисоціює по чотирьом ступеням: Н4У D Н+ + Н3У- рК1 = 2,00 Н3У- D Н+ + Н2У2- рК2 = 2,76 Н2У2- D Н+ + НУ3- рК3 = 6,16 НУ3- D Н+ + У4- рК4 = 10,26 Як бачимо, що при дисоціації по першим двум ступеням вона веде себе як кислота середньої сили, а при дисоціації по третій і четвертій ступеням – як слабка і дуже слабка кислота. У водних розчинах іони багатовалентних металів, мають здібності заміщувати іони водню карбоксильних груп у іоні (Н2У2-), при цьому утворює одночасно з азотом аміногрупу координаційного (донорно-акцепторну) зв’язку. В результаті чого утворюються міцні і розчинні у воді комплексні сполуки. Багатовалентні іони металів взаємодіють з кислотним залишком Н2У2- по рівнянню: Ме2+ + Н2У2- = МеУ2- + 2Н+ Ме2+ + Н2У2- = МеУ- + 2Н+ Ме2+ + Н2У2- = МеУ + 2Н+ Незалежно від валентності іонів металів утворюються комплекси з молекулярним співвідношенням метал:ліганд (1:1). При цьому міцність комплексу виростає. Процес комплексоноутворення супроводжується відщіпленням двух іонів водню, для того щоб виникнути підвищення кислотності, яке може привести до недостатньо повного зв’язування іонів металів, обично використовують буферні розчини. Останні часто виконують і іншу важливу функцію: утворюя комплекси з іонами металів, вони утримують їх у розчині, коли комплексонометричне визначення потрібно проводити в умовах, які проводять до їх осадження. Точку еквівалентності при комплексонометричному титруванні визначають декількома способами: - іони водню, які виділяються у кількості, еквівалентному катіонам, можна визначити алкаметрично з одною із кислотно-основних індикаторів; - фізико-хімічними методами: потенціометрії, кондуктометрії і ін.; - за допомогою металхромових індикаторів, це органічні забарвники, які утворюють з катіонами забарвлення комплексної сполуки. Комплексні сполуки металлохромових індикаторів з іонами металів менш прочні, чим комплекси тих же іонів з комплексом ІІІ. Тому при титруванні аналізуємого розчину комплексоном ІІІ іони метала проходять від індикатора до комплексу і виділяється вільний індикатор, який володіє характерним забарвленням. Відомо багато металохромових індикаторів, із яких одні універсальні: еріохром чорний Т, 8-оксихинолин, алізариновий червоний S, ксиленовий ярко жовтий: другі специфічні: арсеноза І, сульфосаліцілова кислота.
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 102; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.3.235 (0.006 с.) |

 О ½ ½ ¤¤ О
О ½ ½ ¤¤ О



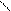 С – С С – С
С – С С – С
 N – C – C – N
N – C – C – N НО ½ ½ ¤ ОН
НО ½ ½ ¤ ОН



