
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В оксидиметричному методі аналізу зустрічаються з трьома видами титрування: прямим, зворотнім та титруванням по заміщенню.Содержание книги
Поиск на нашем сайте
При прямому титруванні досліджує мий розчин титрують стандартним розчином. Зворотне титрування використовують у тому випадку, коли досліджуємо речовина не реагує зі стандартним розчином або реагує повільно. Титрування по заміщенню використовують у випадках, коли визначають іон. Особливістю цього методу являється визначення еквівалентних мас окисника та відновника. Під еквівалентною масою слід розуміти кількість речовини в г/моль, еквівалентне одному прийнятому електрону однією молекулою окисника в даній реакції. Е = де М – молярна маса окисника n – число прийнятих електронів молекули окисника в даній реакції. Під еквівалентною масою відновника розуміють кількість речовини в г/моль, яке еквівалентно одному відданому електрону однією молекулою відновника в даній реакції. Е = де М – молярна маса відновника n – число прийнятих електронів, відданих однією молекулою відновника в даній реакції. Окисник взаємодіє з розчином відновника в об’ємах, зворотно пропорційних їх еквівалентним концентраціям. Таке титрування називають прямим. При зворотному титруванні точний об’єм невідомого окисника обробляється точним надлишковим об’ємом відомого відновника, лишок якого відтитровується еквівалентним об’ємом відомого окисника. При титруванні по заміщенню точний об’єм відомого окисника з розчину йодиду калію у кислому середовищі виділяє еквівалентну кількість йоду, яке відтитровується еквівалентним об’ємом розчину тіосульфату натрію. У процесі титрування по методу окислення-відновлення змінюються окисно-відновні потенціали взаємодіючих один з одним речовин. Якщо реакція проходить з участью іонів водню, то її можна записати в загальному виді: а О к + nН+ +n е D в Вос. + Залежність окисно-відновного потенціалу від концентрації окисленої та відновленої форми, і концетрації іонів водню виражається за рівнянням Нериста: Еок/від = Е0ок/від + де аок, авід – концентрації іонів окисленої та відновненої форми, моль/л; ан – концентрація іонів водню, моль/л; Еок/від – окисно-відновний потенціал, В; Е0ок/від – стандартний окисно-відновний потенціал, В; R – молярна газова постійна, Дж/моль×К; n – кількість електронів, які приймають участь у окисно-відновній реакції, моль; T – абсолютна температура, К; F – постійна Фарадея, 96500 Кл×моль-1; a,b,n – стехіометричний коефіцієнт. Якщо підставити числове значення констант, відповідних 200С, і перейти до натуральних логорифмівдо десятичних, то рівняння Нериста прийме вид: Еок/від = Е0ок/від + Багато окисно-відновних реакцій зворотні. Напрямок і повноту протікання окисно-відновної реакції можна визначити, виходячи із константи рівноваги. 2Fe3+ + Sn2+ D 2Fe2+ + Sn4+ в момент рівноваги наступає рівності потенціалів реагуючих речовин Стан динамічної рівноваги характеризується константою:
де
Значення константи дозволяє оцінити повноту протікання реакції. Для визначення константи рівноваги необхідно використовувати рівняння, які виражають її залежність від нормальних окисно-відновних потенціалів реагуючих пар: lgK = де n – кількість електронів, які приймають участь у віденовленні 1 моль окисника, моль. Велике значення константи рівноваги значать, що реакція є практично незворотньою і тому використовується у кількісному аналізі. Реакція окислення-відновлення, відрізняється від реакції нейтралізації, осадження і комплексоноутворення, протікає з вимірювальною швидкістью. Тому при використанні окисно-відновних реакцій у титриметричному методі аналізу використовують засоби для підвищення швидкості реакції: збільшують концентрацію реагуючих речовин, підвищують температуру, вводят каталізатор. В процесі оксидиметричного титрування, у зв’язку зі зміненням концентрації реагуючих іонів, безпереривно змінюється потенціал системи. Після додавання кожної порції розчину в системі буде встановлюватись рівновага потенціалів реагуючих речовин. Коли стан системи приближується до еквівалентного співвідношення реагуючих компонентів, потенціал системи змінюється довольно різко, таке явище називають “стрибком” потенціалу, а при досягненні системою еквівалентності, потенціал системи має данне значення. Графічне зображення змінення потенціалу системи у координатах: додаваємого окисника або відновника – потенціал системи, називають кривою редокс-титрування. Досягнення системою еквівалентності при титруванні окисника або відновника визначають за допомогою індикаторів, які в залежності від хімічної природи проявляють різні властивості. Незворотні – це індикатори, які розрушаються під дією окисника. Наприклад, у броматометрії використовують індикатор метиловий червоний. Зворотні – це індикатори, які змінюють забарвлення у залежності від окисно-відновного потенціалу системи. Наприклад, при титруванні окисника використовують індикатор дифеніламін або його похідні. Специфічні – це індикатори, які дають специфічну кольорову реакцію з розчинами речовин, які титрують або якими титрують. Наприклад, розчин крохмалю є специфічним індикатором на йод. Безіндикаторні методи. Наприклад, розчин перманганату калію має забарвлення червоно-фіолетового кольору, тому при титруванні цим розчином момент еквівалентності легко встановити по рожевому забарвленню, яке виникає у розчині після того, як весь відновник окислений і до розчину додали невеликий надлишок окисника.
Завдання для виконання самостійної роботи Відповісти на запитання: 1. Загальна зарактеристика методів окислення-відновлення. 2. Вимоги, які пред’являють до реакцій у методах оксидиметрії. 3. Вплив різних факторів на швидкість окисно-відновної реакції. 4. Змінення окисно-відновного потенціалу у процесі титрування. 5. Окисно-відновні індикатори. 6. Інтервал переходу забарвлення окисно-відновного індикатору. 7. Класифікація методів оксидиметрії. 8. Визначення окисника, відновника і речовин, які не є окисниками і відновниками. Скласти рівняння реакцій: 1. Визначте еквівалент окисника та відновника у рівнянні реакції: 2КМnO4 + 5Н2С2О4 + 3H2SO4 ® 2МnSO4 + 10СO2 + К2SO4 + 8H2O Bi2S3¯ + HNO3 ® Bi2(SO4)3 + NO + H2O Na2MoO4 + HCl+ Al ® MoCl2 + AlCl3 + NaCl + H2O KMnO4 + NaNO2 + KOH ® K2MnO4 + NaNO3 + H2O Sb2O3¯ + HbrO3 ® Sb2O5¯ + HBr Fe + HNO3 ® Fe(NO3)2 + NH4NO3 + H2O САМОСТІЙНА РОБОТА № 6. Тема: Методи перманганатометрії та йодометрії.
Повинні знати: сутність перманганатометрії та йодометрії; визначення прямого та зворотного титрування, титрування по заміщенню, та галузь їх застосування у технохімічному контролі харчових виробництв. Повинні вміти: визначати еквівалентні маси окислювачів і відновників; пояснювати особливості окислювання перманганату калію в різних середовищах.
План: Перманганатометрія. Йодометрія. 3. Характеристика розчинів, які використовують в йодометрії.
Стислі теоретичні відомості
Перманганатометрія. Пермангонатометрія – це метод титриметричного аналізу, у якому речовину визначають титруванням розчину перманганату калію. Перманганат – іон, є окисником, може відновлюватись в залежності від умов до іона двухвалентного марганцю (Мn2+), до оксиду марганцю (ІV) (МnО2), а точніше до його гідрату МnО(ОН)2 або марганат-іону МnО42-. У кислому середовищі МnО4- відновлюється до Мn2+. 5Fe2+ + МnО4- + 8H+ = 5Fe3+ + Мn2+ + 4H2O
5 Fe2+ - e = Fe3+ Еквівалент окисника і відновника залежить від реакції, в якій приймає участь речовина. У даній реакції еквівалентна маса дорівнює: М (КМnО4)од. = Еквівалентна маса відновника FeSO4 дорівнює: М (FeSO4)од. = М (FeSO4) = 152 г/моль. У нейтральному, слабокислому або слаболужному середовищі іон МnО4- приймає три електрони, при цьому утворюється осад МnО2 або МnО(ОН)2 бурого кольору: МnО4- + 3H2О + 3e = МnО(ОН)2 + 4ОН-. У лужному середовищі іон МnО4- приймає тільки один електрон, при цьому утворюється іон МnО42- зеленого кольору. МnО4- - е = МnО42- Перманганатометричні визначення частіше всього проводять у кислому середовищі і дуже рідко у слабокислому і нейтральному, так як утворення темно-бурого осаду МnО2 затрудняє встановлення точки еквівалентності, в той час як у кислому середовищі цю точку легко встановити по обезбарвленню перманганату у результаті відновлення його до безкольорового іону Мn2+. Перманганат калію є сильним окисником. Його нормальний окисно-відновний потенціал при відновленні до Мn2+ дорівнює:
Нормальний окисно-відновний потенціал пари MnO-4 / MnO2 дорівнює:
Значить, окисна способність КМnО4 у кислому середовищі незрівнянно вище, чим у лужному. Кислотність титруємих розчинів краще всього здійснювати додаванням сірчаної кислоти. Соляна кислота непридатна, так як може окислювати НСІ перманганатом калію до хлору. Перманганатометрію використовують для кількісного визначення не тільки відновників, но і окисників. Визначая окисники, використовують метод титрування по осаду, а значить до аналізуємого розчину окисника додають надлишок розчину відновника відомої концентрації, а потім залишок відновника відтитровують розчином перманганату калію.
Йодометрія. Йодометрія належить до найбільш використовуємого і точного титриметричного методу аналіза. В її основі лежать окисно-відновні процеси, які пов’язані з відновленням І2 до йодид-іонів (І-) або окисненням йодид-іонів до І2. J2 + 2 е- = 2J 2J - 2 е = J2 Йод є окисником середньої сили. Тому у водних розчинах сильні відновники легко окислюються, а сильні окисники виділяють вільний йод із розчинів йодидів. У зв’язку з цим методом йодометрії можна кількісно аналізувати як окисники, так і відновники. Умови проведення прямої і зворотньої реакції різні. Пряма реакція проходить в слаболужному середовищі при мінімальній концентрації йодид-іонів. Зворотній реакції більш підходить кисле середовище і висока концентрація йодид-іонів. Для кількісного визначення вільного йоду у розчині по методу йодометрії використовують взаємодію його з тіосульфатом натрію. Присутність у тіосульфат-іоні S2O32- сірки, з ступенем окиснення мінус два, визначає його сильні відновлювальні властивості, які приводять у результаті реакції до виникнення дисульфатної групи –S – S -. Йод взаємодіє з тіосульфатом натрію слідуючим чином: І2 + 2Na2S2O3 = 2NaІ + Na2S4O6 І2 + 2S2O32- = 2І- + S4O62-
1 2S2O32- - 2е = S4O62- Із рівняння реакції видно, що еквівалентна маса йоду дорівнює молярній масі йоду поділенної на два, а еквівалентна маса тіосульфату дорівнює його молярній масі. М (І2)од. = М (Na2S2O3 × 5Н2О)од. = М (Na2S2O3 × 5Н2О) = 248,12 г/моль. При йодометричному визначенні сильних окисників в розчин вводять надлишок йодиду калію, після чого виділяється еквівалентна кількість йоду: Cr2O72- + 6I- + 14H+ = 2Cr3+ + 3I2 + 7H2O ClO3- + 6I- + 6H+ = 3I2 + Cl- + 3H2O H2O2 + 2I- + 2H+ = I2 + 2H2O 2Fe3+ + 2I- = I2 + 2Fe2+ 2MnO4 + 10I- + 16H+ = 5I2 + 2Mn2+ + 8H2O Йод, який утворився титрують розчином тіосульфату натрію у присутності індикатору (розчин крохмалю) і визначають масу або кількість окисника. Йодометрично можна визначити також і концентрацію кислот у розчині, наприклад: 6НСІ + 5КІ + КІО3 = 3І2 + 6КСІ + 3Н2О. Кількість йоду, який виділився у результаті реакції, еквівалентно кількості іонів водню. Тому, відтитрував йод розчином тіосульфату, визначають концентрацію кислоти у розчині. Косвенний спосіб йодометричного визначення окисників та кислот називають методом заміщення, так як при цьому речовини, не взаємодіють з розчином тіосульфату натрію, заміщають еквівалентною кількістью йоду, який потім визначають. Існують слідуючі помилки при йодометричному визначенні. Йод і його розчини є леткими, тому, щоб зменшити помилки із-за леткості йоду, усі роботи необхідно, по можливості, виконувати у закритих склянках або колбах і на холоді. При аналізі окисників у розчині утворюють великий надлишок йодиду калію, щоб перевести молекулярний йод, який утворюється при реакції, у розчин і зменшити його леткість, про що вказувалося вище. Другою причиною помилок є окислення йодиду калію киснем повітря: 4I- + 4H+ + О2 = 2I2 + 2H2O Тому не слід залишати на тривалий час підкислені розчини йодиду калію. У йодометрії в якості індикатору використовують розчин крохмалю, який утворює з йодом сполуку синього коліру. Крім того, крохмаль адсорбірує багато йоду і дуже повільно десорбірує його у розчин. Тому, щоб не виникло помилки при титруванні йоду тіосульфатом, крохмаль додають почти у самому кінці титруванні, коли вільного йоду у розчині залишається мало і буре забарвлення розчину стає блідно-жовте (солом’яного коліру).
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 140; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.104.175 (0.012 с.) |


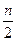 Н2О.
Н2О.



 - концентрація іонів заліза окисленої та відновненої форми, моль/л;
- концентрація іонів заліза окисленої та відновненої форми, моль/л; - концентрація іонів олова окисленої та відновненої форми, моль/л.
- концентрація іонів олова окисленої та відновненої форми, моль/л.
 - стандартні окисно-відновні потенціали окисника та відновника, В;
- стандартні окисно-відновні потенціали окисника та відновника, В; 1 МnО4- + 8H+ + 5e = Мn2+ + 4H2O
1 МnО4- + 8H+ + 5e = Мn2+ + 4H2O г/моль
г/моль = +1,52 В.
= +1,52 В. = +0,59 В.
= +0,59 В. 1 І2 + 2е = 2І-
1 І2 + 2е = 2І-



