
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сутність потенціонометричного аналізу.Содержание книги
Поиск на нашем сайте
Потенціонометричний аналіз полягає у визначенні вмісту іонів за допомогою вимірювання електрохімічного потенціалу електрода, зануреного у досліджуваний розчин. Потенціонометричний аналіз був розроблений наприкінці ХІХ ст., після того, як В. Г. Нернст вивів рівняння, яке пов’язує величину потенціалу металічного електрода з концентрацією іонів цього ж металу у розчині: Ех = Е0 + де Ех – потенціал металічного електрода за даної концентрації іонів металу у розчині; Е0 – потенціал цього ж електрода у розчині з концентрацією іонів, рівний одиниці (1 моль/л) – нормальний потенціал; Сме – концентрація іонів металу; R – газова стала (8,313 Дж); Т – абсолютна температура; F – число Фарадея (96500 К); n – заряд іона металу. Якщо підставити в рівняння (1) відповідні значення R і Т (t = 250С) і врахувати коефіцієнт переходу від натуральних логарифмів до десяткових (2,3026), то рівняння Нернста матиме такий вигляд: Ех = Е0 + Згадуємо, що електродний потенціал – це різниця потенціалів, яка виникає між металевою пластинкою і розчином його солі. Нормальний (стандартний) потенціал – це потенціал, який виникає при зануренні металу у розчин з концентрацією іонів металу 1 моль/л. Потенціонометричне титрування, полягає у тому, що в досліджуваний розчин занурюють індикаторний електрод і титрують розчин, вимірюючи у процесі титрування потенціал електрода. Концентрація іонів, що визначають, змінюється в залежності від об’єму добавленого робочого розчину нерівномірно. Спочатку ця зміна невелика, потім вона стає помітною і наприкінці, в точці еквівалентності, досягає найбільшого значення. Потенціонометричне титрування застосовують головним чином для визначення досить великих кількостей речовини. Порівняно з іншими методами потенціометричне титрування має такі переваги: 1) дає змогу титрувати забарвлені розчини (кольорові індикатори непридатні, як і колориметричний метод); 2) легко визначити кілька речовин у суміші без попереднього їх розділення. Залежить від типу хімічної реакції потенціонометричне титрування застосовують при: а) методах осадження і комплексоутворення; б) окислення – відновлення; в) кислотно-основного титрування. У потенціометрії дуже важливо правильно вибрати відповідний індикаторний електрод для визначення точки еквіалентності. Більш точним є компенсаційний метод, коли різницю потенціалів вимірюють у відсутності струму в ланцюгу за допомогою звичайного містка з натягнутим дротом-реохордом. Нині користуються спеціальними приладами-потенціометрами, які дають змогу вимірювати потенціали електродів з великою точністю. Електроди, які використовуються для визначення концентрації іонів металів у розчинах, називаються індикаторними. Індикаторний електрод з’єднують з другим електродом у гальванічний елемент і вимірюють різницю потенціалів між обома електродами. Потенціал другого електрода постійний і його величина відома – такі електроди називають стандарними, або електродами порівняння. Знаючи різницю потенціалів між електродами і значення потенціалу стандартного електрода, обчислюють потенціал індикаторного електрода. Електроди порівняння. Величина потенціалів електродів порівняння відомі. Це дає змогу застосовувати їх в абсолютній потенціонометрії, коли необхідно визначити абсолютну величину потенціалу, індикаторного електрода, а не тільки зміну цієї величини в процесі титрування. Найчастіше використовують такі стандартні електроди: каломельний та хлорно-срібний. Каломельний електрод – це посудина, на дні якої є шар добре очищеної ртуті завтовшки 4 – 5 см, вкритий шаром каломельної пасти (Нg2СІ2). Зверху паста вкрита шаром кристалічного хлориду калію та його насиченим розчином. Струм від ртуті відводиться за допомогою платинової дротини, впаяної в скляну трубку. Потенціал каломельного електрода залежить лише від концентрації іонів хлориду, яка залишається сталою. Хлорно-срібний електрод – це срібний дріт, вкритий шаром хлориду срібла (він добре проводить електричний струм), занурений у насичений розчин хлориду калію. Хлорно-срібні електроди входять у деякі комплекси вимірювальних прилвдів. Індикаторні електроди. Вимоги до індикаторних електродів можуть бути різними залежно від того, де вони використовуються – в абсолютній потенціонометрії чи в потенціометричному титруванні. В обох випадках індикаторні електроди повинні бути оборотними, тобто їхній потенціал повинен змінюватися із зміною концентрації іонів металу в розчині у відповідності з рівняннями Нернста. Індикаторні еленктроди повинні бути хімічно стійкими по відношенню до речовини, які містяться у розчині. У методах кислотно-основного титрування необхідно вимірювати концентрацію водневих іонів розчину. Для цього найчастіше користуються водневим, хінгідронним, скляним електродами. Водневий електрод – це платинова пластинка, вкрита електролітично губчастою платиною, яка насичена воднем. Під час занурення такого електрода у розчин з певною концентрацією водневих іонів між воднем, адсорбованим губчастою платиною, і іонами водню у розчині встановлюється рівновага, а потенціал електрода визначається рівнянням: Ех = Е0 + 0,058 lg [Н+] де Е0 – потенціал нормального водневого електрода. Нормальним, або стандартним, водневим електродом називається водневий електрод, у якому платиновий провідник насичений воднем під тиском 101 кПа, занурений у розчин з концентрацією іонів водню 1 моль/л при температурі 250С. Нормальний потенціал водневого електрода прийнято вважати рівним нулю, тому Ех = 0,058 lg [Н+] Звідси рН = - Хінгідронний електрод – це скляна посудина з платиновим електродом, зануреним у насичений розчин хінгідрону. Хінгідрон – це малорозчинна молекулярна сполука хінону і гідрохінону, яка у розчині розпадається на хінон і гідрохінон: С6Н4О2 × С6Н4(ОН)2 D С6Н4О2 + С6Н4(ОН)2 хінгідрон хінон гідрохінон В останні роки почали широко використовувати скляний електрод, що являє собою кульку з дуже тонкого спеціального скла, в яку наливають електропровідний розчин. У цей розчин занурюють срібну дротину, на поверхню якої наносять хлорид срібла. Електродна реакція в ньому полягає в обміні іонами водню між рідкою фазою (рН якої вимірюється) і склом: Н+ D Н+скла Потенціал скляного електрода перебуває у повній залежності від концентрації іонів водню, що дає змогу використовувати його для вимірювання рН.
Стисла характеристика електродів.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 172; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.120.103 (0.009 с.) |

 Сме (1)
Сме (1)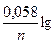 Сме (2)
Сме (2)



