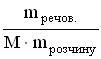Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічна кінетика і термодинамікаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1.Який закон лежить в основі визначення швидкості хімічної реакції? A *діючих мас B Вант-Гоффа C Генрі D Рауля E періодичний закон Менделєєва
2.Закон діючих мас описує залежність швидкості хімічних реакцій від: A *Концентрацій реагуючих речовин B Площі поверхні стикання реагуючих речовин C Природи реагуючих речовин D Температури системи E Наявності каталізаторів
3.Реакція між натрієм и водою є: A *екзотермічною, заміщення B ендотермічною, сполучення C ендотермічною, обміну D ендотермічною, заміщення E ендотермічною, оборотньою
4.Принцип Ле-Шательє дає можливість контролю протікання хімічної реакції як в лабораторії, так і в промисловості. Вкажіть, який з наведених процесів повинен проводитися при підвищеному тиску: A *3H2(г)+N2(г)=2NH3(г) B Fe(т)+H2O(пара)=FeO(т)+H2(г) C N2(г)+O2(г)=2NO(г) D C(т)+О2(г)=CO2(г) E H2(г)+Cl2(г)=2HCl(г)
5.При розчиненні солі в воді температура розчину зменшилась. Значить це процес: A *ендотермічний B екзотермічний C ізобаричний D адіабатичний E ізохоричний
6.В яких одиницях вимірюється швидкість хімічної реакції в гомогенних системах? A *Моль•л-1•с-1 B Моль•мл-1•с-1 C Моль•м3•с-1 D Моль•л-1•хв-1 E Моль•м2•хв-1
7.До зростання швидкості реакції внаслідок збільшення енергії молекул приводить: A *Нагрівання B Освітлення C Опромінення D Охолодження E Всі названі способи
8.На скільки градусів потрібно підвищити температуру, щоб швидкість зросла у 64 рази, якщо γ=2,0? A *На 60°С B На 40°С C На 50°С D На 70°С E На 80°С
9.У скільки разів слід підвищити тиск, щоб швидкість утворення NO2 в реакції 2NO + O2 = 2NO2 зросла у 8 раз? A *2 B 5 C 20 D 50 E 100
10.Як зміниться швидкість реакції 2CО+О2= СО2 між карбону (II) оксидом і киснем, якщо концентрацію вихідних речовин збільшити в 5 разів? A *Зросте в 125 раз B Зросте в 5 раз C Зросте в 25 раз D Зросте в 175 раз E Зросте в 625 раз
11.Який із наведених записів, згідно закону діючих мас, виражає швидкість процесу 2SO2(г) + O2(г) = 2SO3(г): A *k[SO2]2•[O2]. B k[2SO2]•[O2]. C k[SO2]•[O2]. D k[SO2]2 + [O2]. E [SO2]2 + [O2].
12.Одним із законів хімічної кінетики є закон, який формулюється так: "швидкість хімічної реакції пропорційна добутку молярних концентрацій реагуючих речовин". Це закон: A *діючих мас B сталості складу
C еквівалентів D розведення Оствальда E збереження маси речовин
13.Під нормальними умовами (н.у.) в хімії розуміють слідуючі числові значення тиску та температури: A *р=101,3 кПа; Т=273К B р=101,3 атм; Т=298К C р=760 мм.рт.ст; Т=1000ºС D р=1,013 кПа; Т=0ºС E р=760 мм.рт.ст; Т=250ºС
14.Під стандартними в хімії розуміють слідуючі числові значення тиску та температури: A *р=101,3 кПа; Т=298К B р=101,3 атм; Т=273К C р=760 мм.рт.ст; Т=1000ºС D р=1,013 кПа; Т=0ºС E р=760 мм.рт.ст; Т=250ºС
15.Експериментально теплоти згоряння (а також ентальпії утворення) визначають приладом: A *Калориметром B Спектрофотометром C Апаратом Кіппа D Колориметром E Кондуктометром
16.Чому дорівнює температурний коефіцієнт реакції, якщо при підвищенні температури на 50ºС швидкість хімічної реакції зростає у 32 рази? A *2 B 4 C 5 D 6 E 3
17.Каталізатори, які сповільнюють швидкість хімічної реакції при підвищенні температури, називають: A *Інгібітори B Інсульти C Інкубатори D Інтерферометри E Інградієнти
18.Речовини білкової природи, які виробляються клітинами живих організмів і значно збільшують швидкість біохімічних реакцій, це - … A *Ферменти (ензими) B Феромагнетики C Ферити D Фулерени E Ферати
19.Яке співвідношення представляє собою константу рівноваги для хімічної рівноваги, що описується рівнянням реакції: 2NO(г) + О2(г) = 2NO2(г)? A* B C D E 20.Зміщенню рівноваги в системі 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(г); ∆Н<0 в сторону утворення продуктів реакції сприяє все, окрім: A *Підвищення температури B Підвищення концентрації H2S C Пониження концентрації SO2 D Підвищення тиску E Пониження температури
21.Швидкість реакції Fe2O3(т) + 3H2(г) = 2Fe(т) + 3H2O(пара) при V=const і збільшенні кількості H2 в 2 рази зросте у: A *8 разів B 2 рази C 4 рази D 16 разів E 6 разів
22.Швидкість яких реакцій підвищується із зростанням температури? A *ендотермічних B екзотермічних C будь-яких D окисно-відновних E каталітичних
23.Гомогенними називають реакції: A *які відбуваються в однорідному середовищі B які відбуваються в неоднорідному середовищі C які відбуваються з виділенням тепла D які відбуваються з поглинанням тепла E жодної правильної відповіді
24.В якому напрямі зміститься рівновага реакції 2NOCl=2NO+Cl2 при підвищенні тиску?
A *вліво B не зміниться C вправо D зміниться E жодної правильної відповіді
25.Як зміниться швидкість прямої хімічної реакції N2 +3H2 = 2NH3, якщо об’єм газової суміші зменшити в 3 рази? A *збільшиться у 81 раз B збільшиться у 27 раз C збільшиться у 9 раз D збільшиться у 3 рази E зменшиться у 27 раз
26.Чому дорівнює температурний коефіцієнт реакції, якщо при підвищенні температури на 60ºС швидкість хімічної реакції зростає у 1500 раз? A *3,4 B 2,7 C 3,8 D 1,4 E 2,4
27.У скільки разів швидкість прямої реакції 3О2 = 2О3 більша від швидкості зворотної при збільшенні тиску в 3 рази? A *у 3 рази B у 27 раз C у 9 раз D у 81 раз E у 6 раз
28.В якому напрямі зміститься рівновага реакції N2+O2=2NO при підвищенні тиску? A *не зміниться B вліво C вправо D зміниться E жодної правильної відповіді
29.В яких межах змінюється температурний коефіцієнт швидкості для більшості реакцій? A *2-4 B 2-3 C 3-4 D 4-5 E 5-6
30.Яке рівняння є математичним виразом закону діючих мас для реакції 2NO(г) + Cl2(г) = 2NOCl(г): A *k[NO]2•[Cl2] B k[NO]•[Cl2] C k[NOCl2] D k[NO]2•[Cl]2 E k2[NO]•[Cl2].
31.Яке рівняння є математичним виразом закону діючих мас для реакції 2Al(т) + 3Cl2(г) = 2AlCl3(т): A *k[Cl2]3 B k[Al]2•[Cl2]3 C k[Al]•[Cl2] D k[Al]2•[Cl]3 E жодної правильної відповіді
32.Як зміниться швидкість хімічної реакції між оксидом карбону (II) та киснем, якщо концентрацію вихідних речовин збільшити в 5 раз? A *збільшиться у 125 раз B збільшиться у 25 раз C збільшиться у 5 раз D збільшиться у 35 рази E не зміниться
33.У скільки разів слід збільшити концентрацію водню в системі N2 + 3H2 = 2NH3, щоб швидкість прямої реакції збільшити в 125 раз? A *у 5 раз B у 15 раз C у 25 раз D у 3 рази E у 27 раз
34.Чому дорівнює константа рівноваги реакції І2 + H2 = 2НІ, якщо константа швидкості прямої реакції дорівнює 0,16, а зворотної – 0,05? A *3,2 B 2,3 C 0,3 D 1,8 E 2,7
35.Які з перерахованих взаємодій приведуть до зміни константи швидкості реакції? A *зміна температури B зміна тиску C зміна реакційного об’єму D введення в систему каталізаторів E освітлення
36.У скільки разів слід підвищити тиск, щоб швидкість утворення NO2 в реакції 2NO + O2 = 2NO2 зросла у 1000 раз? A *10 B 5 C 20 D 50 E 100
37.Обчисліть константу рівноваги реакції 2NO+O2=2NO2, якщо рівноважні концентрації дорівнюють: [NO2]=0,8 моль/дм3, [O2]=0,2 моль/дм3, [NO]=0,4 моль/дм3. A *20 B 16 C 18 D 22 E 24
38.Що вивчає хімічна термодинаміка? A *перетворення різних форм енергії при фізичних та хімічних процесах B перетворення різних форм енергії хімічних реакціях C теплові ефекти реакцій D перетворення лише певного виду енергії E жодної правильної відповіді
39.Для якої речовини ентальпія утворення не дорівнює нулю? A *С(алмаз) B С(графіт) C I2 D Cl2 E жодної правильної відповіді
40.Вкажіть речовину, для якої теплота утворення в стандартних умовах дорівнює нулю? A *O2 B H2O C CO2 D C6H12O6 E жодної правильної відповіді
41.Вкажіть речовину, для якої теплота утворення в стандартних умовах дорівнює нулю? A *N2 B H2O C CO2 D HF E жодної правильної відповіді
42.Хімічні процеси супроводжуються тепловими ефектами, що підпорядковуються такому закону:»Тепловий ефект реакції залежить від природи вихідних речовин та продуктів реакції і не залежить від шляху, по якому протікає процес». Це: A *Закон Гесса B Закон Генрі C Закон діючих мас D Закон Нернста E Закон Вант-Гоффа
43.Термодинамічні розрахунки дають змогу визначати можливість і напрям самовільних процесів. В ізольованій системі з цією метою використовують зміну термодинамічної функції:
A * Енергії Гіббса B Енергії Гельмгольца C Внутрішньої енергії D Ентропії E Ентальпії
44.Температурний коефіцієнт реакції дорівнює 3. У скільки разів зміниться швидкість реакції внаслідок зміни температури на 30°С? A * У 27 разів B У 18 разів C У 9 разів D У 36 разів E У 45 разів
45.Хімічна рівновага у системі FeO(т.)+H2(г.)=Fe(т.)+H2O(г); ∆H>0 зміститься в бік утворення продуктів реакції за: A *підвищення температури B підвищення тиску C використання каталізатора D зниження тиску E підвищення концентрації H2
Електролітична дисоціація 1.Яка з наведених сполук не є електролітом? A *[Fe(CO)5] B Na3[Co(NO2)6] C HCN D H2O E NaOH
2.Вкажіть одноосновну кислоту: A *H[PO2H2] B H2[PO3H] C H3PO4 D H4P2O7 E -
3.Вкажіть колір фенолфталеїну у розчині натрій сульфіду: A *Малиновий B Безбарвний C Синій D Жовтий E Зелений
4.Як дисоціює йон Н2РО4-? A *У дві стадії, за кожною частково B В одну стадію – частково C В одну стадію – повністю D Не дисоціює E -
5.Згідно теорії електролітичної дисоціації Арреніуса кислоти - це сполуки, що: A *у розчинах дисоціюють з утворенням йонів Гідрогену і кислотного залишку B у розчинах дисоціюють з утворенням йонів гідроксилу C реагують з активними металами з виділенням водню D при нагріванні розкладаються на кислотний оксид і воду E не реагують з металами в ряді напруг після Гідрогену
6.Які з нижченаведених електролітів відносяться тільки до слабких: A *NH3•H2O, CH3COOH B NH4Cl, NH3•H2O C CH3COOH, CH3COONa D HCl, AgCl E AgCl, NH4Cl
7.Які пари іонів не можуть одночасно перебувати у помітних кількостях у водному розчині: A *H+ та CO32- B Na+ та SO42- C K+ та OH- D Ca2+ та HCO- E Ag+ та NO3-
8.Вкажіть пару електролітів, реакція між якими у водному розчині неможлива: A *NaBr та KOH B Na2S та HCl C K2CO3 та H2SO4 D Fe(NO3)3 та NaOH E NaCl та AgNO3
9.Взаємодії яких речовин відповідає скорочене іонне рівняння: H+ + OH- =H2O A *KOH та HNO3 B NaOH та H2S C NH3•H2O та HCl D NH3•H2O та H2CO3 E NH3•H2O та CH3COOH 10.Вкажіть правильний варіант запису виразу для добутку розчинності (ДР) ортофосфата кальцію, який дисоціює за рівнянням Ca3(PO4)2 = 3Ca2+ + 2PO43- A *ДР{Ca3(PO4)2}= [Ca2+]3•[PO43-]2 B ДР{Ca3(PO4)2}=[Ca2+]3•[PO43-]2 /[Ca3(PO4)2 C ДР{Ca3(PO4)2}= [Ca2+]3 + [PO43-]2 D ДР{Ca3(PO4)2}= 3[Ca2+]3 • 2[PO43-]2 E ДР{Ca3(PO4)2}= 3[Ca2+]3 + 2[PO43-]2
11.Вкажіть, яку сіль не можна отримати в водному розчині: A *Al2S3 B FeSO4 C Na2S D AlCl3 E Cr2(SO4)3
12.У 0,1 М розчині якої речовини є найбільша кількість йонів? A *Na3PO4
B KCl C HCl D MgCl2 E H2SO4
13.Вкажіть, яку сіль не можна одержати у водному розчині? A *Cr2S3 B K3PO4 C NaNO3 D FeCl3 E NH4Cl
14.Яких йонів знаходиться найбільше у водному розчині ортофосфатної кислоти? A *H+ B H2PO4- C HPO42- D PO43- E OH-
15.Вкажіть, який із наведених водних розчинів, які мають однакові молярні концентрації, найгірше проводить електричний струм? A *розчин ціанідної (синильної) кислоти B розчин ціаніду калію C розчин сульфатної кислоти D розчин гідроксиду калію E розчин сульфату калію
16.Як дисоціює гідрогенфосфат-йон? A *В одну стадію – частково B В одну стадію – повністю C У дві стадії: за першою – повністю, за другою – частково D У дві стадії, за кожною – частково E У дві стадії: за першою – частково, за другою – повністю
17.Вкажіть колір лакмусу у розчині нітрату феруму(III): A *червоний B фіолетовий C синій D малиновий E індикатор не матиме кольору
18.Вкажіть колір лакмусу у розчині карбонату натрію: A *синій B фіолетовий C червоний D індикатор не матиме кольору E малиновий 19.Вкажіть колір метилоранжу в розчині карбонату калію: A *жовтий B оранжевий C рожевий D безбарвний E синій
20.Вкажіть колір фенолфталеїну у розчині хлориду алюмінію: A *безбарвний B малиновий C жовтий D синій E червоний
21.Вкажіть колір фенолфталеіну в розчині ортофосфату калію: A *малиновий B безбарвний C червоний D синій E жовтий
22.Вкажіть колір метилоранжу в розчині сульфату цинку: A *рожевий B оранжевий C жовтий D безбарвний E синій
23.Вкажіть пару сполук, які можуть бути одночасно в розчині: A *Al(NO3)3 та HCl B Ba(OH)2 та CO2 C NaOH та P2O5 D CuSO4 та BaCl2 E AgNO3 та HCl
24.Яку сіль треба розчинити у воді, щоб збільшити в ній концентрацію йонів Гідрогену? A *ZnCl2 B Na2CO3 C NaCl D K3PO4 E K2SO4
25.Виходячи зі значень добутків розчинності [ДР], вкажіть, у якій з реакцій можна якомога повніше осадити катіони Ca2+ з розчину? A *Ca2+ + 2F- = CaF2, ДР [CaF2] =4,0·10-11 B Ca2+ + SO42- = CaSO4, ДР[CaSO4]=9,1·10-8 C Ca2+ + СO32- = CaCO3, ДР[CaCO3]=4,8·10-9 D Ca2+ + С2O42- = CaC2O4, ДР[CaC2O4]=3,8·10-9 E Ca2+ + СrO42- = CaCrO4, ДР[CaCrO4]=2,3·10-2
26.Яка константа дисоціації багатоосновної кислоти завжди більша за величиною? A *Перша B Друга C Третя D Четверта E Остання
27.Ступінь дисоціації гідрату амоніаку NН3•H2O ↔ NH4+ + OH- збільшується при: A *Розведенні розчину. B Охолодженні розчину. C Концентруванні розчину. D Додаванні солі амонію. E Додаванні лугу.
28.Яка з представлених сполук є слабким електролітом: A *Mg(OH)2 B Ca(OH)2 C Ba(OH)2 D NaOH E KOH
29.Яка з представлених кислот є слабким електролітом: A *H3BO3 B HNO3 C HCl D HBr E H2SO4
30.Чи можна за допомогою однієї реакції, використавши водні розчини, перетворити PbSO4 на PbS? A *Використайте значення добутків розчинності B Ні C Необхідно знати концентрацію йонів свинцю D Необхідно знати концентрацію сульфід-йонів E Використати молярну розчинність PbSO4 та PbS
31.Яка з нижченаведених реакцій йде практично до кінця? A *Хлоридна кислота+нітрат срібла B Сульфатна кислота+хлорид натрію C Хлорид калію+нітратна кислота D Хлорид натрію+гідроксид калію E Сульфатна кислота+гідроксид калію
32.Який з наступних електролітів при дисоціації утворює йони Н+ і ОН- одночасно? A *Zn[OH]2 B Ca[OH]2 C NaOH D H3PO4 E Sr[OH]2
33.Яка речовина в йонному рівнянні наступної реакції записується у виді молекули: HCl + AgNO3 = AgCl + HNO3 A *AgCl B AgNO3 C HNO3 D HCl E Жодна з приведених речовин
34.При взаємодії розчинів яких двох солей реакція є необоротною? A *сульфат натрію+нітрат барію B Хлорид калію+сульфат магнію C Нітрат кальцію+хлорид амонію D Хлорид натрію+бромід калію E Сульфат амонію+йодид натрію
35.Реакція між розчинами Na2SiO3 і H2SO4 йде до кінця, тому що: A *Утворюється нерозчина силікатна кислота. B Утворюється розчинний натрій сульфат C Це реакція іонного обміну. D Сульфатна кислота – сильна кислота. E –
36.Між розчинами яких сполук можливий перебіг незворотньої реакції A *Fe2(SO4)3+NaOH B CaCl2+NaOH C Ca(OH)2+NaCl D FeCl3+Na2SO4 E Fe2(SO4)3+NaCl
38.Розрахуйте ступінь дисоціації CuSO4 (в %), якщо ізотонічний коефіцієнт розчину дорівнює 1,6: A *60 B 50 C 55 D 65 E 70
39.Розрахуйте ступінь дисоціації CuCl2 (в %), якщо ізотонічний коефіцієнт розчину дорівнює 1,9: A *45 B 50 C 55 D 65 E 40
40.Яке максимальне значення ізотонічного коефіцієнту кальцію хлориду у водному розчині? A *3 B 4 C 5 D 2 E 1
41.Яке максимальне значення ізотонічного коефіцієнту магнію сульфату у водному розчині? A *2 B 4 C 5 D 3 E 1
42.Йонний добуток води при температурі 22°С дорівнює: A *10-14 B 10-7 C 10-10 D 10-15 E 10-1
43.Вкажіть, яку сіль не можна отримати в водному розчині: A *Al2(СО3)3 B FeSO4 C Na2S D AlCl3 E Cr2(SO4)3
44.Вкажіть, яку сіль не можна отримати в водному розчині: A *Cr2(СО3)3 B FeSO4 C Na2S D AlCl3 E Cr2(SO4)3
Розчини 1.Для приготування 500 г 10% розчину натрій гідроксиду необхідно взяти: A *50 г B 0,5 г C 5 г D 10 г E 25 г
2.У 0,1 М розчині якої з наведених кислот найбільша концентрація йонів Гідрогену? A *HCl B HCN C H2CO3 D CH3COOH E H2SO3
3.Кислотність середовища характеризується величиною водневого показника. Вкажіть величину рН 0,1М розчину НCl. A *1 B 0 C 2 D 3 E 4
4.Вкажіть концентрацію йонів Гідрогену в чистій воді: A *10-7 B 10-9 C 10-14 D 10-5 E 10-3
5.Яку сіль треба розчинити у воді, щоб збільшити концентрацію йонів Гідрогену? A *ZnCl2 B NaNO3 C KCl D Na2CO3 E Na2S
6.Розчин з масовою часткою NaCl 0,95% входить до складу фізіологічного розчину та викоритовується при значній втраті крові. Вкажіть реакцію середовища даного розчину: A *Нейтральна (pH = 7) B Кисла (pH < 7) C Лужна (pH > 7) D Дуже кисла (pH = 1) E Дуже лужна (pH = 12)
7.рН розчину дорівнює 4. Обчисліть концентрацію [H+] (моль/л): A *10-4 B 4 C 10-10 D 10 E 102
8. 0,9% розчин хлориду натрію називають фізіологічним, тому що він: A *має осмотичний тиск, рівний осмотичному тиску крові B містить іони, що входять до складу крові C добре розчинний у крові D містить нетоксичні для організму речовини E не впливає на кислотно-основний баланс крові
9.Щоб зменшити концентрацію у воді ОН-, треба додати: A *кислоту B натрію нітрат C луг D аміак E воду
10.Які йони в значній кількості можуть одночасно знаходитись у розчині? A *Na+ і OH- B Zn2+ і OH- C Al3+ і OH- D Cu2+ і OH- E H+ і CO32-
11.Кількість розчиненої речовини, що міститься в 1 дм3 розчину, визначає: A *Молярну концентрацію B Масову частку C Молярну концентрацію еквіваленту D Мольну частку E Моляльну концентрацію 12.Водневий показник 0,005 М розчину сульфатної кислоти дорівнює: A *2 B 0 C 1 D 3 E 4
13.Для приготування 200 г 10% розчину калій йодиду необхідно взяти: A *20 г KI B 2 г KI C 0,2 г KI D 10 г KI E 4 г KI
14.У 0,1 М розчині якої з наведених кислот найбільша концентрація йонів Гідрогену? A *H2SO4 B HCl C H2CO3 D CH3COOH E H2SO3
15.Які з наведених пар йонів можуть одночасно знаходитися в розчині: A *Fe3+, Cl- B Ba2+, SO42- C Fe2+, OH- D Fe3+, OH- E Аg+, Cl-
16.В якому з приведених розчинів водневий показник дорівнює нулю? A *1M HCl B 0,1M HCl C 0,1M KOH D 1M H3PO4 E 1M Ba(OH)2
17.У розчині [ОН-] = 1•10-6 моль/л. Вкажіть рН розчину. A *8. B 6. C 1 D 7 E 4
18.У фармацевтичному аналізі, в якості титранту використовують 0,1 М розчин хлоридної кислоти. Який об'єм цієї кислоти можна приготувати виходячи з 100 cм3 0,5 М розчину HCl? A *500 cм3 B 50 cм3 C 200 cм3 D 1000 cм3 E 5000 cм3
19.Водневий показник 0,01 М розчину хлоридної кислоти дорівнює: A *2 B 0 C 1 D 3 E 4
20.Водневий показник 0,001 М розчину хлоридної кислоти дорівнює: A *3 B 0 C 10 D 7 E 5
21.Який з наведених розчинів має найбільший осмотичний тиск? A *1% розчин NaCl B 1% розчин ZnSO4 C 1% розчин глюкози D 1% розчин сахарози E 1% розчин білка
22.Водневий показник 0,001 М розчину KOH дорівнює: A *11 B 13 C 10 D 12 E 9
23.Водневий показник 0,05 М розчину H2SO4 дорівнює: A *1 B 2 C 5 D 4 E 3
24.Водневий показник 0,005 М розчину Ba(OH)2 дорівнює: A *12 B 13 C 10 D 11 E 9
25.Концентрація йонів Гідрогену у рівнянні для розрахунку рН виражається у: A *Моль/дм3 B Моль/см3 C Моль D Моль/кг E Мольних частках
26.До колігативних властивостей розчинів відносять A *осмос і осмотичний тиск B седиментаційну стійкість C кінетичну стійкість D ефект Тіндаля E синерезис
27.Яка концентрація гідроксид-йонів (в моль/дм3) в розчині, рОН якого рівний 9? A *10-9 B 10-3 C 10-1 D 10-5 E 10-7
28.Яка концентрація йонів водню (в моль/дм3) в розчині, рОН якого рівний 9? A *10-5 B 10-3 C 10-1 D 10-9 E 10-7
29.Розрахуйте масу натрію хлориду для приготування 100 г ізотонічного (0,9%) розчину, який використовують для внутрішньовенного введення. A *0,9 г B 1,8 г C 18 г D 0,36 г E 0,18 г
30.Розчинність малорозчинних речовин (типу AgCl або BaSO4) характеризують за допомогою спеціальної константи, яка називається: A *Добутком розчинності B Константою гідроліза C Ступінню дисоціації D Коефіцієнтом абсорбції E Ступінню гідролізу
31.Розчинність газів у воді при підвищенні температури: A *Зменшується B Не змінюється C Збільшується D Спочатку збільшується, а потім зменшується E Спочатку зменшується, а потім збільшується
32.При зберіганні відкритої колби з розчином солі на дні колби утворились кристали. Яким буде розчин над кристалами? A *Насиченим. B Ненасиченим. C Пересиченим. D Розбавленим. E Концентрованим.
33.В 0,1 М розчині якої речовини концентрація йонів найменша? A *СН3СООН B НCl C СаCl2 D H2SO4 E NaNO3
34.Для приготування 1 дм3 0,1М розчину сульфатної кислоти (М(H2SO4})=98 г/моль) необхідно взяти: A *9,8 г H2SO4 B 980 г H2SO4 C 0,098 г H2SO4 D 49 г H2SO4 E 98 г H2SO4
35.Вкажіть формулу, яку застосовують для обчислення молярної концентрації розчину A * B C D E
36.Молярна концентрація показує кількість розчиненої речовини A *в 1 дм3 розчину B в 1000 г розчину C в 1 кг розчинника D в 1 дм3 розчинника E в 100 г розчинника
37.Для приготування 1 дм3 1 М розчину натрій хлориду необхідно брати NaCl A *58,5 г B 5,85 г C 0,585 г D 1,170 г E 2,34 г
38.Закон Вант-Гоффа для осмотичного тиску виражається математичним рівнянням: A * Π=iCмRT B Π=m/MR T C Π=iCmRT D Π=iCнRT E Π=CmRT
39.У якому з наведених розчинів водневий показник дорівнює 14? A * 1М КОН B 0,1M HCl C 0,1M KOH D 1M H2SO4 E 1M HCl
40.Вкажіть розчин з мінімальним значенням йонної сили, якщо молярні концентрації їх дорівнюють 0,01 моль/дм3: A * NaNO3 B K2SO4 C CoCl2 D K3PO4 E (CH3COO)2Ca
41.Вкажіть розчин з максимальним значенням йонної сили, якщо молярні концентрації їх дорівнюють 0,01 моль/дм3: A * Al2(SO4)3 B K2SO4 C CoCl2 D K3PO4 E (CH3COO)2Ca
42.До складу буферних систем крові не входить такий буферний розчин: A *ацетатний B білковий C гідрокарбонатний D фосфатний E жодної правильної відповіді
43.Розчинність газів у воді при підвищенні тиску, як правило: A *Збільшується B Не змінюється C Зменшується D Спочатку збільшується, а потім зменшується E Спочатку зменшується, а потім збільшується
44.При виготовленні деяких лікарських препаратів необхідно враховувати величину осмотичного тиску. Який з перерахованих 0,01М розчинів має найбільший осмотичний тиск? A *Al2(SO4)3 B KCl C Cu(NO3)2 D сечовина E фруктоза
45.При однаковій молярній концентрації максимальною величиною йонної сили характеризується розчин: A *Кальцію хлориду B Калію хлориду C Калію йодиду D Натрію фториду E Натрію йодиду Періодичний закон 1.Одна з класифікацій хімічних елементів ґрунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать лише до р-елементів? A *Br, O, P B Cl, Ca, O C N, Al, Cd D K, Ca, Ni E Fe, Cu, F
2.Амфотерні сполуки – це речовини, які реагують з: A *Кислотами та лугами B Тільки з лугами C Тільки з кислотами D Тільки з кислотними оксидами E Тільки з основними оксидами
3.Благородні гази практично не утворюють хімічних сполук, тому що: A *вони мають повністю завершений зовнішній електронний рівень B вони знаходяться у восьмій групі періодичної системи Д.І. Менделеєва C з усіх елементів періоду вони мають найменший радіус D у періодичній системі Д.І. Менделеєва вони розташовані після галогенів E заряд ядра благородних газів дорівнює кількості електронів у атомі
4.Атомний номер хімічного елемента характеризує: A *Кількість протонів у ядрі атома B Кількість нейтронів у ядрі атома C Кількість нуклонів у ядрі атома D Кількість нейтронів і протонів у ядрі атома E Масу ядра атома
5.Посилення металічних властивостей у головних підгрупах ПС зверху вниз зумовлено: A *збільшенням радіуса атома B збільшенням атомного номера C збільшенням атомної маси D |