Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Валентність хімічних елементівСодержание книги
Поиск на нашем сайте
Словник термінів і понять Алотропія -явище існування декількох простих речовин, утворених одним хімічним елементом. Атом – найменша хімічно неподільна частинка. Атом — це хімічно неподільна електронейтральна частинка речовини, що складається з позитивно зарядженого ядра й негативно заряджених електронів. Валентність – це число (ціле), яке показує, скільки атомів (Н) може приєднати даний атом.Валентність характеризує здатність атома утворювати певну кількість хімічних зв'язків, яка може бути пов'язаною із здатністю атомів віддавати або приєднувати певне число Відносна атомна маса — фізична величина, яка показує, у скільки разів маси атомів хімічних елементів більші від атомної одиниці маси. Ця величина становить 1/12 маси атома нукліда Карбону 12С. Маса атома цього нукліда, яка дорівнює 19,93 ∙ 10-27 кг, прийнята за 12 а. о. м. Із цього випливає, що 1 а. о. м. = 1,66 ∙ 10-27 кг. Відносна молекулярна маса — це фізична величина, що визначається відношенням маси молекули до маси однієї дванадцятої частини маси атома нукліда Карбону 12С. Електронні формули схематично відображають механізм утворення хімічних зв’язків у молекулах. їх записують за допомогою символів хімічних елементів і крапок, які позначають електрони зовнішнього електронного рівня. Індекс – це число атомів даного елемента у формулі. Кількість речовини — це фізична величина, що визначається числом часток у даній порції речовини (структурних елементів речовини: молекул, атомів, іонів). Кислота – складна речовина, утворена кислотним залишком і такою кількістю атомів гідрогену, як його валентність. Коефіцієнт – число перед формулою, яке вказує на число структурних частинок (атомів, молекул). Луг – розчинна у воді основа. Моль — це така кількість речовини, що містить стільки ж структурних елементів речовини (молекул, атомів, іонів), скільки міститься атомів у нукліді Карбону 12С масою 0,012кг. Молярна маса — це фізична величина, що дорівнює масі речовини кількістю 1 моль. Молярний об’єм — це фізична величина, яка дорівнює об’єму речовини кількістю речовини 1 моль. Оксиди – складні речовини, утворені двома елементами, один з яких – Оксиген з валентністю ІІ. Оксид кислотний – оксид, якому відповідає кислота. Оксид основний – оксид, якому відповідає основа. Основа – складна речовина, утворена одним атомом металу і такою кількістю гідроксильних (ОН) груп, як валентність даного металу. Молекула – найдрібніша частина речовини, що зберігає її властивості. Проста речовина – це речовина, утворена атомами одного елемента. Складна речовина – це речовина, яка утворена кількома видами атомів. Солі – складні речовини, утворені атомами металу та кислотним залишком. Структурні формули відображають порядок з’єднання атомів або груп атомів у молекулах. Реакція заміщення – це реакція між простою і складною речовиною, коли атоми простої заміщують один з видів атомів складної речовини. Реакція обміну – реакція між складними речовинами, які обмінюються своїми складовими частинами. Реакція сполучення – це реакція, під час якої з кількох речовин утворюється одна нова речовина. Реакція розкладу - це реакція, під час якої з однієї складної речовини утворюється кілька нових речовин. Рівняння хімічної реакції – це умовне зображення реакцій за допомогою формул і коефіцієнтів. Хімія – це наука про речовини та їх перетворення. Хімічне рівняння - це умовний запис хімічної реакції за допомогою хімічних формул і коефіцієнтів. Хімічна реакція – це хімічне явище, при якому проходять хімічні перетворення одних речовин в інші. Речовини, що вступають в реакцію, називаються реагентами (вихідними речовинами), а ті, що утворюються – продуктами реакції. Хімічна рівновага – стан системи, при якому швидкість прямої реакції дорівнює швидкості зворотної реакції. Хімічні явища – це такі явища, під час перебігу яких одні речовини перетворюються в інші, що відрізняються від вихідних за складом і властивостями. Хімічний елемент — це різновид атомів з певним (однаковим) зарядом ядра. Фізичні явища – це такі явища, під час перебігу яких змінюється форма, агрегатний стан речовини, але нова речовина не утворюється. Формула (хімічна) - умовний запис якісного та кількісного складу речовин за допомогою знаків та індексів. Протонне число — число протонів, що входять до складу ядра атома. Нейтронне число — число нейтронів, що входять до складу ядра атома. Нуклонне число — число нуклонів (протонів і нейтронів) у ядрі атома. Атоми з однаковим протонним і нейтронним числом називають нуклідами. Нукліди з однаковим протонним числом, але різним нейтронним числом називають ізотопами. Методи розділення сумішей
Валентність хімічних елементів
Визначення валентності елементів за формулою. У формулах бінарних сполук сумарна валентність усіх атомів одного елемента завжди дорівнює сумарній валентності всіх атомів іншого елемента. Наприклад, ІІІ ІІІІ ІІ І ІІ Сr2O3 CuO Na2O Послідовність складання хімічних формул за валентністю: 1. Над символами елементів написати валентність. 2. Знайти найменше спільне кратне. 3. Поділити найменше спільне кратне на валентність кожного елемента. 4. Отримані числа записати в хімічній формулі як індекси. Наприклад: 1. AlІІІОІІ 2. Найменше спільне кратне 6 (3 · 2 = 6). 3. Al – 6: 3 = 2; O – 6: 2 = 3. 4. Al2O3.
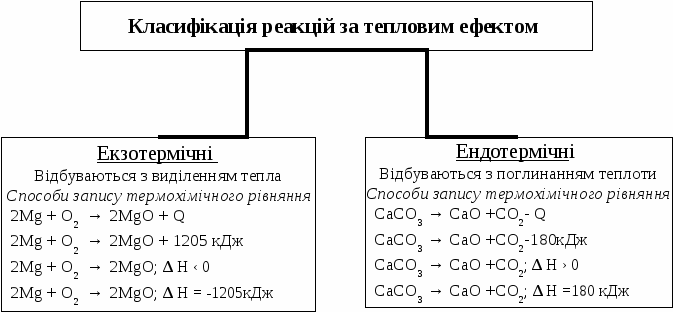
Основні закони хімії Закон збереження маси: сума мас речовин, які прореагували, дорівнює сумі мас речовин, що утворилися внаслідок реакції. У природі ніщо не виникає з нічого і не зникає безслідно. Закон сталості складу: кожна хімічна сполука має сталий якісний і кількісний склад незалежно від способу її добування. Закон Гей-Люссака: об'єми газів, що вступають у реакцію, відносяться один до одного і до об'ємів газоподібних продуктів реакції як прості цілі числа (за однакових умов). Коефіцієнти перед газоподібними речовинами у хімічному рівнянні дорівнюють об'ємам газів. Об’єднаний газовий закон:
де P0, V0, T0 – тиск, об’єм і температура газу за нормальних умов (P0 = 101325 Па, Т0 = 273 К). Рівняння Менделєєва-Клапейрона описує залежність об’єму газу від кількості речовини цього газу, температури і тиску. PV = де P – тиск газу, Па; V – об’єм газу, л; m – маса газу, г; M – молярна маса газу, г/моль; ν – кількість речовини газу, моль; R – універсальна газова стала, R = 8,314 Дж/(моль·К). Закон Авогадро: в однакових об’ємах різних газів за однакових умов міститься однакове число молекул. 1 моль будь-якої речовини містить 6,02·1023 структурних одиниць (молекул, атомів, йонів, електронів). Молярний об’єм – це об’єм 1 моль газу. За нормальних умов (P0 = 101,3 кПа, Т0 = 273 К) він дорівнює 22,4 л/моль. Кількісні величини в хімії
План характеристики хімічних елементів за положенням Найважливіші кислоти
Ряд активності кислот: сильні середні слабкі
НІ, HClО4,H2SO4,HF, СН3СООН, H2CO3, HCl, HNO3H3PO4, H2SO3 H2S, H2SiO3
Можливі ступеня окиснення Деяких хімічних елементів
Словник термінів і понять Алотропія -явище існування декількох простих речовин, утворених одним хімічним елементом. Атом – найменша хімічно неподільна частинка. Атом — це хімічно неподільна електронейтральна частинка речовини, що складається з позитивно зарядженого ядра й негативно заряджених електронів. Валентність – це число (ціле), яке показує, скільки атомів (Н) може приєднати даний атом.Валентність характеризує здатність атома утворювати певну кількість хімічних зв'язків, яка може бути пов'язаною із здатністю атомів віддавати або приєднувати певне число Відносна атомна маса — фізична величина, яка показує, у скільки разів маси атомів хімічних елементів більші від атомної одиниці маси. Ця величина становить 1/12 маси атома нукліда Карбону 12С. Маса атома цього нукліда, яка дорівнює 19,93 ∙ 10-27 кг, прийнята за 12 а. о. м. Із цього випливає, що 1 а. о. м. = 1,66 ∙ 10-27 кг. Відносна молекулярна маса — це фізична величина, що визначається відношенням маси молекули до маси однієї дванадцятої частини маси атома нукліда Карбону 12С. Електронні формули схематично відображають механізм утворення хімічних зв’язків у молекулах. їх записують за допомогою символів хімічних елементів і крапок, які позначають електрони зовнішнього електронного рівня. Індекс – це число атомів даного елемента у формулі. Кількість речовини — це фізична величина, що визначається числом часток у даній порції речовини (структурних елементів речовини: молекул, атомів, іонів). Кислота – складна речовина, утворена кислотним залишком і такою кількістю атомів гідрогену, як його валентність. Коефіцієнт – число перед формулою, яке вказує на число структурних частинок (атомів, молекул). Луг – розчинна у воді основа. Моль — це така кількість речовини, що містить стільки ж структурних елементів речовини (молекул, атомів, іонів), скільки міститься атомів у нукліді Карбону 12С масою 0,012кг. Молярна маса — це фізична величина, що дорівнює масі речовини кількістю 1 моль. Молярний об’єм — це фізична величина, яка дорівнює об’єму речовини кількістю речовини 1 моль. Оксиди – складні речовини, утворені двома елементами, один з яких – Оксиген з валентністю ІІ. Оксид кислотний – оксид, якому відповідає кислота. Оксид основний – оксид, якому відповідає основа. Основа – складна речовина, утворена одним атомом металу і такою кількістю гідроксильних (ОН) груп, як валентність даного металу. Молекула – найдрібніша частина речовини, що зберігає її властивості. Проста речовина – це речовина, утворена атомами одного елемента. Складна речовина – це речовина, яка утворена кількома видами атомів. Солі – складні речовини, утворені атомами металу та кислотним залишком. Структурні формули відображають порядок з’єднання атомів або груп атомів у молекулах. Реакція заміщення – це реакція між простою і складною речовиною, коли атоми простої заміщують один з видів атомів складної речовини. Реакція обміну – реакція між складними речовинами, які обмінюються своїми складовими частинами. Реакція сполучення – це реакція, під час якої з кількох речовин утворюється одна нова речовина. Реакція розкладу - це реакція, під час якої з однієї складної речовини утворюється кілька нових речовин. Рівняння хімічної реакції – це умовне зображення реакцій за допомогою формул і коефіцієнтів. Хімія – це наука про речовини та їх перетворення. Хімічне рівняння - це умовний запис хімічної реакції за допомогою хімічних формул і коефіцієнтів. Хімічна реакція – це хімічне явище, при якому проходять хімічні перетворення одних речовин в інші. Речовини, що вступають в реакцію, називаються реагентами (вихідними речовинами), а ті, що утворюються – продуктами реакції. Хімічна рівновага – стан системи, при якому швидкість прямої реакції дорівнює швидкості зворотної реакції. Хімічні явища – це такі явища, під час перебігу яких одні речовини перетворюються в інші, що відрізняються від вихідних за складом і властивостями. Хімічний елемент — це різновид атомів з певним (однаковим) зарядом ядра. Фізичні явища – це такі явища, під час перебігу яких змінюється форма, агрегатний стан речовини, але нова речовина не утворюється. Формула (хімічна) - умовний запис якісного та кількісного складу речовин за допомогою знаків та індексів. Протонне число — число протонів, що входять до складу ядра атома. Нейтронне число — число нейтронів, що входять до складу ядра атома. Нуклонне число — число нуклонів (протонів і нейтронів) у ядрі атома. Атоми з однаковим протонним і нейтронним числом називають нуклідами. Нукліди з однаковим протонним числом, але різним нейтронним числом називають ізотопами. Методи розділення сумішей
Валентність хімічних елементів
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 422; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.24.36 (0.01 с.) |

 = const; або
= const; або 
 RTабо PV = νRT,
RTабо PV = νRT,
 ; υ =
; υ = 
 ;
DН2=
;
DН2=  ;DО2=
;DО2=  ;Dпов.=
;Dпов.=  ;
;
 100%
100%
 100%
100%

 100%
100%
 100%
η=
100%
η=  100%
η=
100%
η=  100%
100%