
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Серед окисно-відновних реакцій розрізняють міжмолекулярні, внутрішньомолекулярні та реакції диспропорціювання.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Міжмолекулярн і окисно-відновні реакції: елемент-окисник і елемент-відновник знаходяться в різних речовинах; обмін електронами відбувається між різними атомами чи молекулами.
Приклади:
* Реакції між речовинами, що містять атоми одного й того ж самого елементу але в різних ступенях окиснення, теж є міжмолекулярними Внутрішньомолекулярні окисно-відновні реакції:елемент-окисник і елемент-відновник знаходяться в одній і тій жемолекулі. Приклади:
* Внутрішньомолекулярні реакції протікають, як правило, при термічномурозкладанніречовин, що містять окисник і відновник. Реакція диспропорціювання: один і той же елемент в одній і тій же молекулі одночасно підвищує і знижує ступінь окиснення. Приклади:
Методелектронного балансу. В процесі окисно-відновної реакції атоми одного елементу (чи елементів) віддають електрони, а атоми іншого елементу (чи елементів) їх приймають; при цьому кількість відданих електронів обов’язково дорівнює кількості прийнятих електронів (баланс електронів). Такої рівності досягають шляхом підбору таких коефіцієнтів у рівнянні реакції для відновника і окислювача, при яких кількість електронів, відданих відновником, дорівнювала би кількості електронів, прийнятих окисником. Електронний баланс – метод знаходження коефіцієнтів у рівняннях окисно-відновних реакцій, у якому розглядається обмін електронами між атомами елементів, що змінюють свій ступінь окиснення. Складання рівнянь здійснюється в декілька стадій: 1) записують схему реакції (при цьому формули вихідних речовин поміщають зліва від стрілки – покажчика напрямку процесу, формули речовин-продуктів реакції – справа): KMnO4 + HCl ® KCl + MnCl2 + Cl2 + H2O 2) встановлюють ступені окиснення елементів і відмічають ті елементи, що змінюють свій ступінь окиснення в ході реакції:
3) для кожного елемента, що змінює свій ступінь окиснення, складають рівняння напівпроцесу окиснення чи відновлення:
2 4) встановлюють коефіцієнти, необхідні для балансу електронів:
5) проставляють ці коефіцієнти перед формулами речовин, що містять відповідні елементи до і після реакції: 2 6) підбирають коефіцієнти для всіх інших молекул речовин з розрахунку, що кількості атомів різних елементів в правій і лівій частині рівняння повинні бути рівними; перевіряють правильність підбору коефіцієнтів:
Методелектронно-іонного балансу (метод напівреакцій) – метод підбору коефіцієнтів, у якомурозглядається обмін електронами між іонами в розчині з урахуванням характеру середовища. Складання рівнянь здійснюється в декілька стадій: 1) записують схему перебігу реакції в розчині в іонному вигляді та зазначають іони, які зазнають зміни в ході реакції: KMnO4+HCl → KCl+MnCl2+Cl2+H2O K++ MnO4 –+H++ Cl– → K++Cl–+ Mn2+ +2Cl–+ Cl2 +H2O 2) складають схеми іонних напівреакцій за участю реально існуючих в розчині іонів і молекул, урівнюючи при цьому кількість атомів кожного елементу в лівій і правій частині напівреакції (для зв'язування атомів О використовують H+ (при цьому утворюється H2O) або H2O (при цьому утворюється OH–); для введення атомів О використовують H2O (при цьому утворюється Н+) та OH– (при цьому утворюється H2O):
4) урівнюють загальне число зарядів в лівій і правій частині кожної напівреакції (додаючи або віднімаючи необхідну кількість електронів) та підбирають такі коефіцієнти для кожної напівреакції, щоб число електронів, відданих відновником дорівнювало числу електронів, прийнятих окисником (баланс електронів):
5) записують сумарне скорочене іонне рівняння, складаючи ліві і праві частини напівреакцій з врахуванням коефіцієнтів: 10Cl–+2MnО4–+16H+ ® 5Cl20+2Mn2++8H2O 6) записують повне іонне рівняння, додаючи відповідно до лівої та правої частини рівняння іони, що не зазнали змін в ході реакції: 2К ++10Cl–+2MnО4–+16H++ 6Cl – ® 6Cl – +5Cl20+2Mn2++8H2O+ 2К+ 7) записують рівняння реакції в молекулярному вигляді:
В залежності від середовища окисно-відновна реакція протікає з утворенням різних продуктів окиснення і відновлення. Так, при взаємодії перманганату калію KMnO4 з відновником утворяться різні продукти відновлення в залежності від реакції середовища: · у кислому середовищі:
––––––––––––––––––––––––––––––––––––––––––––––––––– 2MnO4- + 16H+ + 5SO32- + 5H2O ® 2Mn2+ + 8H2O + 5SO42- + 10H+ після відповідних скорочень маємо 2MnO4- + 6H+ + 5SO32- ® 2Mn2+ + 3H2O + 5SO42-
Фіолетовий розчин (KMnO4) знебарвлюється. · у нейтральному середовищі:
––––––––––––––––––––––––––––––––––––––––––––––––––– 2MnO4-+ 4H2O + 3SO32- + 6OH- ® 2MnO2 + 8OH- + 3SO42- + 3H2O після відповідних скорочень маємо 2MnO4-+ H2O + 3SO32- ® 2MnO2 + 2OH- + 3SO42-
Фіолетовий розчин (KMnO4) знебарвлюється і спостерігається випадання бурого осаду. · в лужному середовищі:
––––––––––––––––––––––––––––––––––––– SO32- + 2OH- + 2MnO4- ® SO42- + H2O + 2MnO42-
Фіолетовий розчин (KMnO4) перетворюється в зеленуватий (K2MnO4).
Кількісною характеристикою окислювальної здатності різних речовин є окисно-відновний потенціал (редокс-потенціал), що характеризує намагання даного окисника приєднувати електрони. Значення окисно-відновного потенціалу (у вольтах) можна розрахувати за формулою Нернста
де z – кількість електронів, що приймають участь в реакції; Знаючи редокс-потенціали речовин, що вступають у реакцію, можна передбачити напрямок і можливість самовільного протікання окисно–відновної реакції. Так, якщо для окисно-відновних систем (напівреакцій) E 0(Fe3+/Fe2+) = +0.77 B; E 0(Cl2/2Cl–) = +1,36 B; E 0(I2/2I-) = +0,54 B, то реакція 2Fe3++2I– → 2Fe2++I2 проходитиме зліва направо, тому що E0(Fe3+/Fe2+)>E0(I2/2I–), а реакція 2Fe3++2Cl– → 2Fe2++Cl2 проходитиме справа наліво, бо E0(Fe3+/Fe2+)<E0(Cl2/2Cl–), але самовільно протікатиме зворотна реакція окиснення Fe2+ газоподібним хлором. Якщо елемент у сполуці знаходиться у проміжковому ступені окиснення, то атоми його можуть як підвищувати, так і понижувати свій ступінь окиснення. Сполуки, що містять атоми елемента у проміжкових ступенях окиснення, проявляють окисно-відновну двоїстість – здатність вступати у реакції як з окисниками, так і з відновниками. До таких сполук належать нітритна кислота, йод, сірка, пероксид водню та ряд інших. Пероксид водню як окисник: H2O2 + 2HI-1 ® I20 + 2H2O
–––––––––––––––––––––– 2I- + H2O2 + 2H+ ® I2 + 2H2O Пероксид водню як відновник: 5H2O2 + 2KMn+7O4 + 3H2SO4 ® 5O20 + K2SO4 + 2Mn2+SO4 + 8H2O
–––––––––––––––––––––––––––––––––––––––––– 2MnО4- + 5H2O2 + 16H+ ® 2Mn2+ + 8H2O + 5O2 + 10H+ 2MnО4- + 5H2O2 + 6H+ ® 2Mn2+ + 8H2O + 5O2
Одна і та сама речовина у різних реакціях може приєднувати або віддавати різну кількість електронів. Так, в залежності від середовища KMnO4 приймає 5 (кисле), 3 (нейтральне) або 1 (лужне) електрон. Отже, еквівалент KMnO4 у різних реакціях буде різним. Еквівалентом окисника (відновника) називається така його кількість, яка при відновленні (окисненні) приєднує (віддає) 1 моль електронів. Так, у кислому середовищі Е (KMnO4) = 1/5 моль, у нейтральному Е (KMnO4) = 1/3 моль, у лужному Е (KMnO4) = 1 моль Еквівалентна маса окисника (відновника) Е m дорівнює його молярній масі M, поділеній на число електронів z, приєднаних (відданих) у процесі реакції: Е m = M / z (г/моль). Так, у кислому середовищі для реакції MnO4- + 8H+ + 5ē ® Mn2+ + 4H2O еквівалентна маса KMnO4 складає Е m = 158,0/5 = 31,6 г/моль.
Металевий стан умовно можна позначити як М+е–, де М+ – іон металу, е–– вільний електрон. При зануренні металевої пластини у воду іони, що знаходяться в поверхневому шарі металу, під дією полярних молекул води гідратуються. Як наслідок, їх зв’язок з іншими іонами послаблюється і певна кількість іонів металу переходить в розчин. Відповідно, пластинка металу набуває негативного заряду.
Між позитивно зарядженими іонами металу, що перейшли у розчин, та негативно зарядженою пластинкою виникає електростатичне притягання, що заважає подальшому протіканню процесу, і в системі встановлюється рівновага. На межі дотику металу з розчином утворюється подвійний електричний шар і виникає стрибок потенціалу. Цей потенціал, який виник на межі дотику металу з рідиною, називають електродним потенціалом. Різні метали проявляють не однакову здатність до переміщення іонів металу в розчин. Тому кожному металу відповідає своя рівноважна різниця потенціалів. Явище переміщення іонів металу у розчин спостерігається і при зануренні металевої пластинки у розчин солі цього металу. Товщина подвійного електричного шару залежить від природи металу, заряду іонів та температури. Подвійний електричний шар характеризується складною будовою. Біля поверхні металу спостерігається висока концентрація іонів із знаком заряду, протилежним заряду його поверхні. Вона зменшується по мірі віддалення від поверхні метала.
Пристрій, в якому у хімічна енергія перетворюється в електричну, називається гальванічним елементом. Гальванічний елемент складається з одного, двох або декількох розчинів електролітів, в які занурені металеві пластинки (електроди), сполучені між собою зовнішнім провідником. Прикладом такого гальванічного елементу є мідно-цинковий елемент Якобі-Данієля, який складається з мідного та цинкового електродів, занурених відповідно в розчини CuSO4 та ZnSO4. Схематично елемент Якобі зображають таким чином: (+) Cu | CuSO4 || ZnSO4 | Zn (–),
де вертикальні риски відповідають границі поділу двох фаз. У цьому елементі електрична енергія утворюється за рахунок хімічної реакції: Zn+CuSO4 = Cu+ZnSO4. При цьому негативно заряджені електрони рухаються від цинкового електрода до мідного (тобто створюють електричний струм), а позитивно заряджені іони переміщуються в розчині від мідного електрода до цинкового. Пояснення виникнення е.р.с. в ланцюгу (+) Cu | CuSO4 || ZnSO4 | Zn (–) Е 1 Е 3 Е 2 буде спостерігатись три стрибки потенціалу: два з них (Е 1 та Е 2) будуть стрибками потенціалу на межі розділу фаз метал-розчин, і один (Е 3) – на межі розділу двох рідких фаз. Найбільша різниця потенціалів спостерігається на межі метал-розчин. Практично е.р.с. (Е) елементу Якобі-Данієля буде дорівнювати різниці стрибків потенціалу Е 1 та Е 2, оскільки стрибок потенціалу на межі двох рідин в даному випадку незначний: Е = Е 1 – Е 2 = Е Cu/Cu2+– Е Zn/Zn2+ В елементі Якобі-Данієля пластинки (цинкова і мідна) занурені в розчини своїх солей; розчини розділені діафрагмою. Кожен метал виділяє в розчин певну кількість іонів, яка відповідає рівноважному стану метал–розчин. Потенціали цих металів у рівноважному стані не однакові. Якщо сполучити пластинки провідником, то надлишок електронів по зовнішньому провіднику з цинкової пластинки переміститься на мідну. Це призводить до порушення рівноваги подвійного електричного шару. Для її відновлення в розчин буде переходити певна кількість іонів цинку, тобто цинк почне активно розчинятись; частина іонів міді з розчину буде осаджуватись на мідній пластинці.. Цей односторонній рух електронів по провіднику і є електричним струмом, який можна виявити за допомогою відповідних приладів. Різниця потенціалів між електродами за умов протікання нескінченно малого струму по зовнішньому колу називається електрорушійною силою (е.р.с.) елемента. Таким чином, в основі роботи гальванічного елементу лежить окисно-відновна реакція, яка характеризується тим, що на одному з електродів (з нижчим електродним потенціалом) проходить окиснення, а на другому (з вищим електродним потенціалом) – відновлення. Гальванічні елементи застосовують як автономні джерела електроенергії. Найпоширенішими серед них є “сухі” манган-цинкові елементи, що складаються з цинкового анода і (графіт-MnO2) катода; електролітом є паста з NH4Cl. На катоді (К) і аноді (А) протікають реакції К: 4MnO2 +4H+ + 4е- → 4MnO(OH) А: 2Zn - 2е- → 2Zn2+, а електроліт взаємодіє з іонами Zn2+
Процес розрядкиманган-цинкового елементу відображає рівняння: 4MnO2 + 2Zn + 4 NH4Cl → [Zn(NH3)4]Cl2 + 4MnO(OH)
Акумуляторами називаються гальванічні елементи, дію яких можна відновити шляхом пропускання через них електричного струму від зовнішнього джерела. Найбільш вживаними є свинцеві (кислотні) акумулятори. Катодом служать сітчасті пластини з свинцевого сплаву, що містять PbO2, анодом – такі ж пластини з губчастим свинцем; електролітом є розчин сірчаної кислоти H2SO4 Процеси, що протікають на катоді та аноді: K: PbO2 + 4H+ + SO42- + 2e- → PbSO4 + 2H2O A: Pb + H2SO4 – 2e- → PbSO4 + 2H+ Процеси розрядки та зарядки свинцевого акумулятора відображає рівняння:
Величина електродного потенціалу, що виникає на межі метал – розчин солі, визначається рівнянням Нернста:
де z– валентність метала в даній сполуці (кількість електронів, яку втрачає атом, перетворюючись на іон); C – концентрація іонів металу в даному розчині; R – газова стала; F – число Фарадея; T – абсолютна температура; E 0 – стала, що входить до складу потенціалу для даного металу та розчину при даній температурі. Це рівняння виражає залежність потенціалу метала від концентрації його іонів у розчині і називається рівнянням електродного потенціалу. Підставивши в рівняння Нернста числові значення постійних та перейшовши від натурального логарифма до десяткового, для 25 ОС одержуємо наступне рівняння:
При С = 1 г-іон/л
Виміряти стрибок потенціалу на одному окремо взятому електроді неможливо, але можна виміряти значення стрибка потенціалу на межі метал–розчин відносно якого-небудь іншого електроду, абсолютне значення стрибка потенціалу якого прийнято за нуль. За міжнародною угодою за нуль прийнято потенціал так званого нормального водневого електроду: це платиновий електрод, занурений в розчин з концентрацією іонів водню, яка дорівнює 1 г-іон/л, і насичений воднем при тиску 101,3 кПа
Для збільшення поверхні дотику металу з воднем платинову пластинку покривають шаром губчастої платини. Таку платиновану пластинку занурюють до половини в розчин сульфатної кислоти, через який пропускають струмінь газоподібного водню. Платинова пластинка відіграє роль адсорбенту (розчинника) водню, а насичена газом платина поводить себе як сплав водень/платина. Розчинений у платині молекулярний водень частково дисоціює на атоми: Н2 = 2Н, які переходять в іонний стан: 2Н = 2Н+ + 2е–, і на межі Н2 | 2Н+ виникає стрибок потенціалу, який має певну величину. Величина потенціалу водневого електроду за даної температури визначається, з одного боку, концентрацією іонів в розчині, а з другого – кількістю адсорбованого платиною газоподібного водню. Величина адсорбції водню пропорційна його тиску. При тиску 101,3 кПа Е Н2/2Н+ = Е 0Н2/2Н+ + 0,059 lg[H+].
Відносний нормальний потенціал будь-якого металу можна виміряти, створивши гальванічне коло, в якому одним з електродів є цей метал, занурений в розчин з концентрацією однойменних катіонів 1 г-іон/л, а другим електродом є нормальний водневий електрод. При цьому знак нормального електродного потенціалу металу відповідатиме знаку заряду, який набуває метал в гальванічному колі з нормальним водневим електродом. Якщо метал є відновником відносно Гідрогену, то величина електродного потенціалу виражається зі знаком (–), а якщо метал є окисником, то зі знаком (+). Розміщуючи метали в ряд за величиною їх нормальних електродних потенціалів, ми одержимо так званий ряд стандартних електродних потенціалів металів, який ще називають рядом напруги металів. Ряд стандартних електродних потенціалів має не тільки велике теоретичне значення, але з його допомогою може бути розв’язано ряд практичних задач, а саме: 1. Метали, розташовані в ряді напруги до Гідрогену, відрізняються хімічною активністю, здатні легко окиснюватися, витісняють водень з кислот, в той час як метали, розташовані за Гідрогеном, стійкі до окиснення, водень з кислот не виділяють і хімічно менш активні. 2. Кожний попередній метал здатний витіснити з розчинів солей всі наступні метали з ряду стандартних електродних потенціалів. 3. При виготовленні гальванічного елементу з будь-яких двох металів можна розрахувати величину е.р.с. утвореного елементу. Для обчислення е.р.с. гальванічного елементу достатньо знати різницю стандартних потенціалів Е 0 різних електродів.
Електроди, які застосовують в електрохімії, поділяють на кілька груп. До електродів першого роду належать металеві пластинки, які занурені в розчин власних іонів. Схематично їх можна зобразити так: Me | Men+, наприклад, Zn | Zn2+, Cu | Cu2+. Електроди першого роду оборотні відносно катіона, і двофазні. Електродні реакції в таких напівелементах відповідають або реакціям окиснення, якщо у гальванічному колі відбувається процес: Ме = Меn+ + ne– або реакціям відновлення у колі відбувається процес: Меn+ + ne– = Ме Отже, на електродах першого роду відбувається процес переходу катіонів з металу в розчин або з розчину в метал, тобто ці електроди оборотні відносно катіона.
До електродів другого роду належать пластинки металу, вкриті важкорозчинною сполукою цього металу (сіллю, оксидом, гідроксидом), які занурені в розчин добре розчинної сполуки з тим самим аніоном. Схематично їх можна зобразити так: Ме | MeA, An–, наприклад, Ag | AgCl, KCl або Hg | Hg2Cl2, KСl. Електроди другого роду оборотні як відносно катіона, так і аніона, однак можна змінювати тільки концентрацію аніона і таким чином впливати на величину потенціалів електродів другого роду. Серед електродів другого роду найширше застосування мають хлорсрібний та каломельний електроди. Хлорсрібний електрод складається з срібної дротини або пластинки з нанесеним на неї шаром хлориду аргентуму, яка занурена в розчин КСl. Схематичне зображення електроду: Ag | AgCl, KСl (кома між AgCl та KСl означає, що між цими речовинами немає поверхні поділу, оскільки вони знаходяться в одному розчині). AgCl в незначній кількості розчиняється у воді і дисоціює з утворенням іонів Ag+ та Cl–: AgCl Û Ag+ + Cl–. Цей оборотній процес визначає потенціал електроду. У присутності KСl розчинність AgCl зменшується. Таким чином, при високих концентраціях КСl і температурі концентрація Ag+ постійна, чим властиво і забезпечується необхідна постійність потенціалу хлорсрібного електроду. На електроді встановлюється рівновага: AgCl + e– = Ag + Cl–. У насиченому розчині КСl потенціал хлорсрібного електроду, який використовується як електрод порівняння, складає +0,222 В. Каломельний електрод уявляє собою посудину, на дні якої міститься шар очищеної ртуті завтовшки 4-5 мм з нанесеним на неї шаром каломельної пасти (Hg2Cl2), вкритої шаром кристалічного хлориду калію. Струм від ртуті відводиться за допомогою платинової дротинки, впаяної в скляну трубку. Схематичне зображення електроду: Hg | Hg2Cl2, Cl–. На електроді відбувається реакція: Hg2Cl2 + 2e– = 2Hg + 2Cl– У насиченому розчині КСl потенціал каломельного електроду, який використовується як електрод порівняння, дорівнює +0,2412 В.
Окисно-відновними прийнято називати такі електроди, метал яких не приймає участі в окисно-відновній реакції, а тільки переносить електрони. Процес окиснення та відновлення відбувається між речовинами, що знаходяться в розчині, у який занурено електрод. Отже, до окисно-відновних, або редокс-електродів, належать електроди, які складаються з інертного металу (Pt, Au), зануреного в розчин, в якому містяться окиснена та відновлена форми одного і того ж елементу. При зануренні платинової дротинки у розчин, що містить іони Fe2+ та Fe3+, утвориться напівелемент, схематичне зображення якого Pt | Fe2+, Fe3+. Електродна реакція: Fe3+ + e– = Fe2+ Іони Fe3+ відновлюються до Fe2+ за рахунок електронів, одержаних від платини, яка є провідником електронів. У результаті цього процесу електрод отримує додатній заряд і притягує аніони з розчину. На поверхні платини утворюється подвійний електричний шар з певним стрибком потенціалу. Величина цього електродного потенціалу залежить від активності іонів Fe2+ i Fe3+ і визначається рівнянням Нернста:
Це електрохімічні датчики, потенціали яких однозначно визначаються активністю певного виду іонів у розчині. Ці іони називаються потенціало-утворюючими, а електроди – іонселективними.
Іонселективний електрод складається з корпусу, найчастіше пластмасового, внутрішнього допоміжного електроду, зануреного у внутрішній розчин, та мембрани. Іонселективні електроди мають ще й іншу назву – мембранні, їх навіть класифікують за типом мембрани: кристалічні, скляні, рідкі та плівкові. Суттєвим є те, що всі мембрани вміщують електродноактивні речовини, які селективно взаємодіють з іонами досліджуваного та внутрішнього розчинів. В результаті на мембрані виникає потенціал, який фіксується за допомогою внутрішнього допоміжного електрода. В скляному електроді мембраною служить тонка скляна стінка корпусу електроду. Скляна мембрана може змінювати свій потенціал залежно від рН розчину, що використовують для реєстрації рН розчинів (рН-метрія).
Електролізом називають сукупність хімічних процесів, що протікають на електродах, занурених у розчин або розплав електроліту, під дією електричного струму. Сутність електролізу полягає в тому, що при пропусканні електричного струму через розчин (або розплав) електроліту позитивно заряджені іони (катіони) переміщуються до катода, а негативно заряджені (аніони) – до анода. Досягши електродів, іони розряджаються, у результаті чого на електродах виділяються складові частини розчиненого електроліту або водень і кисень з води.
Для відновлення різних іонів у нейтральні атоми чи групи атомів необхідно прикласти різну напругу електричного струму. Ступінь легкості, з яким розряджаються (приєднують електрони) іони металів, визначається положенням металів у ряді напруг. Чим лівіше стоїть метал у ряді напруг, тобто чим більшим є його негативний потенціал (чи меншим позитивний потенціал), тим важче за інших рівних умов розряджаються його іони. Легше всього розряджаються іони Аu3+, Ag+; важче всього Li+, Rb+, K+). Якщо в розчині одночасно знаходяться іони декількох металів, то в першу чергу розряджаються іони того металу, у якого негативний потенціал є меншим (чи позитивний – більшим). Наприклад, з розчину, що містить іони Zn2+ і Cu2+, в першу чергу виділяється металева мідь. Величина потенціалу металу залежить також і від концентрації його іонів у розчині, тому так само змінюється і легкість розряду іонів кожного металу в залежності від їхньої концентрації: збільшення концентрації полегшує розряд іонів, зменшення – утруднює. Тому при електролізі розчину, що містить іони декількох металів може статися, що виділення більш активного металу буде відбуватися раніш, ніж виділення менш активного (якщо концентрація іонів першого металу значна, а другого – дуже мала). У водних розчинах солей, крім іонів солі, завжди існують ще й іони Н+ і ОН– (внаслідок незначної дисоціації Н2О). Іони Н+ будуть розряджатися легше, ніж іони всіх металів, що стоять в ряді напруг до Н. Однак через незначну концентрацію іонів Н+ при електролізі всіх солей, крім солей найбільш активних металів, на катоді відбувається виділення металу, а не водню. Тільки при електролізі солей натрію, кальцію й інших металів до алюмінію включно розряджаються іони Н+ і виділяється водень. На аноді можуть розряджатися іони кислотних залишків, а також гідроксильні іони ОН–. Якщо іони кислотних залишків не містять кисню (Cl–, S2–, CN– і ін.), то звичайно розряджаються саме ці іони, і на аноді виділяються Cl2, S і т.д. Навпаки, якщо електролізу піддається сіль кисневмісної кислоти чи сама кислота, то розряджаються гідроксильні іони, а не іони кислотних залишків. Нейтральні групи, що утворяться при розряді гідроксильних іонів ОН– миттєво розкладаються по рівнянню: 4OH ® 2H2O + O2↑ У результаті на аноді виділяється кисень. Електроліз розплаву хлориду магнію MgCl2. Розплав містить іони Mg2+ і Cl–. При протікання струму іони Mg2+ переміщуються до катода, а іони Cl– – до анода. Приймаючи від катода два електрони, іони Mg2+ перетворюються в нейтральні атоми, На катоді виділяється магній. Іони хлору, досягаючи анода, віддають йому електрони і перетворюються в атоми хлору, що, з'єднуючись попарно, утворять молекули хлору. На аноді виділяється хлор. –К: Mg2+ + 2 е → Mg0 +А: 2Cl– – 2е → Cl2↑ Електроліз розчину хлориду нікелю NiCl2. Розчин містить іони Ni2+ і Cl–, а також у незначній концентрації іони Н+ і ОН–. При протіканні струму іони Ni2+ переміщуються до катоду, а іони Cl– – до аноду. Приймаючи від катода два електрони, іони Ni2+ перетворюються в нейтральні атоми, що виділяються з розчину. Катод поступово покривається нікелем. –К: Ni2+ + 2 е → Ni0 Іони хлору, досягаючи аноду, віддають йому електрони і перетворюються в атоми хлору, що, з'єднуючись попарно, утворять молекули хлору. На аноді виділяється хлор. +А: 2Cl– – 2е → Cl2 ↑ Отже, на катоді відбувається процес відновлення, а на аноді – процес окиснення. Електроліз розчину йодиду калію KI. Йодид калію знаходиться в розчині у виді іонів К+ і I–. При пропусканні струму іони К+ переміщуються до катоду, іони I– – до аноду. Але оскільки калій стоїть в ряді напруг набагато лівіше водню, то на катоді розряджаються не іони калію, а молекули води. Атоми водню, що утворяться при цьому, з'єднуються в молекули Н2, і в такий спосіб на катоді виділяється водень. –К: 2Н2О + 2 е → Н20↑+ 2ОН– +А: 2I– – 2е → I2 В міру розряду іонів водню відбувається дисоціація нових молекул води, внаслідок чого біля катода накопичуються гідроксильні іони (що звільняються з молекули води), а також іони К+, що безупинно переміщуються до катода. Утвориться розчин КОН. Електроліз розчину сульфату калію K2SO4. Розчин містить іони K+, SO42- та іони Н+ і ОН- з води. Йони K+ розряджаються важче, ніж іони Н+, а іони SO42-, ніж іони ОН-, тому на катоді будуть розряджатися іони Н+, а на аноді – іони ОН-, тобто фактично буде відбуватися електроліз води. У той же час внаслідок розряду водневих і гідроксильних іонів води і безупинного переміщення іонів K+ до катода, а іонів SO42- до анода, біля катода утвориться розчин лугу (КОН), а біля анода – розчин сірчаної кислоти. Електроліз розчину сульфату купруму при мідному аноді. Коли анод зроблений з того ж металу, сіль якого знаходиться в розчині, ніякі іони не розряджаються на аноді, але сам анод поступово розчиняється, посилаючи в розчин іони і віддаючи елек |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 649; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.49.213 (0.029 с.) |



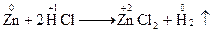
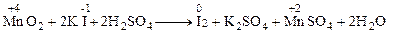
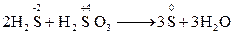 *
*



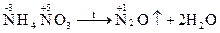
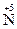


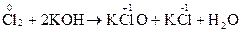

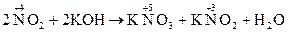

 + 5ē ®
+ 5ē ® 
 2
2

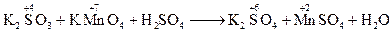
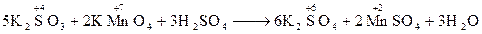
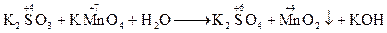

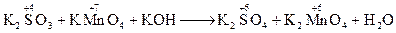
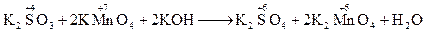
 ,
, і
і 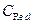 – концентрація (активність) окисленої і відновленої форми іонів у розчині; R – універсальна газова стала; F – число Фарадея (96500Кл/моль); T – абсолютна температура; E 0 – стандартний окисно-відновний потенціал (Т = 298 К,
– концентрація (активність) окисленої і відновленої форми іонів у розчині; R – універсальна газова стала; F – число Фарадея (96500Кл/моль); T – абсолютна температура; E 0 – стандартний окисно-відновний потенціал (Т = 298 К,  Рис.9. Утворення подвійного
електричного шару
Рис.9. Утворення подвійного
електричного шару
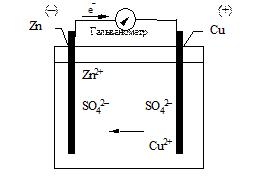 Рис. 10. Елемент Якобі-Данієля
Рис. 10. Елемент Якобі-Данієля
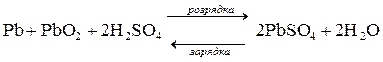


 . Отже, постійна величина Е 0 дорівнює потенціалу метала відносно розчину солі цього металу з концентрацією іонів 1 г-іон/л. Цей потенціал Е 0 називається нормальним, або стандартним потенціалом за даної температури; він не залежить від інших складових розчину, є величиною постійною і характерною для даного метала.
. Отже, постійна величина Е 0 дорівнює потенціалу метала відносно розчину солі цього металу з концентрацією іонів 1 г-іон/л. Цей потенціал Е 0 називається нормальним, або стандартним потенціалом за даної температури; він не залежить від інших складових розчину, є величиною постійною і характерною для даного метала. Рис.11. Водневий електрод
Рис.11. Водневий електрод

 Рис.12. Іонселективний електрод
Рис.12. Іонселективний електрод
 Рис.13. Схема роботи електролізера
Рис.13. Схема роботи електролізера



