Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ферменти як біологічні каталізатори реакцій обміну речовинСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Білет 1 Ферменти як біологічні каталізатори реакцій обміну речовин Ферменти (ензими) — біологічні каталізатори білкової природи, які синтезуються в клітинах живих організмів та забезпечують необхідні швидкість і координацію біохімічних реакцій, що становлять обмін речовин (метаболізм).Властивості ферментів: – Ферменти значно підвищують швидкість перебігу біохімічних реакцій, але не входять до складу кінцевих продуктів реакції; – ферменти забезпечують перебіг лише тих біохімічних реакцій, які можливі, виходячи із законів термодинаміки; – ферменти прискорюють швидкість як прямої, так і зворотної реакції перетворення субстрату, не змінюючи константи рівноваги (Кр) реакції та зменшуючи термін часу до досягнення стану рівноваги (або стаціонарного стану у відкритій метаболічній системі); – протягом реакції фермент певним чином взаємодіє із субстратом, що перетворюється, але до складу кінцевих продуктів реакції не входить. Під час перебігу біохімічної реакції, що каталізується, відбувається циклічний процес, вході якого фермент та субстрат підлягають ступеневому перетворенню з утворенням продукту реакції та регенерацією ферменту; – ферменти є високоспецифічними каталізаторами, тобто діють, як правило, на структурно близькі субстрати, що мають певний хімічний зв’язок, структурно подібні радикали або функціональні групи. Проявом високої специфічності ферментів є їх стереоспецифічність, тобто здатність перетворювати тільки певні стереоізомери, наприклад L- або D-амінокислоти, D- або L-моносахариди; – відповідно до білкової природи, каталітична активність ферментів дуже чутлива до змін фізико-хімічних властивостей середовища (рН, температури), які можуть впливати на структурну організацію молекул ферментів, спричиняючи в певних умовах їх денатурацію; – активність ферментів може суттєво змінюватися під впливом певних хімічних сполук, що збільшують (активатори) або зменшують (інгібітори) швидкість реакції, яка каталізується. Ковалентна модифікація ферментів. Постсинтетична ковалентна модифікація є одним із поширених механізмів контролю за перебігом метаболічних процесів. Шляхами її є зворотне фосфорилювання-дефосфорилювання, метилування, аденілування, АДФ-рибозилювання. Білки фосфорилюють спеціальні ферменти протеїнкінази, що за рахунок кінцевого фосфату АТФ здійснюється фосфорилювання серинового чи треонінового радикалу відповідного білка. Е-ОН + АТФ= Е-О-Ф + АДФ Зворотня реакція – дефосфорилювання. Каталізатор – протеїнфосфатаза Е-О-Ф+ Н2О = Е-ОН + Фн • Коферментні функції аскорбінової кислоти • Біосинтез колагену,норадреналіну, адреналіну, дофаміну, стероїдів, серотоніну • Катаболізм тирозину. Недостатність викликає цингу. Джерела надходження – продукти харчування рослинного та тваринного походження. 3. Коферментні функції аскарбінової кислоти
Білет 3 Варіант 4 Білет №5 1.Номенклатура та класифікація ферментів.Типи реакцій, що каталізують окремі класи ферментів. Номенклатура ферментів: 1. Систематична номенклатура.Згідно з цією номенклатурою, назва фарменту включає в себе: хімічну назву субстрату;тип реакції, що каталізується; суфікс -аза.2.Тривіальна номенклатура.Утворюється на основі хімічної назви субстрату з додаванням суфікса -аза. Класифікація ферментів:Згідно з типом реакції, які ферменти каталізують, їх поділяють на класи, а класи - на підкласи. 1-й клас. Оксидоредуктази — ферменти, що каталізують окислювально-відновлювальні реакціїрізних типів.До оксидоредуктаз належать дегідрогенази— ферменти, що каталізують реакціїдегідрування, оксидази, що окислюють субстрати шляхом приєднання кисню,цитохроми — переносники електронів тощо. 2-й клас. Трансферази — ферменти, що каталізують реакції міжмолекулярного переносу хімічних груп.Трансферази поділяють на амінотрансферази, метилтрансферази, ацил-трансферази, фосфотрансферази, глікозилтрансферази — ферменти, що переносять амінні, метильні, ацильні, фосфатні, глікозильні групи, відповідно. До трансфераз належать також кінази, зокрема протеїнкінази — ферменти, що каталізують фосфорилювання субстратів та інших білків за рахунок фосфатного залишку АТФ. 3-й клас. Гідролази — ферменти, що каталізують реакції гідролізу, тобто розщеплення субстратів за участю молекули води.Гідролази здатні розщеплювати складноефірні, пептидні, глікозидні та інші зв’язки — естерази, пептидази та протеази, глікозидази. 4-й клас. Ліази — ферменти, що каталізують реакції розщеплення ковалентних зв’язків між атомами С, О, N, S негідролітичним шляхом.До ліаз належать декарбоксилази — ферменти, що відщеплюють від органічних кислот карбоксильну групу у вигляді СО2; альдолази, що розщеплюють вуглець-вуглецеві зв’язки з утворенням альдегідів; дегідратази, які відщеплюють від субстратів молекулу води з утворенням подвійного зв’язку. 5-й клас. Ізомерази — ферменти, що каталізують реакції ізомеризації субстратів (рацемізації, епімеризації, внутрішньомолекулярної оксидоредукції) — рацемази, епімерази тощо. 6-й клас. Лігази (синтетази) — ферменти, що каталізують реакції синтезу біомолекул, тобто утворення нових хімічних зв’язків за рахунок енергії АТФ. 2.Активний центр ферменту. Активний центр — ділянка молекули ферментного білка, що взаємо- діє із субстратом під час ферментативної реакції і необхідна для перетво- рення субстрату в каталітичному процесі.Активний центр локалізується, як правило, в заглибленні, просторовій ніші, щоутворюється в макромолекулі білка-ферменту. У структурі активного центру розрізняють: – ділянку, що зв’язує субстрат(якірну ділянку), що містить радикали полярних (зв’язують молекули субстрату за рахунок водневих зв’язків або дипольних взаємодій) або неполярних амінокислотних залишків (створюють в активному центрі гідрофобнізони, що взаємодіють із відповідними радикалами в субстраті); – каталітично активну ділянку, до складу якої входять хімічні групи, що беруть безпосередню участь у перетворенні субстрату (групи –ОН, –SH, ≥N,–NH3, –СОО). Білет 6 1. Властивості ферментів: залежність активності ферментів від рH середовища, залежність активності ферментів від температури. Ферменти значно підвищують швидкість перебігу біохімічних реакцій, але не входять до складу кінцевих продуктів реакції; ферменти забезпечують перебіг лише тих біохімічних реакцій, які можливі згідно з законами термодинаміки; ферменти прискорюють швидкість як прямої, так і зворотної реакції перетворення субстрату, не змінюючи константи рівноваги (Кр) реакції та зменшуючи термін часу до досягнення стану рівноваги (або стаціонарного стану у відкритій метаболічній системі); протягом реакції фермент певним чином взаємодіє із субстратом, що перетворюється, але до складу кінцевих продуктів реакції не входить. Під час перебігу біохімічної реакції, що каталізується, відбувається циклічний процес, в ході якого фермент та субстрат підлягають ступінчастому перетворенню з утворенням продукту реакції та регенерацією ферменту; ферменти є високоспецифічними каталізаторами, тобто діють, як правило, на структурно близькі субстрати, що мають певний хімічний зв’язок, структурно подібні радикали або функціональні групи. Проявом високої специфічності ферментів є їх стереоспецифічність, тобто здатність перетворювати тільки певні стереоізомери, наприклад L- або L- амінокислоти, D- або L-моносахариди; відповідно до білкової природи, каталітична активність ферментів дуже чутлива до змін фізико- хімічних властивостей середовища (рН, температури), які можуть впливати на структурну організацію молекул ферментів, спричиняючи в певних умовах їх денатурацію; активність ферментів може суттєво змінюватися під впливом певних хімічних сполук, що збільшують (активатори) або зменшують (інгібітори) швидкість реакції, яка каталізується. Вплив температури на активність ферментів Ферменти, відповідно до своєї білкової природи, є термочутливими та термола- більними утвореннями: – зростання температури до оптимальних значень (для більшості ферментів — у межах 37-40 °C) cупроводжується збільшенням швид- кості ферментативної реакції відповідно за рів- нянням Арреніуса (за рахунок частіших ефек- тивних зіткнень між молекулами); cтупінь збільшення швидкості реакції при зростанні t° на 10 °C позначають, як температурний коефіцієнт Q10; – при збільшенні температури вище опти- мального значення швидкість ферментативної реакції різко зменшується за рахунок конфор- маційних (денатураційних) змін у структурі ферментного білка. Вплив рН на активність ферментів Кожен фермент має свій рН-оптимум, тобто значення рН середовища, при якому його каталітична активністьмаксимальна. “Дзвоно- подібна” залежність активностейферментів від змін рН визначається їх білковою природою, зсувами в дисоціації іоногенних груп та (при екcтремальних значеннях рН) розвитком кон- формаційних змінмолекул. Більшість внутрішньоклітинних та тканин- нихферментів організму людини найактивніші в нейтральному, слаболужному або слабокис- лому середовищі (звичайно, вмежах рНміж 5,0 та 9,0). Ферментами з оптимумами при екстре- мальних значеннях рН є пепсин (рНопт = 1-2) і аргіназа (рНопт = 10-11). Коферменти та кофактори Кофактори та коферменти Кофактори. Багато ферментів потребують для реалізації своєї каталітичної активності наявності певних низькомолекулярних небілкових сполук кофакторів. Роль кофакторів можуть відігравати біоорганічні сполуки різної хімічної природи або іони металів (Mg2+, Ca2+, Fe3+, Fe2+, Cu2+, Cuj+ та ін.). Іони металів зв'язані з апоферментом або входять до складу небілкової простетичної групи - найчастіше порфіринового кільця гемінових ферментів (цитохромів, пероксидаз, каталази). Ферменти, які міцно зв'язані з іонами металів і не втрачають цього зв'язку за умов виділення та фракціонування ферменту, назваються металоферментами. У деяких випадках іони металів не входять до складу ферментів як інтегральні структурні компоненти, а виконують лише функцію їх активаторів. Коферменти (коензими) — біоорганічні сполуки небілкової природи, що є необхідними для дії ферменту, тобто перетворення субстрату в каталітичному акті. Коферменти можуть сполучатися з білковою частиною (апоферментом) нековалентними фізико-хімічними або ковалентними зв'язками (в останньому випадку вони є простетичними групами ферментного білка - флавінові коферменти, піридоксаль-фосфат, ліпоєва кислота тощо); інколи коферменти утворюють комплекси з апоферментом лише в ході каталітичного процесу (НАД, НАДФ). За хімічною природою коферменти підрозділяють на: - похідні вітамінів, зокрема: вітаміну В, - тіаміндифосфат; вітаміну В2 - флавінмононуклеотид (ФМН); вітаміну В6 - піридоксальфосфат, піридоксамінфосфат; пантотенової кислоти - коензим А; вітаміну В12 - метилкобаламін, дезоксиаденозилкобаламін; вітаміну Н (біотину) - карбоксибіотин; фолієвої кислоти - тетрагідрофолієва кислота; - динуклеотиди (похідні нікотинаміду - НАД, НАДФ; похідна рибофлавіну - ФАД); - нуклеотиди - похідні пуринів та піримідинів (АТФ, АДФ, ЦТФ, ЦДФ, УТФ, УДФ); - комплекси порфіринів з іонами металів. Білет 7 1.Специфічність ферментів. Ферменти є високоспецифічними каталізаторами, тобто діють, як правило, на структурно близькі субстрати, що мають певний хімічний зв’язок, структурно подібні радикали або функціональні групи. Проявом високої специфічності ферментів є їх стереоспецифічність, тобто здатність перетворювати тільки певні стереоізомери, наприклад L- або D-амінокислоти, D- або L-моносахариди Ферменти зазвичай проявляють високу специфічність по відношенню до своїх субстратів. Це досягається частковою комплементарністю форми, розподілу зарядів і гідрофобних областей на молекулі субстрату і в ділянці зв'язування субстрату на ферменті. Ферменти демонструють високий рівеньстереоспецифічності (просторової специфічності), регіоселективності (специфічності орієнтації) і хемоселективності (специфічності до хімічних груп). Модель «ключ-замок» Реалістичніша ситуація індукованої відповідності — «неправильні» субстрати дуже великі або дуже маленькі та не підходять до активного центруУ 1890 році Еміль Фішер припустив, що специфічність ферментів визначається точною відповідністю форми ферменту і субстрату. Таке припущення називається моделлю «ключ-замок». Фермент з'єднується з субстратом з утворенням короткоживучого фермент-субстратного комплексу. Проте, хоча ця модель пояснює високу специфічність ферментів, вона не пояснює явища стабілізації перехідного стану, який спостерігається на практиці. Модель індукованої відповідності У 1958 році американський дослідник Деніел Кошланд запропонував модифікацію моделі «ключ-замок». Ферменти, в основному, — не жорсткі, а гнучкі молекули. Активний центр ферменту може змінити конформацію після зв'язування з ним субстрату. Бічні групи амінокислот активного центру займають таке положення, яке дозволяє ферменту виконувати свою каталітичну функцію. В деяких випадках молекула субстрату також міняє конформацію після скріплення в активному центрі. На відміну від моделі «ключ-замок», модель індукованої відповідності пояснює не тільки специфічність ферментів, але і стабілізаціюперехідногоHYPERLINK "https://uk.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B5%D1%85%D1%96%D0%B4%D0%BD%D0%B8%D0%B9_%D1%81%D1%82%D0%B0%D0%BD" стану. Активація ферментів Активатори- це речовини, що збільшують швидкість ферментативної реакції. Роль активаторів можуть відігравати як органічні (жовчні кислоти, ферменти й ін.), так і неорганічні речовини (іони металів, аніони). Іони металів бувають досить специфічними активаторами для певних ферментів. Вони можуть сприяти приєднанню субстрату до ферменту, брати участь у формуванні третинної структури ферменту або бути складником активного центру. Іони багатьох металів (натрію, калію, кальцію, магнію, заліза, міді та ін.) є обов’язковими компонентами, що необхідні для нормального функціонування багатьох ферментів. Прикладами активуючої дії аніонів можуть бути аніони хлору відносно пепсину та амілази слини; аніони галогенів – аденілатциклази; жовчні кислоти – панкреатичної ліпази. Активація ряду ферментів залежить від процесів фосфорилювання і дефосфорилювання. Так, фосфорилаза, що відщеплює від глікогену одну молекулу глюкози, проявляє свою дію тільки у фосфорильованому стані (фосфорилаза А), в нефосфорильованому стані (фосфорилаза В) вона неактивна. В основі активації ферментів лежать різні механізми. Серед них можна назвати такі: 1 – активація за допомогою впливу на активний центр; 2 – активація шляхом відщеплення від ферменту частини пептидного ланцюга або якоїсь неорганічної сполуки, що закривала активний центр; 3 – активація шляхом приєднання до ферменту якоїсь модифікуючої сполуки; 4 – активація шляхом дисоціації неактивного комплексу ферменту на субодиниці, одна з яких проявляє властивості ферменту.
Білет 8 Білет №9 1.Ізоферменти, особливості будови та функціонування, значення в діагностиці захворювань. Ізоферменти (ізоензими; ізозими) – множинні молекулярні форми одного й того ж ферменту. Ізоферменти каталізують одну й ту ж біохімічну реакцію, але розрізняються за своєю первинною структурою і, відповідно, фізико-хімічними (молекулярною масою, рухомістю при електрофорезі тощо) та каталітичними (різною спорідненістю ферменту із субстратом - Кm) властивостями. Різні ізоферменти одного й того ж ферменту можуть бути присутні в різних органах і тканинах (ізоферменти лактатдегідрогенази), субклітинних структурах (мітохондріальний та цитозольний ізоферменти ізоцитратдегідрогенази). В разі, якщо фермент, що представлений ізоферментними формами, має олігомерну будову, його ізоферменти формуються за рахунок різних комбінацій неідентичних протомерів. Прикладом такого ізоферментного сімейства можуть бути ізоферменти лактатдегідрогенази (ЛДГ) - ферменту, що каталізує оборотну реакцію перетворення піровиноградної кислоти в молочну. За своєю молекулярною будовою ЛДГ є тетрамером, що побудований із протомерів двох типів: Н (серцевого - heart, англ.) та М (м'язового - muscle). В організмі людини присутні п'ять комбінацій зазначених протомерів, які створюють різні ізоферменти ЛДГ: ЛДГ1 (Н4), ЛДГ2 (Н3М1), ЛДГ3 (Н2М2), ЛДГ4 (Н1М3) та ЛДГ5 (М4). Вони розподілені переважно в різних органах (міокарді, печінці, скелетних м'язах, нирках тощо). Ці ізоферменти розрізняються за своєю електрофоретичною рухомістю і їх визначення в плазмі крові має діагностичне значення для виявлення пошкоджень мембранних структур клітин, що спостерігаються при різних захворюваннях. Зокрема, при інфаркті міокарда збільшується концентрація в плазмі ізоферменту ЛДГ1, а при інфекційному та токсичному гепатиті - ізоформ ЛДГ4 та ЛДГ5, характерних для клітин печінки.
2. Ензимодіагностика патологічних процесів та захворювань. Для ранньої діагностики низки захворювань використання ферментів виявилося інформативнішим порівняно з іншими біохімічними тестами. Так, зміну активності аланінамінотрансферази, аспартатамінотрансферази, альдолази при інфекційному гепатиті у більшості хворих виявляють значно раніше, ніж інші біохімічні показники (тимолова проба, вміст білірубіну, білкових фракцій тощо). Підвищення активності лужної фосфатази при рахіті, креатинфосфокінази, аспартатамінотрансферази — при інфаркті міокарда використовують для ранньоїдіагностики цих захворювань. При багатьох захворюваннях зміна активності ферментів може бути настільки специфічною, що є одним із вирішальних критеріїв під час установлення діагнозу. Переконливим прикладом може бути використання сорбітолдегідрогенази для діагностики печінкових і обтураційних жовтяниць, креатинфосфокінази та аспартатамінотрансферази — для диференціації інфаркту міокарда й стенокардії. Нерідко активність ферментів змінюється ще до прояву клінічних ознак загострення. Наприклад, підвищення активності аланінамінотрансферази передує збільшенню вмісту білірубіну, погіршенню самопочуття хворого. Це допомагає своєчасно розпізнати ускладнення і змінити терапевтичну тактику. Ферменти успішно використовують у клінічній практиці для оцінювання ефективності лікування, прогнозу захворювання. Відсутність зміни активності ферментів на тлі використання лікарських та інших методів лікування свідчить про низьку їх ефективність. Так, визначення активності амінотрансфераз у сироватці крові достовірніше відображує ступінь репаративних процесів у печінці при гепатиті порівняно із вмістом білірубіну. Багато ферментів використовують у клініці для прогнозування перебігу захворювання. Наприклад, стійке зниження активності холінестерази при хронічному гепатиті свідчить про прогресування процесу й ускладнення захворювання. Різке зниження активності амінотрансфераз на тлі зростання вмісту білірубіну (ферментно-білірубінова дисоціація) свідчить про виснаження тканинних джерел ферментів за рахунок тяжкого ушкодження паренхіми печінки, що визначає відповідний прогноз. Перспективним для ферментодіагностики є дослідження ізоферментів. Доведено, що в разі ушкодження тканин ізоферменти надходять у кров та інші біологічні рідини і їхній ізоферментний спектр стає близьким до тканинного, що покладено в основу використання ізоферментів у діагностиці. Знаючи топографію ізоферментів у клітині, особливості їх тканинних і сироваткових спектрів, можна встановити локалізацію патологічного процесу. Дослідження ізоферментів має переваги перед визначенням загальної активності ферментів, оскільки їм властиві одночасно висока чутливість і специфічність. Ізоферментні спектри широко використовують для діагностики різних видів патології, насамперед у гепатології, кардіології, при захворюваннях нирок, підшлункової залози, легенів, скелетних м’язів, в онкології, гематології тощо. Коферментні ф-ції ретинолу. Ретинол (кофермент 2 групи) входить до складу глікозилтрансфераз, які переносять олігосахариди через клітинну мембрану для синтезу глікопротеїнів, іммуноглобулінів, лізоциму, муцинів слизу, що вкривають покриви шлунково-кишкового тракту, дих., сечовивідних та статевих шляхів, очнеяблуко, сльозових каналів.
Вітамін А є ненасиченим одноатомним спиртом, до складу якого входить (3-іононове кільце та боковий ланцюг з двох залишків ізопрену, який має первинну спиртову группу. Вітамін А містить два вітамери — А (ретинол) та А2 (дегідроретинол, що має додатковий подвійний зв’язок в р-іононовому кільці). В організмі ретинол (вітамін A-спирт) перетворюється в ретиналь (вітамін А-альдегід) та ретиноєву кислоту (вітамін A-кислота), тобто відбувається окислення спиртової групи вітамерів А, і А2 в альдегідну та карбоксильну відповідно.
4. Цикл трикарбонових кислот. Локалізація, послідовність ферментативних реакцій, значення в обміні речовин. Цикл трикарбонових кислот (ЦТК) - це загальний кінцевий шлях окислювального катаболізму клітини в аеробних умовах. Реакції і ферменти ЦТК локалізовані в матриксі та внутрішній мембрані мітохондрій. Вони функціонально та біохімічно спряжені з мітохондріальними електроно- транспортними ланцюгами, що використовують для відновлення атомів кисню відновлювальні еквіваленти від НАДН (НАДН2) та ФАДН2 або ФМНН2, і утворюють АТФ у ході окисного фосфоритування. Цикл починається з взаємодії молекули ацетил-СоА з чотири вуглеводневою дикарбоновою кислотою-щавелевооцтовою (оксалоацетата), в результаті утворюється шести вуглеводнева три карбонова кислота - лимонна. Далі йде серія реакцій, в ході яких відбувається вивільнення двох молекул СО2 і регенерація оксалоацетата. Оскільки кількість оксалоацетата, необхідне для перетворення великого числа ацетильних одиниць в СО2 досить невелика, можна вважати, що оксалоацетат виконує каталітичну роль. Цикл лимонної кислоти є механізмом, що забезпечує вловлювання більшої частини вільної енергії, що звільняється в процесі окислення вуглеводів, ліпідів і білків. В процесі окислення ацетил-СоА завдяки активності ряду специфічних дегідрогеназ відбувається утворення відновних еквівалентів у формі водню або електронів. Останні надходять в дихальний ланцюг; при функціонуванні цього ланцюга відбувається окисне фосфорилювання, тобто синтезується АТФ. 5. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання. Окисне фосфорилювання – процес, шляхом якого хімічна енергія, що вивільняється під час транспортування електронів упродовж дихального (електронотранспортного) ланцюга мітохондрій, уловлюється та використовується для синтезу аденозинтрифосфату (АТФ) з аденозиндифосфату (АДФ) та неорганічного фосфату (Фн). Синтез АТФ з АДФ та неорганічного фосфату отримав назву спряження дихання (електронного транспорту в мітохондріях)та окисного фосфорилювання. Синтез однієї молекули АТФ з АДФ та Фн потребує витрат хімічної енергії, що дорівнюють + 7,3 ккал (+ 30,5 кДж). Очевидно, що енергії, яка вивільняється за умов транспорту електронів у дихальному ланцюгу мітохондрій, достатньо для синтезу декількох молекул АТФ. Безпосередніми біохімічними дослідженнями доведено, що за умов окислення субстратів через НАДН: коензим Q-редуктазу утворюється 3 молекули АТФ, при дії сукцинат: коензим Q-редуктази - 2 молекули АТФ. Коефіцієнт окисного фосфорилування — відношення кількості зв'язаного (етерифікованого) неорганічного фосфату (моль) до кількості поглинутого мітохондріями кисню (моль) (позначається як Фн (Рi)/O) - кількісно дорівнює числу молекул АТФ, що утворюються при перенесенні двох відновлювальних еквівалентів на один атом кисню, тобто АТФ/О –табл(стор 131) Пункти спряження транспорту електронів та окисного фосфорилування Утворення АТФ з АДФ та Фн може відбуватися тільки в певних ділянках електронотранспортного ланцюга мітохондрій, в яких величина хімічної енергії, що виділяється при транспортуванні пари електронів між двома редокс-системами (компонентами дихального ланцюга), достатня для синтезу 1 молекули АТФ (тобто > 7,3 ккал, або 30,5 кДж). Ділянки дихального ланцюга мітохондрій, де вивільнення хімічної енергії достатнє для синтезу молекули АТФ: Комплекс І (НАДН → коензим Q) 12,2 ккал 51,0 кДж Комплекс III (цитохром b → цитохром с1) 9,9 ккал 41,4 кДж Комплекс IV (цитохром а3 → О2) 23,8 ккал 99,6 кДж Зазначені ділянки електронотранспортного ланцюга називаються пунктами спряження дихання (електронного транспорту) з окисним фосфоритуванням. Субстратне фосфорилювання ЦТК. Субстратне фосфорилювання – процес синтезу АТФ, який відбувається як результат окиснення субстратів без участі дихального ланцюга мітохондрій. У цьому разі перетворення субстрату в продукт супроводжується фосфорилюванням АДФ з утворенням АТФ. В організмі є три реакції субстратного фосфорилювання (дві – в гліколізі, одна – в ЦТК). Кожна з цих реакцій супроводжується утворенням лише одної молекули АТФ. Цей процес можливий як в аеробних, так і анаеробних умовах і відбувається в цитоплазмі і матриксі мітохондрій Білет 10 1)Методи виявлення ферментів в біологічних об*єктах Принципи та методи виявлення ферментів у біооб’єктах. Здебільшого кількість фермента не можна виміряти в одиницях маси, тобто в міліграмах або в молях, про неї опосередковано свідчить його активність, тобто дія фермента. Іншими словами, присутність і кількість фермента виявляють за специфічністю та швидкістю реакції, яку він каталізує. Активність фермента можна визначити опосередковано: за визначенням кількості продукту, який утворився під дією ферменту, або за кількістю витраченого субстрату за одиницю часу при оптимальних умовах ферментативної реакції. Як приклад розглянемо принцип методу визначення активності a-амілази, яка каталізує гідролітичне розщеплення крохмалю з утворенням у кінцевому результаті мальтози. Активність амілази розраховують на основі кількості негідролізованого крохмалю або за кількістю утвореної мальтози. Найчастіше активність ферментів визначають у сироватці, плазміабоклітинах крові та в сечі колориметричними, спектрофотометричними, флюориметричними, манометричними, кондуктометричними, віскозиметричними методами. У клініко-діагностичних лабораторіях для визначення активності ферментів переважно застосовують колориметричні та спектрофотометричні методи. В основі колориметричних методів лежить вимірювання за допомогою фотоелектроколориметра інтенсивності забарвлення речовини, яка утворюється під час взаємодії субстрату або продукту ферментативної реакції зі специфічними реактивами, які додаються у пробу після припинення реакції. Ці методи широко застосовують для визначення активності оксидоредуктаз, зокрема НАД- та НАДФ-залежних дегідрогеназ. Перехід НАД+ або НАДФ+ з окисненої форми у відновлену супроводжується зміною поглинання в ультрафіолетовій ділянці спектра. В окисненій формі кофермент дає одну вузьку смугу поглинання при λ=260 нм, яка обумовлена наявністю аденіну в його молекулі. 2)Ензимотерапія Ензимотерапія — використання ферментів як лікарських засобів проводиться переважно в разі нестачі в організмі якогось ферменту, коферменту або як допоміжний засіб при деяких захворюваннях. Засоби замісної терапії використовують досить давно. Передусім це ферменти шлункового соку (пепсин, абомін) та підшлункової залози (панкреатин), а також багатокомпонентні препарати, що містять у своєму складі ферменти, які чинять комплексний вплив на білки, жири, вуглеводи (фестал, панзинорм, дигестал, онотон, ктазим, комбіцин). їх застосовують для поліпшення функціонального стану травного каналу та нормалізації процесів травлення. Вобензим. Препарат є спеціально підібраною комбінацією ферментів з імуномодулювальним, протинабряковим і певною мірою фібринолітичним впливом. Він чинить загальнотерапевтичну дію при запальних процесах, обмежує патологічні прояви автоімунних продуктів обміну речовин і некротизованих тканин, розсмоктує гематоми, нормалізує проникність судинних стінок, густину крові й тим самим поліпшує мікроциркуляцію. Препарат застосовують для лікування синуситу, бронхіту, бронхопневмонії, панкреатиту, виразкового коліту, хвороби Крона, розсіяного склерозу, ІХС, ревматоїдного артриту; Аспарагіназа виявляє антилейкемічну активність. Протипухлинний ефект зумовлений здатністю аспарагінази каталізувати гідроліз амінокислоти аспарагіну, необхідної лейкозним клітинам для їх розвитку: дефіцит аспарагіну впливає на клітинні мембрани, що істотно полегшує транспорт білків і поліпептидів крізь мембрани ракових клітин. Відомо, що клітини деяких злоякісних пухлин позбавлені здатності синтезувати аспарагін з інших сполук, оскільки в них відсутня аспарагінсинтетаза. Цитохром С — фермент, що бере участь у процесах тканинного дихання. Ферум, який міститься в його простетичній групі, зворотно переходить із окисненої форми у відновлену, у зв’язку з чим препарат прискорює перебіг окисних процесів. Препарат застосовують для поліпшення тканинного дихання при асфіксії новонароджених, астматичних станах, хронічній пневмонії, серцевій недостатності, ішемічній хворобі серця, інфекційному гепатиті, старечій дегенерації сітківки тощо. Велика група лікарських засобів належить до регуляторів активності ферментів, передусім до їх інгібіторів. Необхідність у них виникає досить часто, а саме: • у разі дефіциту фізіологічних інгібіторів, які виконують важливу для організму функцію — обмеження впливу ендогенних ферментів, а інколи — його захисту від ушкоджувальної дії чужорідних ферментів, зокрема мікробного походження; • під час введення з лікувальною метою ферментів у неадекватній дозі або в разі несприйняття введеного ферменту. Так, при передозуванні тромболітичних препаратів (фібринолізину), активаторів плазміну (стрептокінази, урокінази) застосовують інгібітори протеолізу (трасилол, амінокапронову кислоту тощо); • під час захворювань, у патогенезі яких певну роль відіграє гіперфункція ферментів, пов’язана з неадекватною їх активацією, аномальним викидом у кров і тканини (механічні, термічні й хімічні травми, інфекційна патологія, тромбози та емболії тощо); • під час змін ферментного спектра, при патологічному переважанні однієї ізоформи ферменту над іншою. У клінічній практиці з цією метою інгібітори широко використовують в онкології, оскільки пригнічення активності ферментів пухлинних клітин — один із відомих напрямів створення лікарських препаратів для терапії онкопатології; • у разі потреби викликати необхідну, найчастіше нефізіологічну, реакцію. На цьому принципі ґрунтується дія деяких регуляторів судинного тонусу (інгібіторів тих ферментів, які беруть участь в утворенні ангіотензину II або катехоламінів), активаторів метаболічних процесів у печінці, лікарських засобів, які пригнічують синтез простагландинів тощо. Інгібітори ферментів, потенційно придатні для застосування в терапії, досить поширені в природі, їх також можна отримувати шляхом синтезу. Більшість інгібіторів тваринного й рослинного походження, вивчені в експерименті чи клініці, є поліпептидами з молекулярною масою понад 5 000, тоді як мікробні інгібітори, як правило, мають невелику молекулярну масу. Інгібітори, виділені з рослин і мікроорганізмів, належать переважно до простих білків, а інгібітори тваринного походження часто містять у своєму складі вуглеводи. Наприклад, значна кількість інгібіторів протеаз тваринного походження є глікопротеїнами. Для деяких рослинних інгібіторів характерний низький уміст ароматичних амінокислот. Слід зазначити, що багато мікроорганізмів продукують хімічні сполуки, здатні впливати на ферментативні процеси в тканинах організмів тварин і людини. 3)Коферментні функції вітаміну К Коферментна форма: гідрохінонна форма
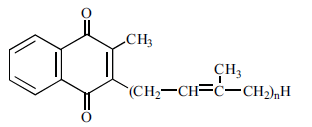
Вітамін К має група вітамерів — похідних 2-метил-1,4-нафтохінона. Розрізняють вітамін К1 (філохінон) та вітамін К2 (фарнохінон). ВітамінК1 є похідним 2-ме- тил-1,4-нафто- хінону, бічним вуглеводневим радикалом, у якому є похід- не ізопрену — фітил (2-ме- тил-3-фітил-1,4-нафтохінон). Цей вітамер був вперше виділений із люцерни і є біологічно найбільш ак- тивною формою вітаміну К. ВітамінК2має довший бічний ізо- преноїдний ланцюг, будучи за хіміч- ною будовою 2-метил-3-фарнезил- 1,4-нафтохіноном; вітамер був вперше виділений із рибного борошна. Біологічні властивості Біологічна дія вітаміну К в організмі людини і тварин полягає в його впливі на функціонування згортальної системи крові (“антигеморагічний” вітамін). Оскільки вітамін К є необхідним компонентом для утворення факторів коагуляції крові II, VII, IX, X, недостатність вітаміну супроводжується небезпечними для життя кровотечами. Біохімічні механізми прокоагулянтної дії
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 988; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.19.123 (0.018 с.) |