
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Прості та складні білки-ферменти, простетичні групи складних білків-ферментів (кофактори,коферменти)Содержание книги
Поиск на нашем сайте
Ферменти відрізняються по своїй структурі. Їх поділяють на 2 групи – прості і складні. Прості, або однокомпонентні; - ферменти складаються тільки із амінокислот. До них відносяться невелика кількість ферментів (рибонуклеаза, амілаза, альдолаза, уреаза, пепсин та ін.). Але більшість ферментів складається з двох компонентів: небілкової частини, або простетичної групи, і білкової – апофермент. Ці дві частини фермента окремо не мають сили, але тільки в комплексі одне з іншим вони проявляють каталітичну здатність. ПРОСТЕТИЧНА ГРУПА — компонент складних ферментів та інших складних білків, пов’язаний з білковою частиною міцними ковалентними зв’язками. П.г. ферментів є похідні вітамінів, нуклеотидів, залізопорфіринів та ін. П.г. забезпечують каталітичну активність ферменту, формування активних центрів та інших важливих доменних структур. Найважливішими П.г. складних ферментів є флавіннуклеотиди — ФМН та ФАД, тіамінпірофосфат, похідні вітаміну В6 (піридоксаль- і піридоксамінфосфат), біотин, тіоктова (ліпоєва) кислота, залізопорфіринові комплекси тощо. Кофактори та коферменти. Будова та властивості коферментів, вітаміни як попередники в біосинтезі коферментів.Кофактори та коферменти Кофактори. Багато ферментів потребують для реалізації своєї каталітичної активності наявності певних низькомолекулярних небілкових сполук кофакторів. Роль кофакторів можуть відігравати біоорганічні сполуки різної хімічної природиабо іони металів (Mg2+, Ca2+, Fe3+, Fe2+, Cu2+, Cuj+ та ін.). Іони металів зв'язані з апоферментом або входять до складу небілкової простетичної групи - найчастіше порфіринового кільця гемінових ферментів (цитохромів, пероксидаз, каталази). Ферменти, які міцно зв'язані з іонами металів і не втрачають цього зв'язку за умов виділення та фракціонування ферменту, назваються металоферментами. У деяких випадках іони металів не входять до складу ферментів як інтегральні структурні компоненти, а виконують лише функцію їх активаторів. Коферменти (коензими) — біоорганічні сполуки небілкової природи, що є необхідними для дії ферменту, тобто перетворення субстрату в каталітичному акті. Коферменти можуть сполучатися з білковою частиною (апоферментом) не ковалентними фізико-хімічними або ковалентними зв'язками (в останньому випадку вони є простетичними групами ферментного білка – флавінові коферменти, піридоксаль-фосфат, ліпоєва кислота тощо); інколи коферменти утворюють комплекси з апоферментом лише в ході каталітичного процесу (НАД, НАДФ). За хімічною природою коферменти підрозділяють на: - похідні вітамінів, зокрема: вітаміну В, - тіаміндифосфат; вітаміну В2 - флавінмононуклеотид (ФМН); вітаміну В6 - піридоксальфосфат, піридоксамінфосфат; пантотенової кислоти - коензим А; вітаміну В12 - метилкобаламін, дезоксиаденозилкобаламін; вітаміну Н (біотину) - карбоксибіотин; фолієвої кислоти - тетрагідрофолієва кислота; - динуклеотиди (похідні нікотинаміду - НАД, НАДФ; похідна рибофлавіну - ФАД); - нуклеотиди - похідні пуринів та піримідинів (АТФ, АДФ, ЦТФ, ЦДФ, УТФ, УДФ); - комплекси порфіринів з іонами металів. Коферменти: типи реакцій, які каталізують окремі класи коферментів. За типом реакції,яку каталізують коферменти,їх поділяють на: 1)Коферменти,що є переносниками атомів водню та електронів 2)Коферменти,що є перенесониками різних хімічних груп 3)Коферменти синтезу,ізомеризації та розщеплення вуглець-вуглецевих зв*язків Алостеричні ферменти - це різновид регуляторних ферментів, що, крім активного центру, мають додатковий регуляторний (алостеричний) центр, з яким взаємодіють алостеричні регулятори (ефектори, модулятори). Алостеричні ефектори можуть бути як позитивними, тобто такими, що збільшують каталітичну активність ферменту (алостеричні активатори), так і негативними, тобто такими, що її гальмують (алостеричні інгібітори). За своєю молекулярною будовою алостеричні регуляторні ферменти складаються, як правило, з декількох поліпептидних ланцюгів, тобто мають четвертинну структуру. Активний та регуляторний (алостеричний) центри локалізуються на різних білкових субодиницях - каталітичній ті регуляторній, відповідно. Модифікація каталітичної активності такого ферменту здійснюється шляхом передачі на каталітичні субодиниці конформаційних змін із регуляторних субодиниць, які відбуваються в останніх після взаємодії з лігандами - ефекторами.
3.Коферментні функції гему Гем. Структурною основою гему є протопорфірин IX, який складається з 4 пірольних кілець, які з’єднанні метиновими містками. До складу гему входить іон металу зі змінною валентністю (залізо або мідь), тому він може брати участь в окисно-відновних реакціях – віддавати та приймати електрони:
Гем, наприклад, входить до складу цитохромів мітохондрій, які транспортують електрони із субстратів на кисень і створюють умови для синтезу АТФ. Крім того, гемвмісними ферментами є каталаза та пероксидаза:
|
||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 955; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.176.191 (0.007 с.) |

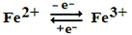 .
.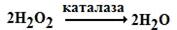
 .
.


