Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Внутрішньоклітинна локалізація ферментівСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Ферменти виявлено у всіх структурних компонентах клітини. Внутрішньоклітинна локалізація ферментів безпосередньо пов’язана з функцією, яку виконує дана структура і природою хімічних процесів, які в ній відбуваються. У ядрі містяться ферменти, що беруть участь у процесі реплікації ДНК (ДНК -полімераза), синтезі нікотинамідаденіндинуклеотиду (НАД). З мітохондріями зв'язані ферменти піруватдегідрогеназного комплексу, циклу трикарбонових кислот, окиснення жирних кислот і деяких амінокислот, синтезу сечовини, а також ферменти переносу електронів та окисного фосфорилювання. У лізосомах містяться переважно гідролітичні ферменти (гідролази) з оптимумом рН у зоні 5. Саме через гідролітичний характер дії ферментів ці органели назвали лізосомами. У рибосомах локалізуються ферменти білкового синтезу. У цих структурах відбувається зв'язування амінокислот у поліпептидні ланцюги з утворенням молекул білка. В ендоплазматичному ретикулумі локалізовані ферменти синтезу ліпідів, а також ферменти, що беруть участь у реакціях гідроксилювання (ферментна система мікросомального окиснення). З плазматичною мембраною насамперед зв'язані АТФ-аза, що забезпечує транспортування іонів Na+ і К+, аденілатциклаза й ряд інших ферментів. У гіалоплазмі (недиференційованій частині внутрішньоклітинного вмісту) локалізовані ферменти гліколізу, пентозного циклу окиснення вуглеводів, синтезу жирних кислот, синтезу мононуклеотидів, активації амінокислот, а також багато ферментів глюконеогенезу.
2. Ензимопатії Галактоземії (дефіцит галактозо-1-фосфат-уридилтрансферази). Відбувається порушення процесу ферментативного перетворення галактози на глюкозу з накопиченням галактози й продуктів її обміну в клітинах, що виявляє ушкоджувальну дію на функції печінки, головного мозку, кришталика ока, нирок. Фруктоземії (дефіцит фруктозо-1-фосфатальдолази, фруктокінази або фруктозо-1,6-дифосфатальдолази). Патологія проявляється фруктоземією, фруктозурією та тяжкою гіпоглікемією, що розвивається після споживання дієти, яка містить фруктозу. Глікогенози – група спадкових ензимопатій, в основі яких лежить зниження або відсутність активності ферментів, що каталізують реакції синтезу або розпаду глікогену, або порушення регуляції цих ферментів. Альбінізм (дефіцит тирозинази). Відзначається прискорене розщеплення родопсину, наслідком чого є поганий зір вдень і фотофобія. Малі дози сонячного світла можуть призвести до розвитку фотодерматозу. Гіпергістидинемія (дефіцит гістидинази). У хворих відзначають зниження інтелекту, порушується функція ЦНС (судоми, невпевнена хода). Цистиноз (дефіцит цистеїндіоксигенази). Унаслідок порушення реабсорбції майже всіх амінокислот у ниркових канальцях (за винятком циклічних) зростає екскреція всіх амінокислот у 5–10 разів, із них цистину й цистеїну – у 20–30 разів. Відбувається вибіркове відкладання цистину в ретикулярних клітинах кісткового мозку, селезінці, печінці й клітинах рогівки ока. Гіперпролінемія (дефіцит проліноксидази). Характеризується порушенням обміну проліну, що супроводжується розумовою відсталістю та порушенням функцій нирок. 3. Коферментні функції Біотину Биотин стимулирует синтез метионина из серина и гомоцистеина и процессы метилирования вообще, способствуя накоплению коферментных форм фолиевой кислоты. Таким образом, при недостаточности биотина нарушена утилизация организмом фолиевой кислоты и превращение ее в активные коферментные формы. По-видимому, биотин принимает непосредственное участие в ферментативных процессах превращения фолиевой кислоты в ее коферментные производные (Marchetti e. а., 1966). Биотин благоприятно влияет на общее состояние организма и сохранение аскорбиновой кислоты в тканях цинготных морских свинок. В свою очередь аскорбиновая кислота замедляет, хотя и не предотвращает развитие авитаминоза биотина у крыс. При недостаточности биотина снижается содержание тиамина в печени, селезенке,. почках и мозге животных. У крыс, содержавшихся на рационе, лишенном биотина, содержание витамина B12 было выше, чем у контрольных животных, получавших биотин. Эти два витамина тесно связаны между собой в обмене пропионовой кислоты у микроорганизмов и животных. Существует тесная связь между биосинтезом биотина и пантотеновой кислоты у микроорганизмов и зеленых растений (В. В. Филиппов, 1962). Биотин облегчает симптомы пантотеновой недостаточности и, наоборот, пантотеновая кислота смягчает проявление авитаминоза биотина.
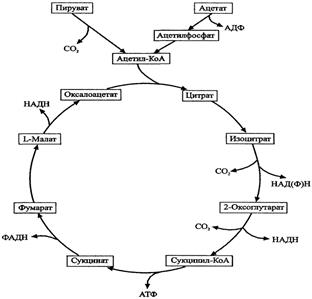
4. Цикл Трикарбонових кислот 1. Утворення лимонної кислоти (цитрату) за рахунок конденсації ацетил-КоА з щавлевооцтовою кислотою (оксалоацетатом)
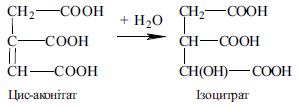
Реакція каталізується ферментомцитратсинтазою. Вона є регуляторним ферментом, активність якого гальмується АТФ, НАДН, сукциніл-КоА та довголанцюговими ацил-КоА. 2. Перетворення (ізомеризація) цитрату на ізоцитрат. Реакція каталізується ферментом аконітазою і складається з двох етапів:
Дегідратація лимонної кислоти з утворенням цис-аконітової кислоти (цис-аконітату):
Приєднання до цис-аконітату молекули води. При приєднанні до подвійного зв’язку в складі цис-аконітату Н+ та ОН- у транс-положенні результатом реакції є утворення ізолимонної кислоти (ізоцитрату) 3. Дегідрування та декарбоксилювання ізоцитрату. Реакція каталізується НАД- залежною ізоцитратдегідрогеназою і призводить до утворення α-кетоглутарової кислоти (α-кетоглутарату).
Ізоцитратдегідрогеназа є регуляторним ферментом, позитивний модулятор якого — АДФ, негативний — НАДН.
4. Окислення α-кетоглутарату до сукцинату. Цей процес відбувається у дві стадії: Окислювальне декарбоксилювання α-кетоглутарату з утворенням сукциніл-КоА — стадія, що каталізується мультиензимним а-кетоглутарат- дегідрогеназним комплексом. Кінцевий продукт — високоенергетичний тіоефір сукциніл-КоА, в макроергічному зв’язку якого акумульовано хімічну енергію окислювально-відновлювальною реакцією, що мала місце
НАДН, що утворився в цій реакції, окислюється в дихальному ланцюзі мітохондрій із генерацією 3 молекул АТФ. Деацилювання сукциніл-КоА (перетворення на янтарну кислоту (сукцинат). Реакція каталізується ферментом сукцинілтіокіназою. У результаті розщеплюється макроергічний зв’язок у молекулі сукциніл-КоА, та за рахунок цієї енергії утворюється нова макроергічна сполука нуклеозидтрифосфат ГТФ
Потім ГТФ передає свою кінцеву фосфатну групу на АДФ у нуклеозидфосфокіназній реакції з утворенням АТФ 5. Окислення янтарної кислоти до фумарової кислоти (фумарату). Реакція каталізується ФАД-залежним ферментом сукцинатдегідрогеназою
Окислення відновленого коферменту (ФАДН2) за допомогою коензиму Q дихального ланцюга мітохондрій призводить до синтезу за рахунок окисного фосфорилювання 2 молекул АТФ. 6. Перетворення фумарової кислоти на яблучну кислоту (малат) внаслідок приєднання до фумарату молекули води. Реакція каталізується ферментом фумаратгідратазою (фумаразою)
7. Окислення малату до оксалоацетату (щавлевооцтової кислоти). Реакція каталізується НАД-залежним ферментом — малатдегідрогеназою мітохондрій
Окислення НАДН, що утворився, в дихальному ланцюзі мітохондрій призводить до генерації 3 молекул АТФ. Малатдегідрогеназна реакція завершує цикл трикарбонових кислот. Оксалоацетат, який є продуктом даної реакції, здатний до взаємодії з новими молекулами ацетил-КоА. 5. Шляхи включення відновних еквівалентів(електронів і протонів) у дихальний ланцюг мітохондрій Білет №9 1.Ізоферменти, особливості будови та функціонування, значення в діагностиці захворювань. Ізоферменти (ізоензими; ізозими) – множинні молекулярні форми одного й того ж ферменту. Ізоферменти каталізують одну й ту ж біохімічну реакцію, але розрізняються за своєю первинною структурою і, відповідно, фізико-хімічними (молекулярною масою, рухомістю при електрофорезі тощо) та каталітичними (різною спорідненістю ферменту із субстратом - Кm) властивостями. Різні ізоферменти одного й того ж ферменту можуть бути присутні в різних органах і тканинах (ізоферменти лактатдегідрогенази), субклітинних структурах (мітохондріальний та цитозольний ізоферменти ізоцитратдегідрогенази). В разі, якщо фермент, що представлений ізоферментними формами, має олігомерну будову, його ізоферменти формуються за рахунок різних комбінацій неідентичних протомерів. Прикладом такого ізоферментного сімейства можуть бути ізоферменти лактатдегідрогенази (ЛДГ) - ферменту, що каталізує оборотну реакцію перетворення піровиноградної кислоти в молочну. За своєю молекулярною будовою ЛДГ є тетрамером, що побудований із протомерів двох типів: Н (серцевого - heart, англ.) та М (м'язового - muscle). В організмі людини присутні п'ять комбінацій зазначених протомерів, які створюють різні ізоферменти ЛДГ: ЛДГ1 (Н4), ЛДГ2 (Н3М1), ЛДГ3 (Н2М2), ЛДГ4 (Н1М3) та ЛДГ5 (М4). Вони розподілені переважно в різних органах (міокарді, печінці, скелетних м'язах, нирках тощо). Ці ізоферменти розрізняються за своєю електрофоретичною рухомістю і їх визначення в плазмі крові має діагностичне значення для виявлення пошкоджень мембранних структур клітин, що спостерігаються при різних захворюваннях. Зокрема, при інфаркті міокарда збільшується концентрація в плазмі ізоферменту ЛДГ1, а при інфекційному та токсичному гепатиті - ізоформ ЛДГ4 та ЛДГ5, характерних для клітин печінки.
2. Ензимодіагностика патологічних процесів та захворювань. Для ранньої діагностики низки захворювань використання ферментів виявилося інформативнішим порівняно з іншими біохімічними тестами. Так, зміну активності аланінамінотрансферази, аспартатамінотрансферази, альдолази при інфекційному гепатиті у більшості хворих виявляють значно раніше, ніж інші біохімічні показники (тимолова проба, вміст білірубіну, білкових фракцій тощо). Підвищення активності лужної фосфатази при рахіті, креатинфосфокінази, аспартатамінотрансферази — при інфаркті міокарда використовують для ранньоїдіагностики цих захворювань. При багатьох захворюваннях зміна активності ферментів може бути настільки специфічною, що є одним із вирішальних критеріїв під час установлення діагнозу. Переконливим прикладом може бути використання сорбітолдегідрогенази для діагностики печінкових і обтураційних жовтяниць, креатинфосфокінази та аспартатамінотрансферази — для диференціації інфаркту міокарда й стенокардії. Нерідко активність ферментів змінюється ще до прояву клінічних ознак загострення. Наприклад, підвищення активності аланінамінотрансферази передує збільшенню вмісту білірубіну, погіршенню самопочуття хворого. Це допомагає своєчасно розпізнати ускладнення і змінити терапевтичну тактику. Ферменти успішно використовують у клінічній практиці для оцінювання ефективності лікування, прогнозу захворювання. Відсутність зміни активності ферментів на тлі використання лікарських та інших методів лікування свідчить про низьку їх ефективність. Так, визначення активності амінотрансфераз у сироватці крові достовірніше відображує ступінь репаративних процесів у печінці при гепатиті порівняно із вмістом білірубіну. Багато ферментів використовують у клініці для прогнозування перебігу захворювання. Наприклад, стійке зниження активності холінестерази при хронічному гепатиті свідчить про прогресування процесу й ускладнення захворювання. Різке зниження активності амінотрансфераз на тлі зростання вмісту білірубіну (ферментно-білірубінова дисоціація) свідчить про виснаження тканинних джерел ферментів за рахунок тяжкого ушкодження паренхіми печінки, що визначає відповідний прогноз. Перспективним для ферментодіагностики є дослідження ізоферментів. Доведено, що в разі ушкодження тканин ізоферменти надходять у кров та інші біологічні рідини і їхній ізоферментний спектр стає близьким до тканинного, що покладено в основу використання ізоферментів у діагностиці. Знаючи топографію ізоферментів у клітині, особливості їх тканинних і сироваткових спектрів, можна встановити локалізацію патологічного процесу. Дослідження ізоферментів має переваги перед визначенням загальної активності ферментів, оскільки їм властиві одночасно висока чутливість і специфічність. Ізоферментні спектри широко використовують для діагностики різних видів патології, насамперед у гепатології, кардіології, при захворюваннях нирок, підшлункової залози, легенів, скелетних м’язів, в онкології, гематології тощо. Коферментні ф-ції ретинолу. Ретинол (кофермент 2 групи) входить до складу глікозилтрансфераз, які переносять олігосахариди через клітинну мембрану для синтезу глікопротеїнів, іммуноглобулінів, лізоциму, муцинів слизу, що вкривають покриви шлунково-кишкового тракту, дих., сечовивідних та статевих шляхів, очнеяблуко, сльозових каналів.
Вітамін А є ненасиченим одноатомним спиртом, до складу якого входить (3-іононове кільце та боковий ланцюг з двох залишків ізопрену, який має первинну спиртову группу. Вітамін А містить два вітамери — А (ретинол) та А2 (дегідроретинол, що має додатковий подвійний зв’язок в р-іононовому кільці). В організмі ретинол (вітамін A-спирт) перетворюється в ретиналь (вітамін А-альдегід) та ретиноєву кислоту (вітамін A-кислота), тобто відбувається окислення спиртової групи вітамерів А, і А2 в альдегідну та карбоксильну відповідно.
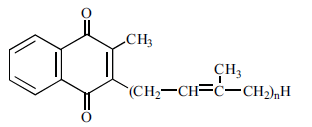
4. Цикл трикарбонових кислот. Локалізація, послідовність ферментативних реакцій, значення в обміні речовин. Цикл трикарбонових кислот (ЦТК) - це загальний кінцевий шлях окислювального катаболізму клітини в аеробних умовах. Реакції і ферменти ЦТК локалізовані в матриксі та внутрішній мембрані мітохондрій. Вони функціонально та біохімічно спряжені з мітохондріальними електроно- транспортними ланцюгами, що використовують для відновлення атомів кисню відновлювальні еквіваленти від НАДН (НАДН2) та ФАДН2 або ФМНН2, і утворюють АТФ у ході окисного фосфоритування. Цикл починається з взаємодії молекули ацетил-СоА з чотири вуглеводневою дикарбоновою кислотою-щавелевооцтовою (оксалоацетата), в результаті утворюється шести вуглеводнева три карбонова кислота - лимонна. Далі йде серія реакцій, в ході яких відбувається вивільнення двох молекул СО2 і регенерація оксалоацетата. Оскільки кількість оксалоацетата, необхідне для перетворення великого числа ацетильних одиниць в СО2 досить невелика, можна вважати, що оксалоацетат виконує каталітичну роль. Цикл лимонної кислоти є механізмом, що забезпечує вловлювання більшої частини вільної енергії, що звільняється в процесі окислення вуглеводів, ліпідів і білків. В процесі окислення ацетил-СоА завдяки активності ряду специфічних дегідрогеназ відбувається утворення відновних еквівалентів у формі водню або електронів. Останні надходять в дихальний ланцюг; при функціонуванні цього ланцюга відбувається окисне фосфорилювання, тобто синтезується АТФ. 5. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання. Окисне фосфорилювання – процес, шляхом якого хімічна енергія, що вивільняється під час транспортування електронів упродовж дихального (електронотранспортного) ланцюга мітохондрій, уловлюється та використовується для синтезу аденозинтрифосфату (АТФ) з аденозиндифосфату (АДФ) та неорганічного фосфату (Фн). Синтез АТФ з АДФ та неорганічного фосфату отримав назву спряження дихання (електронного транспорту в мітохондріях)та окисного фосфорилювання. Синтез однієї молекули АТФ з АДФ та Фн потребує витрат хімічної енергії, що дорівнюють + 7,3 ккал (+ 30,5 кДж). Очевидно, що енергії, яка вивільняється за умов транспорту електронів у дихальному ланцюгу мітохондрій, достатньо для синтезу декількох молекул АТФ. Безпосередніми біохімічними дослідженнями доведено, що за умов окислення субстратів через НАДН: коензим Q-редуктазу утворюється 3 молекули АТФ, при дії сукцинат: коензим Q-редуктази - 2 молекули АТФ. Коефіцієнт окисного фосфорилування — відношення кількості зв'язаного (етерифікованого) неорганічного фосфату (моль) до кількості поглинутого мітохондріями кисню (моль) (позначається як Фн (Рi)/O) - кількісно дорівнює числу молекул АТФ, що утворюються при перенесенні двох відновлювальних еквівалентів на один атом кисню, тобто АТФ/О –табл(стор 131) Пункти спряження транспорту електронів та окисного фосфорилування Утворення АТФ з АДФ та Фн може відбуватися тільки в певних ділянках електронотранспортного ланцюга мітохондрій, в яких величина хімічної енергії, що виділяється при транспортуванні пари електронів між двома редокс-системами (компонентами дихального ланцюга), достатня для синтезу 1 молекули АТФ (тобто > 7,3 ккал, або 30,5 кДж). Ділянки дихального ланцюга мітохондрій, де вивільнення хімічної енергії достатнє для синтезу молекули АТФ: Комплекс І (НАДН → коензим Q) 12,2 ккал 51,0 кДж Комплекс III (цитохром b → цитохром с1) 9,9 ккал 41,4 кДж Комплекс IV (цитохром а3 → О2) 23,8 ккал 99,6 кДж Зазначені ділянки електронотранспортного ланцюга називаються пунктами спряження дихання (електронного транспорту) з окисним фосфоритуванням. Субстратне фосфорилювання ЦТК. Субстратне фосфорилювання – процес синтезу АТФ, який відбувається як результат окиснення субстратів без участі дихального ланцюга мітохондрій. У цьому разі перетворення субстрату в продукт супроводжується фосфорилюванням АДФ з утворенням АТФ. В організмі є три реакції субстратного фосфорилювання (дві – в гліколізі, одна – в ЦТК). Кожна з цих реакцій супроводжується утворенням лише одної молекули АТФ. Цей процес можливий як в аеробних, так і анаеробних умовах і відбувається в цитоплазмі і матриксі мітохондрій Білет 10 1)Методи виявлення ферментів в біологічних об*єктах Принципи та методи виявлення ферментів у біооб’єктах. Здебільшого кількість фермента не можна виміряти в одиницях маси, тобто в міліграмах або в молях, про неї опосередковано свідчить його активність, тобто дія фермента. Іншими словами, присутність і кількість фермента виявляють за специфічністю та швидкістю реакції, яку він каталізує. Активність фермента можна визначити опосередковано: за визначенням кількості продукту, який утворився під дією ферменту, або за кількістю витраченого субстрату за одиницю часу при оптимальних умовах ферментативної реакції. Як приклад розглянемо принцип методу визначення активності a-амілази, яка каталізує гідролітичне розщеплення крохмалю з утворенням у кінцевому результаті мальтози. Активність амілази розраховують на основі кількості негідролізованого крохмалю або за кількістю утвореної мальтози. Найчастіше активність ферментів визначають у сироватці, плазміабоклітинах крові та в сечі колориметричними, спектрофотометричними, флюориметричними, манометричними, кондуктометричними, віскозиметричними методами. У клініко-діагностичних лабораторіях для визначення активності ферментів переважно застосовують колориметричні та спектрофотометричні методи. В основі колориметричних методів лежить вимірювання за допомогою фотоелектроколориметра інтенсивності забарвлення речовини, яка утворюється під час взаємодії субстрату або продукту ферментативної реакції зі специфічними реактивами, які додаються у пробу після припинення реакції. Ці методи широко застосовують для визначення активності оксидоредуктаз, зокрема НАД- та НАДФ-залежних дегідрогеназ. Перехід НАД+ або НАДФ+ з окисненої форми у відновлену супроводжується зміною поглинання в ультрафіолетовій ділянці спектра. В окисненій формі кофермент дає одну вузьку смугу поглинання при λ=260 нм, яка обумовлена наявністю аденіну в його молекулі. 2)Ензимотерапія Ензимотерапія — використання ферментів як лікарських засобів проводиться переважно в разі нестачі в організмі якогось ферменту, коферменту або як допоміжний засіб при деяких захворюваннях. Засоби замісної терапії використовують досить давно. Передусім це ферменти шлункового соку (пепсин, абомін) та підшлункової залози (панкреатин), а також багатокомпонентні препарати, що містять у своєму складі ферменти, які чинять комплексний вплив на білки, жири, вуглеводи (фестал, панзинорм, дигестал, онотон, ктазим, комбіцин). їх застосовують для поліпшення функціонального стану травного каналу та нормалізації процесів травлення. Вобензим. Препарат є спеціально підібраною комбінацією ферментів з імуномодулювальним, протинабряковим і певною мірою фібринолітичним впливом. Він чинить загальнотерапевтичну дію при запальних процесах, обмежує патологічні прояви автоімунних продуктів обміну речовин і некротизованих тканин, розсмоктує гематоми, нормалізує проникність судинних стінок, густину крові й тим самим поліпшує мікроциркуляцію. Препарат застосовують для лікування синуситу, бронхіту, бронхопневмонії, панкреатиту, виразкового коліту, хвороби Крона, розсіяного склерозу, ІХС, ревматоїдного артриту; Аспарагіназа виявляє антилейкемічну активність. Протипухлинний ефект зумовлений здатністю аспарагінази каталізувати гідроліз амінокислоти аспарагіну, необхідної лейкозним клітинам для їх розвитку: дефіцит аспарагіну впливає на клітинні мембрани, що істотно полегшує транспорт білків і поліпептидів крізь мембрани ракових клітин. Відомо, що клітини деяких злоякісних пухлин позбавлені здатності синтезувати аспарагін з інших сполук, оскільки в них відсутня аспарагінсинтетаза. Цитохром С — фермент, що бере участь у процесах тканинного дихання. Ферум, який міститься в його простетичній групі, зворотно переходить із окисненої форми у відновлену, у зв’язку з чим препарат прискорює перебіг окисних процесів. Препарат застосовують для поліпшення тканинного дихання при асфіксії новонароджених, астматичних станах, хронічній пневмонії, серцевій недостатності, ішемічній хворобі серця, інфекційному гепатиті, старечій дегенерації сітківки тощо. Велика група лікарських засобів належить до регуляторів активності ферментів, передусім до їх інгібіторів. Необхідність у них виникає досить часто, а саме: • у разі дефіциту фізіологічних інгібіторів, які виконують важливу для організму функцію — обмеження впливу ендогенних ферментів, а інколи — його захисту від ушкоджувальної дії чужорідних ферментів, зокрема мікробного походження; • під час введення з лікувальною метою ферментів у неадекватній дозі або в разі несприйняття введеного ферменту. Так, при передозуванні тромболітичних препаратів (фібринолізину), активаторів плазміну (стрептокінази, урокінази) застосовують інгібітори протеолізу (трасилол, амінокапронову кислоту тощо); • під час захворювань, у патогенезі яких певну роль відіграє гіперфункція ферментів, пов’язана з неадекватною їх активацією, аномальним викидом у кров і тканини (механічні, термічні й хімічні травми, інфекційна патологія, тромбози та емболії тощо); • під час змін ферментного спектра, при патологічному переважанні однієї ізоформи ферменту над іншою. У клінічній практиці з цією метою інгібітори широко використовують в онкології, оскільки пригнічення активності ферментів пухлинних клітин — один із відомих напрямів створення лікарських препаратів для терапії онкопатології; • у разі потреби викликати необхідну, найчастіше нефізіологічну, реакцію. На цьому принципі ґрунтується дія деяких регуляторів судинного тонусу (інгібіторів тих ферментів, які беруть участь в утворенні ангіотензину II або катехоламінів), активаторів метаболічних процесів у печінці, лікарських засобів, які пригнічують синтез простагландинів тощо. Інгібітори ферментів, потенційно придатні для застосування в терапії, досить поширені в природі, їх також можна отримувати шляхом синтезу. Більшість інгібіторів тваринного й рослинного походження, вивчені в експерименті чи клініці, є поліпептидами з молекулярною масою понад 5 000, тоді як мікробні інгібітори, як правило, мають невелику молекулярну масу. Інгібітори, виділені з рослин і мікроорганізмів, належать переважно до простих білків, а інгібітори тваринного походження часто містять у своєму складі вуглеводи. Наприклад, значна кількість інгібіторів протеаз тваринного походження є глікопротеїнами. Для деяких рослинних інгібіторів характерний низький уміст ароматичних амінокислот. Слід зазначити, що багато мікроорганізмів продукують хімічні сполуки, здатні впливати на ферментативні процеси в тканинах організмів тварин і людини. 3)Коферментні функції вітаміну К Коферментна форма: гідрохінонна форма
Вітамін К має група вітамерів — похідних 2-метил-1,4-нафтохінона. Розрізняють вітамін К1 (філохінон) та вітамін К2 (фарнохінон). ВітамінК1 є похідним 2-ме- тил-1,4-нафто- хінону, бічним вуглеводневим радикалом, у якому є похід- не ізопрену — фітил (2-ме- тил-3-фітил-1,4-нафтохінон). Цей вітамер був вперше виділений із люцерни і є біологічно найбільш ак- тивною формою вітаміну К. ВітамінК2має довший бічний ізо- преноїдний ланцюг, будучи за хіміч- ною будовою 2-метил-3-фарнезил- 1,4-нафтохіноном; вітамер був вперше виділений із рибного борошна. Біологічні властивості Біологічна дія вітаміну К в організмі людини і тварин полягає в його впливі на функціонування згортальної системи крові (“антигеморагічний” вітамін). Оскільки вітамін К є необхідним компонентом для утворення факторів коагуляції крові II, VII, IX, X, недостатність вітаміну супроводжується небезпечними для життя кровотечами. Біохімічні механізми прокоагулянтної дії вітаміну К роз- глянуті в главі 29. Гіповітаміноз вітаміну К у людини розвивається найчастіше при захворю- ваннях печінки та системижовчовивідних шляхів, які перешкоджають утворенню та/або надходженню в дванадцятипалу кишку жовчі, необхідної для всмоктування жиророзчинних речовин. При підвищеній активності згортальної системи крові нагальною проблемою клінічної практики є застосування антикоагулянтів, що за механізмом дії є антивітамінами вітаміну К (група похідних кумарину). А також g-карбоксилювання залишків глютамату Джерела та добова потреба Джерелами вітаміну К для організму людини є переважно рослинні продукти харчування (капуста, помідори, салат); певна кількість вітамінуміститься в печінці (особливо свиній), м’ясі. Значна кількість вітаміну синтезується такожкишковою мікрофлорою, що може забезпечити потреби організму людини в цьому вітаміні навіть в умовах зменшеного його надходження з продуктами харчування. Добова потреба у вітаміні К складає 200-300 мкг 4)Енергетичний баланс ЦТК. Механізми інгібування ЦТК фторацетатом та малонатом Біохімічний підсумок циклу трикарбонових кислот полягає в утворенні двох молекул СО2 (в ізоцитратдегідрогеназній та α-кетоглутаратдегідрогеназній реак- ціях) та чотирьох пар атомів водню, три з яких акцептуються НАД+ та одна — ФАД. Відновлені коферменти окислюються в дихальному ланцюзі мітохондрій, утворюючи за рахунок окисного фосфорилювання по 3 молекули АТФ на кожну молекулу НАДН і по 2 молекули АТФ на кожну молекулу ФАДН2. Крім того, одна молекула АТФ утворюється в субстратному фосфорилюванні при перетворенні сукциніл-КоА в сукцинат
Білет 12
|
|||||||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 2520; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.219.203 (0.013 с.) |


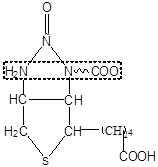 Карбоксибіотин
Карбоксибіотин