Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дегідрогенази, залежні від нікотинамідних коферментів (НАД(Ф)-залежні дегідрогенази).Содержание книги
Поиск на нашем сайте
Коферментами цих дегідрогеназ є нуклеотиди НАДабо НАДФ, у структурімолекул яких міститься похідне піридину — нікотинамід. Зв’язок між НАД(або НАДФ) та білковою частиною ферменту (апофер- ментом) у складі піридинзалежних дегідрогеназ нестійкий: він утворюється та руйнується в процесі каталітичного циклу, що дозволяє вважати нікотинамідні нуклеотиди скоріше субстратами, ніж простетичними групами. Активною структурою в молекулі НАДабо НАДФ, що акцептує віднов- лювальні еквіваленти від субстрату, є піридинове кільце никотинаміду. У ході ферментативної реакції субстрат відщеплює два атоми водню (2Н+ 2е), один з яких у формі гідрид-іону: Н(тобто Н + 2е) приєднується до піридинового кільцяНАД(Ф) ,а другий у вигляді протону (іону Н) надходить у реакційне середовище. НАД-залежні дегідрогенази — ці ферменти каталізують окислювально- відновлювальні реакції, що містяться на окислювальних шляхах метаболізму — гліколізу, циклу лимонної кислоти, -окислення жирних кислот, окисного дезамінування амінокислот, дихального ланцюга мітохондрій. НАДФ-залежні дегідрогенази — ці ферменти беруть участь у процесах від- новлювального синтезу, що відбуваються в цитозолі, зокрема постачають атоми водню при синтезі жирних кислот та стероїдів. Головним джерелом відновленого НАДФ є дегідрогеназні реакції пентозофосфатного шляху окислення глюкози. Флавінзалежні дегідрогенази. Дегідрогенази цього типу за хімічною природою є флавопротеїнами, просте- тичними групами, в яких є флавінаденіндинуклеотид (ФАД) та флавінмоно- нуклеотид (ФАД). На відміну від піридинзалежних дегідрогеназ, у більшості флавінзалежних ферментів коферменти (ФАД та ФМН) міцно зв’язані з білковою частиною і не відщеплюються від неї на жодній стадії каталітичного циклу. Виключенням є ФАД- залежна оксидаза D-амінокислот, у складі якої білок має низьку спорідненість із коферментом. У процесах біологічного окислення певні флавопротеїнові ферменти відігра- ють роль як анаеробних, так і аеробних дегідрогеназ. Флавопротеїни — анаеробні дегідрогенази: – НАДН-дегідрогеназа — ФМН-залежний компонент внутрішньої мембрани мітохондрій; виконує функцію колектора електронів, що забирає їх від НАДН і передає на більш електропозитивні компоненти дихального ланцюга мітохондрій; – сукцинатдегідрогеназа — ФАД-залежний фермент циклу трикарбонових кислот, що окислює янтарну кислоту; – дигідроліпоїлдегідрогеназа — ФАД-залежний фермент, що бере участь в окислювальному декарбоксилюванні піровиноградної кислоти; -окислення – ацил-КоА-дегідрогеназа — ФАД-залежний фермент системи жирних кислот; – гліцерол-3-фосфат-дегідрогеназа — ФАД-залежний фермент, що окислює гліцерол-3-фосфат у мітохондріях. Флавопротеїни — аеробні дегідрогенази: – дегідрогеназа (оксидаза) L-амінокислот — ФМН-залежний фермент нирок, специфічний до природних L-амінокислот; – ксантиноксидаза (ксантиндегідрогеназа) — ФАД-залежний фермент, який окислює пурини до сечової кислоти; – глюкозоксидаза — ФАД-залежний рослинний фермент, що використовується для кількісного визначення глюкози в біологічних рідинах. Цитохроми. Цитохроми — залізовмісні білки мітохондрій, що належать до класу гемо- протеїнів. У цитохромах іон заліза входить до складу металопорфіринового комплексу (гемінове залізо), близького за хімічною структурою до простетичних груп гемоглобіну та міоглобіну. За рахунок оберненої зміни валентності гемінового заліза цитохроми виконують функцію транспорту електронів у ланцюгах біологічного окислення в аеробних клітинах.
46. Дихальний ланцюг мітохондрій — сукупність молекулярних компонентів (ферментів та коферментів), які вбудовані в ліпідний матрикс внутрішніх міто-хондріальних мембран і здійснюють окислення біологічних субстратів та послі-довне, ступеневе транспортування відновлювальних еквівалентів на кисень з утворенням молекули води. Компоненти дихального ланцюга мітохондрій: НАДН-дегідрогеназа окислює відновлений НАД+ (НАДН); входить до складу молекулярного комплексу внутрішніх мітохондріальних мембран НАДН-коензимQ-редуктази. Сукцинатдегідрогеназа- окислюєянтарну кислоту; входить до складу молекулярного комплексу сукцинат-коензим Q-редуктази. Коензим Q (убіхінон) — ліпідорозчиннийхінон з ізопреноїднимбічнимланцюгом, виконуєфункціюколекторавідновлювальнихеквівалентів, Комплекси: 1) НАДН-коензим Q-редуктаза — ферментний,якийокислює НАДН і передаєвідновлювальніеквіваленти на коензим Q (убіхінон). 2) Сукцинат-коензимQ-редуктаза — ферментний комплекс (ФАД-залежнийфлавопротеїн), який окислює сукцинат, відновлюючи коензимQ.(комплекс ІІ) 3) КоензимQ-цитохромс-редуктаза (убіхінолдегідрогеназа) —ферментний комплекс транспортує електрони з відновленого коензимуQ (QН2) на цитохром с (комплекс ІІІ) 4 )Цитохром с-оксидаза —здійснює кінцеву стадію біологічного окислення — відновлення електронами молекулярного кисню. 47.Хеміосмотична теорія окисного фосфорилювання. Головний постулат Хеміосмотичної – спряження електронного транспорту в мітохондріях з біохімічною системою синтезу АТФ, здійснюеться за рахунок електрохімічного потенціалу протонів, що утв. під час функціонування електронотранспортного ланцюга. ХМ передбачає: 1. Функціонування дихального ланцюга у внутрішніх мембранах мітохондрій супроводжується генерацією на цих мембранах електрохімічного градієнта протонів. 2. Окремі компоненти електор. Трансп. Ланцюга діють як протонні помпи – спричиняють векторний транспорт протонів, спрямованих у між мембранний простір. 3. Електрохімічний потенціал протонів на спрягуючих мембранах, який створюється завдяки дії протонних помп, є рушійною силою синтезу АТФ з АДФ та Фн. 4. Існує ферментна система, що використовує енергію електрохімічного протонного потенціалу для синтезу АТФ за рахунок транс локації протонів у напрямку зовнішня поверхня -> матрикс. Ця ферментна система – АТФаза складається з субодиниць F0 і F1. 5. Фізичні, хімічні та біологічні фактори можуть пошкоджувати цілісність спрягаючи мембран мітохондрій та розсіюють енергію електрохімічного градієнта, порушують синтез АТФ, виступають як роз’єднувачі транспорту електронів та окисного фосфорилювання.
48 Окисне фосфорилювання: коефіцієнт окисного фосфорилю-вання, пункти поєднання окиснення та фосфорилювання. Роль бурої жирової тканини в термогенезі Кількість молекул неорганічного фосфату, яке перейшло у зв’язану форму (тобто у АТФ) у перерахунку на один атом кисню має назву коефіцієнт окисного фосфорилювання і позначається Р/O (коефіцієнт фосфорилювання). Коефіцієнт Р/O чисельно дорівнює кількості молекул АТФ, що синтезувалися в результаті транспорту 2 ē на один атом кисню. Тому для субстратів, що окислюються під дією НАД-залежних дегідрогеназ Р/O= 3 (наприклад, для пірувату). Для субстратів, які окислюються за допомогою ФАД-залежних дегідрогеназ, цей коефіцієнт дорівнює 2 (наприклад, для сукцинату, ацил-КоА, гліцерил-3-фосфату).Поєднання окиснення та фосфорилювання дозволяє пояснити чому окисне фосфорилювання на відміну від субстратного можливе лише в замкнутих мембранних структурах. Енергія, окрім синтезу АТФ може використовуватися клітиною для тр-ту метаболітів, руху, відновлення ферментів.В дих.ланцюгу є декілька ділянок, які називаються пунктами поєднання окиснення та фосфорилювання, зазвичай 3: НАД:убіхінон редуктаза; убіхінол: цитохром с редуктаза, цитохром с оксидаза. Кожен із пунктів спряження дихального ланцюга виділений у вигляді індивідуального ферментативного комплексу, який володіє окисно-відновлюваною активністю. Такий комплекс може функціонувати як протонний насос. 49 Регуляція тканинного дихання й окисного фосфорилювання. Дихальний контроль. Інгібітори та роз’єднувачі електронного транспорту й окисного фосфорилювання, їх біомедичне значення Певні хімічні сполуки здатні специфічним чином порушувати електронний транспорт (інгібітори електронного транспорту) та окисне фосфорилювання (інгібітори та роз’єднувачі окисного фосфорилювання) в мітохондріях. Дані сполуки взаємодіють з певними компонентами дихального ланцюга або систе- мами окисного фосфорилювання, порушуючи їх біохімічні функції. Інгібітори електронного транспорту Сполуки цього класу порушують функціонування дихального ланцюга міто- хондрій за рахунок зв’язування з окремими ферментними білками або кофермен- тами, що беруть безпосередню участь у переносі електронів від субстратів біо- логічного окислення на О2. При надходженні в організм людини або тварин ці речовини діють як клітинні отрути, спричиняючи феномен тканинної гіпоксії. Ротенон — інгібітор транспорту електронів через НАДН-коензим Q-редук- тазний комплекс. Ротенон застосовується як інсектицид. Амобарбітал (амітал) та близький до нього за структурою секобарбітал (секонал). Ці похідні барбітурової кислоти (барбітурати) застосовуються у фарма- кології як снодійні засоби. Разом з тим, барбітурати, подібно до ротенону, є активними інгібіторами клітинного дихання, блокуючи електронний транспорт на рівні НАДН-коензим Q-редуктази. Пієрицидин А — антибіотик, що також блокує НАДН-коензим Q-редуктазний комплекс за рахунок конкурентної взаємодії з убіхіноном. Антиміцин А — антибіотик, що блокує дихальний ланцюг мітохондрій на рівні переносу електронів через комплекс III (цитохром b — цитохром c1). Ціаніди (іони CN –) — потужні клітинні отрути, що є інгібіторами транспорту електронів на термінальній ділянці дихального ланцюга мітохондрій (у цито- хромоксидазному комплексі). Іони CN – утворюють комплекси з ферри (Fe3+) — формою молекул гему цитохромоксидази, блокуючи їх відновлення до ферро (Fe2+) — форм. Монооксид вуглецю (CO) — інгібірує цитохромоксидазу шляхом зв’язування з ділянкою гему, що взаємодіє з молекулою кисню Інгібітори окисного фосфорилювання Інгібітори окисного фосфорилювання блокують як окислення субстратів, так і фосфорилювання АДФ у мітохондріях. Олігоміцин — антибіотик, що протидіє як фосфорилюванню АДФ до АТФ, так і стимуляції поглинання О2, що спостерігається після додавання до мітохондрій АДФ (феномен “дихального контролю”). Механізм дії олігоміцину полягає в інгібі- руванні функції АТФ-синтетази. Роз’єднувачі окисного фосфорилювання Сполуки цього класу спричиняють “неконтрольоване” дихання мітохондрій, яке не залежить від функціонування системи фосфорилювання АДФ. В присут- ності роз’єднувачів спостерігається активне поглинання мітохондріями О2, незва- жаючи на зниження швидкості (або відсутність) генерації АТФ з АДФ та Фн. Згідно з хеміоосмотичною теорією, роз’єднувачі спричиняють втрату мембраною протонного потенціалу — рушійної сили генерації макроергічних зв’язків АТФ. До роз’єднувачів окисного фосфорилювання належать: – 2,4-динітрофенол та сполуки, близькі до нього за хімічною структурою (динітрокрезол, пентахлорфенол); – СССР (карбонілціанід-м-хлорфенілгідразон) — сполука, що в 100 разів пере- вищує за специфічною активністю 2,4-динітрофенол. Здатність роз’єднувати дихання та окисне фосфорилювання в мітохондріях мають також гормони щитовидної залози (тироксин, трийодтиронін).
50. Мікросомальне окиснення: цитохром P-450, молекулярна організація ланцюга. Основою монооксигеназного окиснення організму є цитохром P-450, який гідроксилює субстрати, такі як холестерол, лікарські речовини, ксенобіотики та ендогенні токсичні речовини. Окиснення за участю цитохрому P-450 має назву – мікросомальне окиснення, воно відбувається за участю електрон-транспортних ланцюгів, які містять білки переносники, що вбудовані в мембрани. Є два ланцюги: І – до складу входить два ферменти: НАДФН Н+ - цитохром P-450 редуктаза містить два коферменти ФАД та ФМН, які буруть участь у транспорті електронів з НАДФН Н+ на цитохром P-450. цитохром P-450 каталізує гідроксилювання субстратів. ІІ – містить фермент НАДН-цитохром b5 редуктазу та цитохром b5. Коферментом НАДН-цитохром b5 редуктази є ФАД, який бере участь у транспорті електронів з НАДН Н+ на цитохром b5. Наступним акцептором електронів може бути десатураза або цитохром P-450 цитохром. P-450 - гемопротеїн який може звязувати СО.
51 Активні форми кисню і механізми їх інактивації Активные формы кислорода (АФК, реактивные формы кислорода, РФК,англ. Reactive oxygen species, ROS) — включают ионы кислорода, свободные радикалы и перекиси как неорганического, так и органического происхождения. Это, как правило, небольшие молекулы с исключительной реактивностью благодаря наличию неспаренного электрона на внешнем электронном уровне. К активным формам кислорода (АФК) относятся супероксид (O2), синглетный кислород, Н2О2 ирадикал гидроксила (ОН'). В организме человека и животных первичным АФК служит супероксид, возникающий при одноэлектронном восстановлении молекулярного кислорода. Ферменты антиоксидантного действия К ферментам, защищающим клетки от действия активных форм кислорода, относят супе-роксиддисмутазу, каталазу и глутатионпероксидазу; Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико. Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода: 2О2 + 2H+ → H2O2 + O2 Изоферменты СОД находятся и в цитозоле и в митохондриях и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи. СОД - индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется перекисное окисление. Пероксид водорода, который может инициировать образование самой активной формы ОН•, разрушается ферментом каталазой: 2Н2О2 → 2 Н2О + О2.
52 Вуглеводи: визначення, класифікація. Будова, властивості, роль представників окремих класів. Вуглеводи (глюциди, цукри) — біоорганічні сполуки, що за своєю хімічною будовою є альдегідо- та кетопохідними багатоатомних спиртів. Вуглеводи утворюються в природі з діоксиду вуглецю та води за рахунок фотосинтезу, що протікає в рослинах та деяких мікроорганізмах, і складають основну массу органічного вуглецю біосфери; їх вміст у тканинах рослин становить близько 80 % маси. У свою чергу, рослинні вуглеводи є одним із основних джерел вуглецю для тваринних організмів. У тваринних організмах вміст вуглеводів відносно невисокий, становлячи в середньому 1-2 % сухої маси, в основному у вигляді резервного полісахариду глікогену. Вуглеводи відіграють життєво важливі енергетичні (важливі енергетичні субстрати), структурні (є у складі пентоз-нуклеїнові кислоти, олігосахариди-глікопротеїнів), пластичні(з проміжних продуктів метаболізму глюкози можуть синтезуватися ліпіди), детоксикаційні(знешкоджують ксенобіотики), антигенні(полісахариди плазматичної мембрани клітин) функції. Класи вуглеводів: 1. Моносахариди (прості вуглеводи) представлені одним полігідроксиальдегідом чи полігідроксикетоном з різною кількістю атомів корбону(гексози,пентози тощо). Представники – глюкоза, галактоза, фруктоза
Найбільш важливими з пентоз є рибоза і дезоксирибоза; тріоди, тетрози і гептози – це мінорні компоненти клітин, які виконують енергетичну і пластичну роль. 2. Олігосахариди – це вуглеводи, які скл. з 2 -10 моносахаридів, з’єднаних глікозидними зв’язками. Найбільше значення мають дисахаридя,так як лактоза(галактоза+глюкоза), сахароза(глюкоза+фруктоза,мальтоза(глюкоза+глюкоза)
Сахароза Мальтоза
Біологічна роль: важливі компоненти харчування, входять до складу глікопротеїнів мембран, що відповідають за процеси клітинного розпізнавання 3. Полісахариди – біополімери, які скл. з кількох тисяч мономерів. Поділяються на 2 групи: · Гомо полісахариди(повторюється мономер одного виду): крохмал, глікоген, целюлоза, у яких повторюється глюкоза,а також інсулін, декстрин,хітин. Основна роль - енергетична · Гетеро полісахариди – скл. з різних моносахаридів двух видів,тобто повт. Дисахарид. Мають значення глікозаміноглікани, у яких повт. Гексуронові кислоти і похідні гексозамінів. Роль: є у складі міжклітинного матрикса сполучної тканини, гепарин-антикоагулянт. 53. Анаеробне окиснення глюкози: послідовність реакцій, ферменти. Клінічні аспекти метаболізму глюкози в анаеробних умовах
54. Анаеробне окиснення глюкози: регуляція, реакції субстратного фосфорилювання, енергетичний ефект. Гліколітична оксидоредукція. Особливості метаболізму глюкози в еритроциті
55. Аеробне окиснення глюкози: етапи, енергетичний баланс. Човникові механізми окиснення гліколітичного НАДН. Ефект Пастера
56. Фосфоролітичний шлях розщеплення глікогену в печінці та м’язах. Регуляція активності глікогенфосфорилази. Генетичні порушення метаболізму глікогену
57. Біосинтез глікогену: ферментативні реакції, фізіологічні значення. Регуляція активності глікогенсинтази
58. Механізми реципрокної регуляції глікогенолізу та глікогенезу. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну глікогену в м’язах і печінці
59. Глюконеогенез: субстрати, ферменти та фізіологічне значення процесу. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикл. Субстраты: лактат, пируват, оксалоацетат и другие промежуточные продукты ЦЛК(кроме цитрата), глицерол, гликогенные аминокислоты(кроме лейцина). Биологическая роль: обеспечивает организм глюкозой при патологиях и состояних которые приводят к гипогликемии или увеличении потребности тканей в глюкозе; утилизация лактата, который образуется при работе скелетных мышц и является метаболическим шлаком. Ключевые ферменты: пируваткарбоксилаза, ФЕПкарбоксилаза, фруктозо-1,6-дифосфатаза, глюкозо-6-фосфатаза. Глюкозо-лактатний цикл: Мышцы кров Печень глюкоза глюкоза пируват пируват Лактат Лактат Глюкозо-аланиновый цикл: Глюкоза мышц глюкоза печени Пируват мышц пируват печени Аланын мышц аланин печени
60. Пентозо-фосфатний шлях окиснення глюкози: схема процесу, біологічне значення, регуляція, порушення процесу. Биологическая роль: востановление НАДФ, образование рибозо-5-фосфатаза. Регуляция: при повышении концентрации НАДФ ПФП активируется.
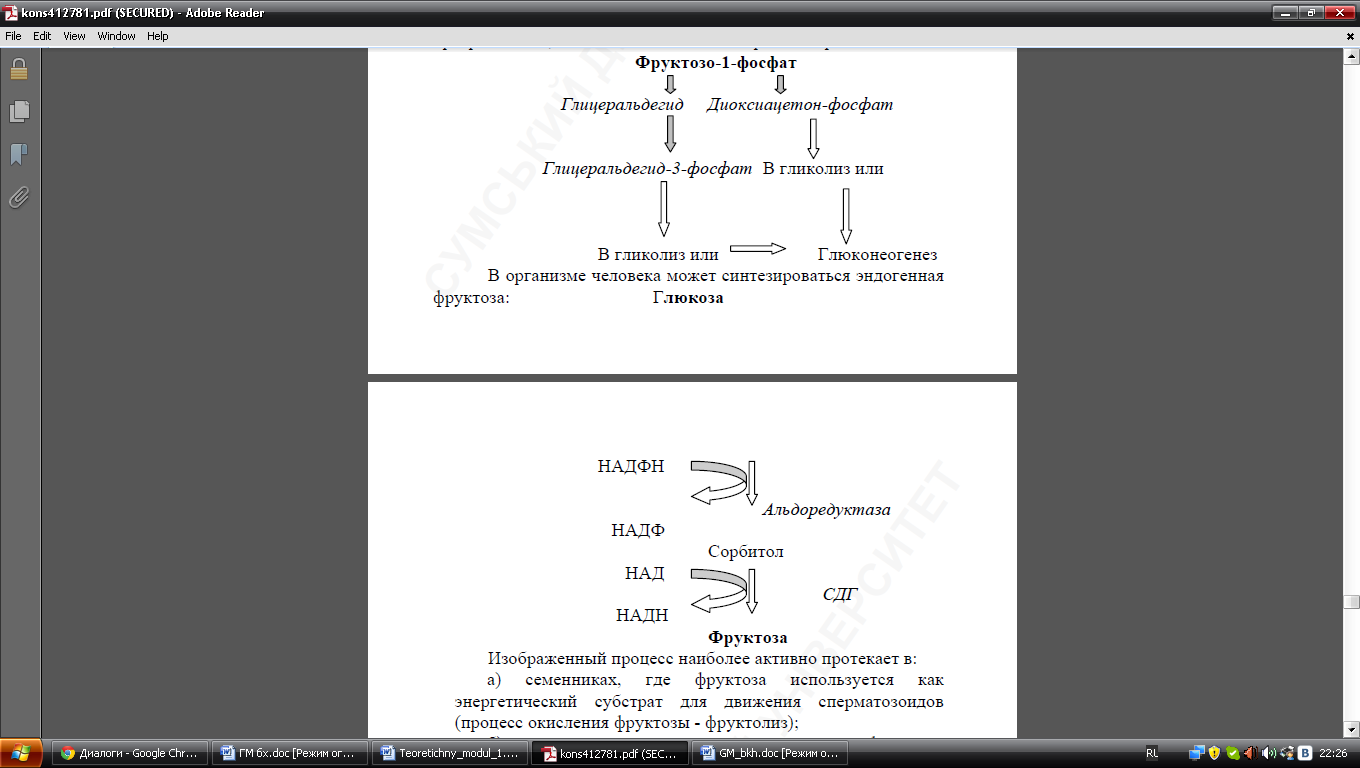
61. Метаболічні шляхи перетворення фруктози: спадкові ензимопатії її обміну. Фруктоза входит в состав пищевих продуктов как самостоятельный моносахарид, так и как компонент дисахарида сахарозы, которая гидролизируется в кишечнике. Прием большого количества может визвать снижение уровня адениловых нуклеотидов в печени и привести к некротическому поражению этого органа. В орг человека может синтезироваться эндогенная фруктоза. Энзимопатии:непереносимость фруктозы, фруктоземия
62. Метаболічні шляхи перетворення галактози: спадкові ензимопатії її обміну. Глюкоза поступает в организм в основном в составе молочного сахара – лактозы, которая под действием лактазы кишечного сока расщепляетсядо галактозы и глюкозы. Ензимопатии: галактоземия(недостаточность галактозо-1-фосфотуридилтрансферазы).
63. Окиснювальне декарбоксилювання пірувату: реакції, регуляція, клінічні аспекти.
64. Метаболізм вуглеводних компонентів глікокон’югатів: синтез О- та N-зв’язаних глікопротеїнів. Генетичні порушення метаболізму глікокон’югатів.
65. Механізми регуляції концентрації глюкози в крові. Порушення обміну вуглеводів при цукровому діабеті. Рівень глюкози в крові варіює в залежності від прийому їжі. Після їжі цукор крові завжди трохи підвищується, а потім нормалізується протягом кількох годин. Підвищення рівня глюкози в крові після їди дає сигнал до виділення інсуліну - гормону підшлункової залози, що сприяє засвоєнню глюкози клітинами організму і зниження її концентрації в крові. Інсулін також сприяє утворенню запасів глюкози в печінці у вигляді глікогену. Паралельно зі зниженням рівня глюкози в крові виділення інсуліну зменшується. Цукровий діабет — це х ронічне ендокринно-обмінне захворювання, зумовлене абсолютною (порушення утворення) або відносною (порушення дії) недостатністю інсуліну внаслідок дії різноманітних ендогенних (генетичних) та екзогенних факторів, яке супроводжується порушенням усіх видів обміну речовин, у першу чергу, вуглеводного з найбільш характерним його проявом – гіперглікемією, ураженням різних органів і тканин, у першу чергу, судин та нервів. 66. Загальна характеристика ліпідів: будова, функції представників окремих класів. Жирні кислоти, будова, роль. Ліпіди – біоорганічні сполуки різноманітного походження і структури, нерозчинні у воді, але розчинні у неполярнихорганічних розчинниках - хлороформі, тетрахлор-метані, діетиловому ефірі та ін. Основні функції ліпідів у організмі людини: · Енергетична – ліпіди використовуються як ефективне джерело енергії і здатні утворювати резерви енергетичного матеріалу в жировій тканині. · Структурна – ліпіди є компонентами зовнішніх і внут-рішніх клітинних мембран, зумовлюють їх властивості та впливають на функції. · Регуляторна – окремі класи ліпідів (вітаміни, гормони), як фізіологічно активні речовини, регулюють метаболічні процеси в клітинах. · Резервна – на відміну від вуглеводів, здатність ліпідів до накопичення необмежена. Вони депонуються переважно у жировій тканині. · Транспортна - транспортні форми ліпідів – ліпопротени - перерозподіляють ліпіди між органами і тканинами організму. · Бар¢єрна - ліпіди створюють бар¢єр, який захищає організм від термічного і механічного впливу.
Жирні кислоти – аліфатичні карбонові кислоти. У організмі можуть знаходитися у вільному вигляді (сліди) або є структурними компонентами різних класів ліпідів. Властивості, структура: · ВЖК виявляють амфіфільні властивості (містять одну гідрофільну карбоксильну групу і гідрофобний вуглеводневий ланцюг. · Подвійний зв¢язок частіше розташований між 9-м і 10-м атомами вуглецю. Додаткові подвійні зв¢язки, як правило, знаходяться на ділянці між 11-м атомом вуглецю і метильним кінцем ланцюга. У природних ненасичених жирних кслотах подвійні зв¢язки завжди “ізольовані”, тобто відділені двома простими зв¢язками через метиленові групи: (-СН = СН – СН2 – СН = СН-) · Природні ненасичені жирні кислоти мають переважно цис-конфігурацію, що призводить до вигину та вкорочення вуглецевого ланцюга. Поліненасичені жирні кислоти мають декілька вигинів, і їх молекули характеризуються значною жорсткістю, на відміну від насичених жирних кислот, в яких атоми вуглецю вільно обертаються навколо одинарних зв'язків, характеризуються більшою гнучкістю і довжиною. · Такі особливості структури насичених і ненасичених жирних кислот впливають на будову та властивості мембран, до складу яких вони входять. 67. Катаболізм ТАГ у жировій тканині: послідовність реакцій, механізми регуляції активності ТАГ-ліпази. – Схема реакцій ліполізу
ТАГ1 ДАГ2 МАГ3 гліцерол + ЖК Н2О R1COOH Н2О R2COOH Н2О R3COOH Позначення: 1- триацилгліцеролліпаза (ТАГ-ліпаза); 2 – диацилгліцеролліпаза(ДАГ-ліпаза); 3 – моноацилгліцеролліпаза (МАГ-ліпаза); ТАГ – триацил-гліцерол; ДАГ – диацилгліцерол; МАГ – моноацилгліцерол; ЖК – жирна кислота. Молекулярною основою регуляції активності ТАГ-ліпазиадипоцитів є її ковалентна модифікація (обернене фосфорилю-вання-дефосфорилювання). Каталітично активною є фосфори-льована форма ТАГ-ліпази, дефосфорильована - неактивна. 68.Нейрогуморальна регуляція ліполізу. · Катехоламіни (адреналін, норадреналін), глюкагон - активують ліполіз за рахунок стимуляції цАМФ-залежної каскадної системи і активації ТАГ-ліпазиадипоцитів.Ліполітична дія катехоламінів реалізується при фізичному напруженні, стресі,зниженні температури навколишнього середовища. Дія глюкагону проявляється при зменшеннінадходження глюкози через шлунково-кишковий трактабо посиленні використання її тканинами. За рахунок дії катехоламінів та глюкагону відбувається швидка активація ліполізу в жировій тканині та мобілізація НЕЖК, що забезпечує підвищені енергетичні потреби організму за умов стресу або голодування. · Інсулін інгібуєліполіз і вивільнення ЖК ізадипоцитівза рахунок двох біохімічних механізмів: а) зменшення концентраціїцАМФ через активаціюфосфодіесте- рази цАМФ; б) підвищення проникності мембран адипоцитів до глюкози, що приводить до активації гліколізу і ліпогенезуз продуктів метаболізму глюкози. · Соматотропін - активує ліполіз у жировій тканині при голодуванніза рахунок підвищення синтезу відповідних ферментних білків. Метаболічні ефекти соматотропіну розвиваються повільно. 69. Реакції окиснення жирних кислот (β-окиснення), роль карнітину в транспорті жирних кислот у мітохондрії. Стадії окиснення: 1Активація ЖК відбувається в цитозолі клітин за участю специфічних ацил-КоА-синтетаз (тіокіназ), що утворюють КоА-похідні жирних кислот: R-СООН + КоА-SН + АТФ ®R-СО-S-КоА + АМФ + ФФн Жирна кислота Ацил-КоА 2 Транспорт ЖК через мембрану мітохондрій: Ферменти b-окисненнялокалізовані всередині мітохондрій.Внутрішня мітохондріальна мембрана непроникна для довго- ланцюгових ацил-КоА. На внутрішній мітохондріальній мембрані функціонує спеціальна човникова транспортна система, яка містить аміноспирт карнітин, що переносить молекули ацил-КоА до матриксу мітохондрій.
(СНз)зN+-СН2-СН-СН2-СООН │ ОН На внутрішній мітохондріальній мембрані функціонує спеціальна човникова транспортна система, яка містить аміноспирт карнітин, що переносить молекули ацил-КоА до матриксу мітохондрій.
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 1084; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.89.152 (0.012 с.) |


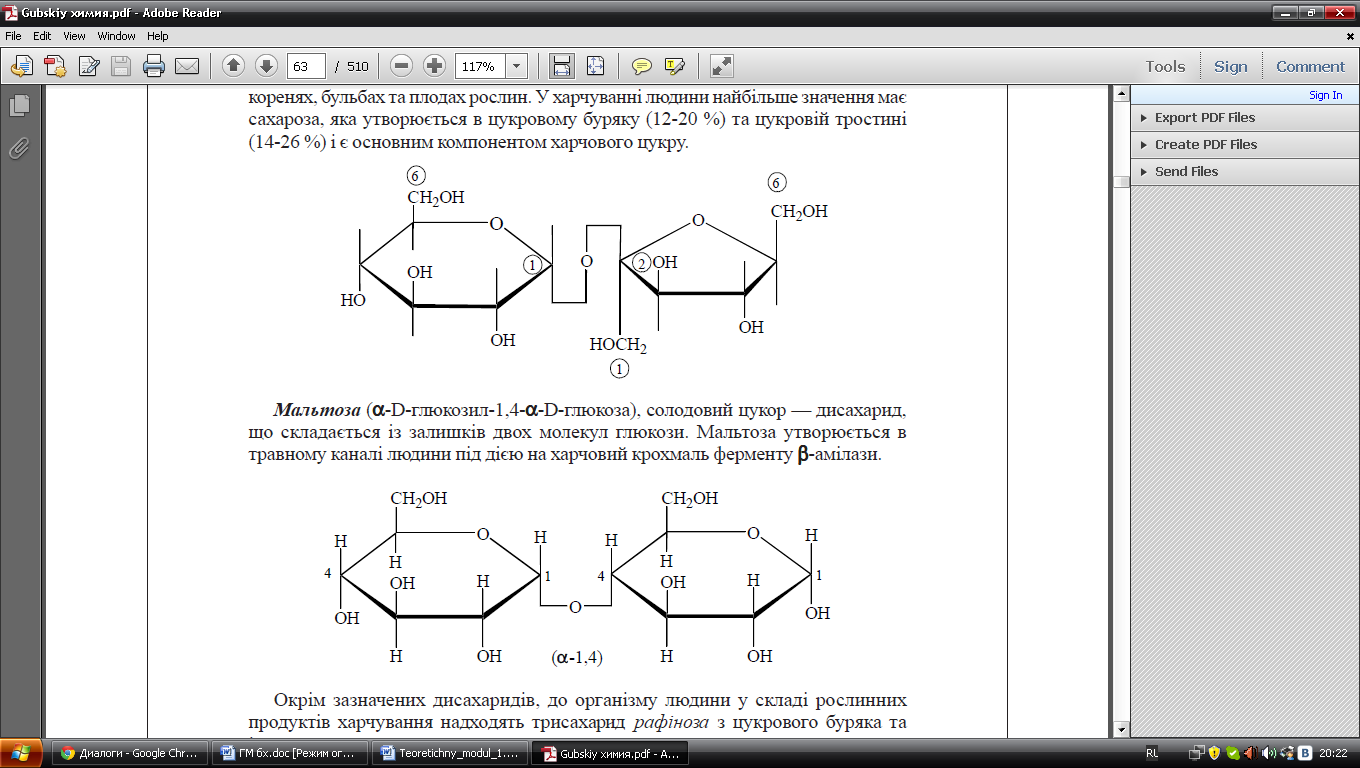
 Лактоза
Лактоза