
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Завдання 6. Кінетика. РівновагаСодержание книги
Поиск на нашем сайте
6.1. Виразіть математично швидкість нижченаведених реакцій, що протікають у однорідному середовищі: а) А+В
6.2. Виразіть математично швидкість таких реакцій:
а) СО+C1 б) N2+O2
6.3. Виразіть математично швидкість таких реакцій:
а) 2NO+O2 б) N2+3H2
6.4. Швидкість реакції А+2В [В] = 0,6 моль/л дорівнює 0,018 моль/л×хв. Визначте константу швидкості. 6.5. Константа швидкості реакції 2А+В 6.6. Температурний коефіцієнт швидкості реакції дорівнює 2,5. При якій температурі треба проводити реакцію для зниження її швидкості у 10 разів (початкова температура 50 °С)? 6.7. Швидкість деякої реакції при охолодженні системи з 60 до 30 °С зменшилася у 8 разів. Визначте температурний коефіцієнт швидкості цієї реакції. 6.8. Швидкість реакції при нагріванні на 20 °С зросла у 9 разів. Визначте температурний коефіцієнт швидкості реакції. 6.9. Обидві реакції при 10 °С протікають з однаковою швидкістю (v 1 = v 2). Температурний коефіцієнт швидкості першої реакції дорівнює 2, а другої – 3. Як будуть співвідноситися швидкості реакцій, якщо першу з них провести при 50 °С, а другу – при 30 °С? 6.10. У скільки разів збільшиться швидкість хімічної реакції при підвищенні температури на 30 °С, якщо температурний коефіцієнт швидкості дорівнює а) 1,5; б) 2,0; в) 3,0. 6.11. Як впливатиме зменшення тиску на рівновагу реакцій, що протікають у газовому середовищі:
а) А+2В
6.12. Як впливатиме зменшення тиску на рівновагу реакцій, що протікають у газовому середовищі:
а) А2+В2
6.13. Як впливатиме підвищення тиску на рівновагу наступних оборотних реакцій, що протікають у газовому середовищі:
а) H2+I2 г) Н2+СО2
6.14. Яким чином впливатиме підвищення тиску на рівновагу оборотних реакцій, що протікають у гетерогенній системі:
а) СаСО3 (т) б) Na2CO3(т ) +Н2О+СО2 в) H2SO4(р)+NH3 6.15. У який бік зміститься рівновага при зниженні температури оборотних реакцій (
а) А+В б) В+С–
6.16. Напишіть формули константи рівноваги оборотних реакцій, що протікають у гомогенному середовищі:
а) 2А+В г) mA+nD
6.17. Напишіть константи рівноваги оборотних реакцій:
а) 2NO+O2
6.18. Напишіть константи рівноваги оборотних реакцій:
а) СО + C12
6.19. Реакція протікає за рівнянням А2+В2
[А] = 0,2 моль/л, [В] = 0,3 моль/л, [АВ] = 0,25 моль/л.
6.20. Реакція протікає за рівнянням А+В [А]р = 0,4 моль/л, [С]р = 0,2 моль/л, [D]р = 0,1 моль/л.
6.21. Реакція протікає за рівнянням А+В 6.22. Реакція протікає за рівнянням 2А 6.23. При синтезі амоніаку за певних умов у рівновазі знаходяться 1 моль водню, 2 моля Нітроґену і 8 молей амоніаку. У скільки разів вихідні кількості Нітроґену і водню більші за їх рівноважні кількості? 6.24. Рівновага реакції H2+Br2
[Н2] = 0,5 моль/л; [Br2] = 0,1 моль/л; [НBr] = 1,6 моль/л.
Визначте вихідні концентрації [Н2] і [Br2]. 6.25. При синтезі фосгену має місце рівновага реакції C12+СО
[C12] = 0,2 моль/л; [CО] = 0,1 моль/л; [СОC12] = 2 моль/л.
6.26. Напишіть вирази швидкостей таких хімічних реакцій:
а) 4NH3+ 3O2
6.27. У скільки разів збільшиться швидкість хімічної реакції С(т)+2Н2 = СН4, якщо збільшити концентрацію водню вдвічі? 6.28. На скільки градусів треба підвищити температуру, щоб швидкість реакції збільшилась у 81 раз, якщо температурний коефіцієнт швидкості дорівнює 3? 6.29. Визначте, як зміниться швидкість прямої реакції 2SO2+O2 6.30. Напишіть вирази константи рівноваги для таких реакцій:
а) С(т)+СО2
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 448; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.005 с.) |

 АВ; б) А+2В
АВ; б) А+2В  [А] = 0,5 моль/л і
[А] = 0,5 моль/л і АВ2; б) 2А+2В
АВ2; б) 2А+2В 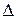 Нх.р – тепловий ефект):
Нх.р – тепловий ефект):


