
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розділ 11. Контрольні завданняСодержание книги
Поиск на нашем сайте
Розділ 11. КОНТРОЛЬНІ ЗАВДАННЯ
Завдання 1. Атомно-молекулярна теорія 1.1. 0,56 л кисню взаємодіють з 1,2 г двовалентного металу. Обчисліть еквівалентну і молярну масу його. 1.2. На нейтралізацію 0,336 г кислоти витрачається 0,292 г натрій гідроксиду. Обчисліть еквівалентну масу кислоти. 1.3. Однакова кількість металу взаємодіє з 0,2 г кисню і з 3,2 г галогену. Обчисліть еквівалентну масу галогену. 1.4. Хлорид металу містить 36% металу і 64% хлору. Визначте еквівалентну масу металу. 1.5. Оксид тривалентного елемента містить 31,58% кисню. Обчисліть значення молярної маси елемента. 1.6. Визначте об'єм 5,3 еквівалентів кисню при н.у. 1.7. При взаємодії 0,121 г металу з кислотою виділилося 0,112 л водню (н.у.). Визначте еквівалентну масу металу. 1.8. Який приблизно об’єм (н.у.) займуть 2,41∙1025 молекул хлору і така сама кількість молекул карбон (IV) оксиду? 1.9. Сульфід двовалентного металу містить 67,1% металу. Визначте молярну масу металу. 1.10. Визначте об'єм водню, витрачений на відновлення 2,5 г цинк оксиду за н. у. 1.11. При спалюванні 1,534 г шестивалентного металу витрачено 280 мл кисню (н. у.). Визначте молярну масу металу. 1.12. Обчисліть густину за воднем таких газів: а) хлороводню НCl; б) сірководню Н2S; в) амоніаку NH3. 1.13. Для розчинення 16,8 г металу потрібно 14,7 г сульфатної кислоти. Визначте еквівалентну масу металу та об'єм водню, що виділився. 1.14. Арсен сульфід містить 38% сірки. Еквівалентна маса сірки дорівнює 16 г/моль. Обчисліть еквівалентну масу і валентність арсену. 1.15. Обчисліть масу 80 молекул натрій силікату в г й а.о.м. 1.16. Визначте об'єм 20 еквівалентів водню при н.у. 1.17. При розчиненні 4,8 г металу виділилося 2,694 л водню (н. у.). Визначте еквівалентну масу металу. 1.18. Газоподібна сполука Нітроґену з Гідрогеном містить 12,5% (мас.) Гідрогену. Густина сполуки за воднем дорівнює 16. Знайдіть молекулярну формулу сполуки. 1.19. При спалюванні 0,511 г тривалентного металу витрачено 100 мл кисню (н. у.). Визначте молярну масу металу. 1.20. Однакова кількість металу взаємодіє з 0,6 г кисню і з 9,6 г галогену. Обчисліть еквівалентну масу галогену. 1.21. У якій кількості речовини сірки (ІV) оксиду вміщується така сама кількість атомів сірки, що й у піриті FeS масою 24 г? 1.22. При з’єднанні 5,6 г феруму з сіркою утворилося 8,8 г ферум (ІІ) сульфіду. Знайдіть еквівалентну масу феруму, якщо еквівалентна маса сірки 16 г/моль. 1.23. Яка формула поташу, якщо масовий склад цієї речовини становить: К – 56,6%; С – 8,7%; О – 34,8%. 1.24. Обчисліть масову частку вуглецю у кальцій карбіді CaC2. 1.25. 1,355 г ферум (ІІІ) хлориду взаємодіє без залишку з 1 г натрій гідроксиду, еквівалентна маса якого дорівнює 40 г/моль. Визначте еквівалентну масу феруму. 1.26. Скільки атомів уміщується в 17 г хрому? 1.27. Скільки молекул йоду вміщується у 50,8 г I2? 1.28. Який об’єм нітроген (ІІ) оксиду утворюється при взаємодії 5∙1020 молекул Нітроґену з киснем? 1.29. Скільки молей складають 4,8 г водень флуориду? 1.30. Який об’єм за н.у. займають 2,7∙1022 молекул газу?
Завдання 2. Будова атома
2.1. Що таке квантові числа? Які значення вони можуть приймати? 2.2. Складіть електронні й електронно-графічні формули атомів елементів з порядковими номерами 16 і 22. 2.3. Напишіть електронні формули атомів елементів з порядковими номерами 9 і 28. Розподіліть електрони цих атомів по квантових осередках. До якого електронного сімейства належить кожен з цих елементів? 2.4. Напишіть електронні формули атомів фосфору і ванадію. Розподіліть електрони цих атомів по квантових осередках. До якого електронного сімейства належить кожен з цих елементів? 2.5. Яке максимальне число електронів може знаходитися на s-, p-, d- і f-орбіталях даного енергетичного рівня? Чому? 2.6. Напишіть електронні формули атомів марганцю і селену. До якого електронного сімейства належить кожен з цих атомів? 2.7. Які орбіталі атома заповнюються електронами раніш: 4s або 3d; 4s або 4p? Чому? Складіть електронну формулу атома елемента з порядковим номером 21. 2.8. Складіть електронні формули атомів елементів з порядковими номерами 17 і 29. В останнього відбувається провал одного 4s-електрона на 3d-підрівень. До якого електронного сімейства належить кожен з цих елементів? 2.9. Які орбіталі атома заповнюються електронами раніш: 4d або 5s; 6s або 4p? Чому? Складіть електронну формулу атома елемента з порядковим номером 43. 2.10. Що таке ізотопи? Чим можна пояснити, що в більшості елементів періодичної системи атомні маси виражаються дробовим числом? Чи можуть атоми різних елементів мати однакову масу? Як називаються подібні атоми? 2.11. У чому сутність a-, 2.12. Складіть електронні формули атомів елементів з порядковими номерами 14 і 40. Які електрони цих атомів є валентними? 2.13. Яку радіоактивність називають штучною? Ізотоп якого елемента утвориться в результаті ядерної реакції, що відбувається при бомбардуванні ядер 2.14. Складіть електронні формули атомів елементів з порядковими номерами 16 і 28. До якого електронного сімейства належить кожен з цих елементів? 2.15. Ізотоп якого елемента утвориться в результаті ядерної реакції, що відбувається при бомбардуванні ядер 2.16. Скільки і які значення може приймати магнітне квантове число ml при орбітальному квантовому числі l = 0; 1; 2 і 3? Які елементи в періодичній системі називаються s-, p-, d- і f-елементами?Наведіть приклади. 2.17. Які значення можуть приймати квантові числа n, l, ml і ms, що характеризують стан електронів у атомі? Які значення вони приймають для зовнішніх електронів атома магнію? 2.18. Чим відрізняється послідовність у заповненні атомних орбіталей в атомах d-елементів від послідовності заповнення їх в атомах s - і p - елементів? Складіть електронну формулу атома елемента з порядковим номером 46 з огляду на те, що, знаходячись у п'ятому періоді, атоми цього елемента на п'ятому енергетичному рівні не містять жодного електрона. 2.19. Складіть електронні формули атомів елементів з порядковими номерами 24 і 33 з огляду на те, що в першому відбувається провал одного 4s-електрона на 3d-підрівень. До якого електронного сімейства належить кожен з цих елементів? 2.20. Значення якого квантового числа визначає кількість s-, p - і d-електронів у атомі кобальту? 2.21. У чому полягає принцип Паулі? Чи може бути на якомусь підрівні атома p7 - або d12 - електронів? Чому? Складіть електронну формулу атома елемента з порядковим номером 22 і визначте його валентні електрони. 2.22. Складіть електронні формули атомів елементів з порядковими номерами 32 і 42 з огляду на те, що в останнього відбувається провал одного 5s-електрона на 4d-підрівень. До якого електронного сімейства належить кожен з цих елементів? 2.23. У природних сполуках хлор знаходиться у вигляді ізотопів 2.24. Природний магній складається з ізотопів 2.25. Природний галій складається з ізотопів 2.26. Складіть повні рівняння реакцій радіоактивного розпаду: а) ж) 2.27. Який тип радіоактивного розпаду спостерігається при таких перетвореннях: а) г) 2.28. Як змінюються масове число і заряд атома ізотопу: а) при послідовному випусканні однієї a-частинки і двох b-частинок; б) при поглинанні ядром двох протонів і випусканні двох нейтронів; в) при поглинанні однієї a-частинки і викиданні двох нейтронів? 2.29. Скільки a- і b-частинок повинно було загубити ядро
Д.І. Менделєєва
3.1 Побудуйте графік залежності енергії іонізації від атомного номера для елементів головної підгрупи першої групи періодичної системи. Встановіть закономірність. 3.2. Як змінюється відновлювальна активність s - елементів у групах періодичної системи зі збільшенням порядкового номера? Чому? 3.3. Як змінюється відновлювальна активність p - елементів у групах періодичної системи зі збільшенням порядкового номера? Чому? 3.4. Якому елементу притаманні найбільш металеві властивості? 3.5. Побудуйте графік залежності електронегативності від атомного номера для елементів головної підгрупи п'ятої групи періодичної системи. Встановіть закономірність. 3.6. Як змінюється електронегативність p - елементів у періоді зі збільшенням порядкового номера? 3.7. Як змінюється електронегативність p - елементів у групі періодичної системи зі збільшенням порядкового номера? 3.8. Який елемент має найбільш високе значення електронегативності? Чому воно дорівнює? 3.9. Значення спорідненості до електрону атомів Берилію, Карбону, Оксигену та Флуору відповідно: +2,5 еВ, –1,27 еВ, –1,47 еВ, –3,34 еВ. Як зміниться спорідненість до електрону для елементів ІІ періоду? Чим це пояснюється? Побудуйте графік залежності спорідненості до електрону від атомного номера. 3.10. Який з елементів четвертого періоду - Ванадій або Арсен – має більш виражені неметалеві властивості? 3.11. У якого елемента четвертого періоду - Хрому або Селену – сильніше виражені металеві властивості? 3.12. Енергія, необхідна для видалення електрона з іона P4+, дорівнює 6270 кДж/моль, тоді як для видалення електрона з іона Si4+ потрібна енергія 16100 кДж/моль. Поясніть причину такої великої розбіжності. 3.13. Складіть формули оксидів і гідроксидів елементів третього періоду періодичної системи, що відповідають їх найвищім ступеням окиснення. Як змінюється хімічний характер цих сполук при переході від Натрію до Хлору? 3.14. Гідроксид елемента, що розташований у 4-му періоді ІІ групи, реагує з кислотою, яку утворив елемент, розташований у 3-му періоді VІІІ групи. Напишіть рівняння реакції в іонному та молекулярному вигляді. 3.15. Виходячи з положення металу в періодичній системі, дайте мотивовану відповідь на питання: який з двох гідроксидів є більш сильною основою – Ba(OH)2 або Mg(OH)2; Ca(OH)2 або Fe(OH)2; Cd(OH)2 або Sr(OH)2? 3.16. Який найнижчий і найвищий ступінь окиснення виявляють Карбон, Фосфор, Сульфур і Йод? Чому? Складіть формули сполук даних елементів, що відповідають цим ступеням окиснення. 3.17. Які елементи мають більш виражені неметалеві властивості? Вкажіть їх положення у періодичній системі. 3.18. Як змінюється стійкість вищих оксидів і гідроксидів у головних та побічних підгрупах із зростанням заряду атомних ядер елементів. Наведіть приклади. 3.19. Які хімічні властивості має штучно отриманий елемент із порядковим номером 87? З яким із елементів періодичної системи він найбільш схожий? 3.20. Чим пояснюється відмінність властивостей елементів 2-го періоду від властивостей їх електронних аналогів у наступних періодах? 3.21. З яким елементом більш схожий Молібден за властивостями – з Селеном чи з Хромом? Чим це пояснюється? 3.22. За яким принципом елементи об’єднуються в групи та підгрупи?
Розділ 11. КОНТРОЛЬНІ ЗАВДАННЯ
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 454; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.170.196 (0.009 с.) |


 b- і b+-радіоактивного розпаду? Ізотоп якого елемента утвориться в результаті послідовного випромінювання 4a- і 2b- частинок атомним ядром
b- і b+-радіоактивного розпаду? Ізотоп якого елемента утвориться в результаті послідовного випромінювання 4a- і 2b- частинок атомним ядром 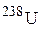 ?
?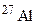 атомів протонами, якщо при цьому поглинається один протон і виділяється одна a-частинка? Складіть рівняння цієї ядерної реакції.
атомів протонами, якщо при цьому поглинається один протон і виділяється одна a-частинка? Складіть рівняння цієї ядерної реакції.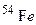 атомів a-частинками, якщо при цьому поглинається одна a-частинка і виділяється один нейтрон. Складіть рівняння цієї ядерної реакції.
атомів a-частинками, якщо при цьому поглинається одна a-частинка і виділяється один нейтрон. Складіть рівняння цієї ядерної реакції. [75,5% (мас.)] і
[75,5% (мас.)] і 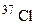 [24,5% (мас.)]. Обчисліть середню атомну масу природного хлору.
[24,5% (мас.)]. Обчисліть середню атомну масу природного хлору.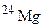 ,
, 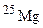 і
і 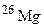 . Обчисліть середню атомну масу природного магнію, якщо вміст окремих ізотопів у атомних відсотках відповідно дорівнює 78,6; 10,1 і 11,3.
. Обчисліть середню атомну масу природного магнію, якщо вміст окремих ізотопів у атомних відсотках відповідно дорівнює 78,6; 10,1 і 11,3.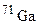 і
і 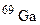 . У якому кількісному співвідношенні знаходяться між собою числа атомів цих ізотопів, якщо середня атомна маса галію дорівнює 69,72?
. У якому кількісному співвідношенні знаходяться між собою числа атомів цих ізотопів, якщо середня атомна маса галію дорівнює 69,72?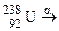 ; б)
; б) 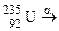 ; в)
; в) 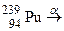 ; г)
; г) 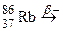 ; д)
; д) 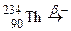 ; е)
; е) 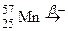 ;
;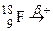 . Зазначте випадки, коли дочірній атом є ізобаром материнського атома.
. Зазначте випадки, коли дочірній атом є ізобаром материнського атома.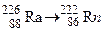 ; б)
; б) 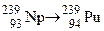 ; в)
; в)  ;
;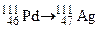 ?
?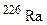 для одержання дочірнього елемента з масовим числом 206, що належить IV групі періодичної системи елементів? Назвіть цей елемент.
для одержання дочірнього елемента з масовим числом 206, що належить IV групі періодичної системи елементів? Назвіть цей елемент.


