
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Завдання 1. Атомно-молекулярна теоріяСодержание книги
Поиск на нашем сайте
1.1. 0,56 л кисню взаємодіють з 1,2 г двовалентного металу. Обчисліть еквівалентну і молярну масу його. 1.2. На нейтралізацію 0,336 г кислоти витрачається 0,292 г натрій гідроксиду. Обчисліть еквівалентну масу кислоти. 1.3. Однакова кількість металу взаємодіє з 0,2 г кисню і з 3,2 г галогену. Обчисліть еквівалентну масу галогену. 1.4. Хлорид металу містить 36% металу і 64% хлору. Визначте еквівалентну масу металу. 1.5. Оксид тривалентного елемента містить 31,58% кисню. Обчисліть значення молярної маси елемента. 1.6. Визначте об'єм 5,3 еквівалентів кисню при н.у. 1.7. При взаємодії 0,121 г металу з кислотою виділилося 0,112 л водню (н.у.). Визначте еквівалентну масу металу. 1.8. Який приблизно об’єм (н.у.) займуть 2,41∙1025 молекул хлору і така сама кількість молекул карбон (IV) оксиду? 1.9. Сульфід двовалентного металу містить 67,1% металу. Визначте молярну масу металу. 1.10. Визначте об'єм водню, витрачений на відновлення 2,5 г цинк оксиду за н. у. 1.11. При спалюванні 1,534 г шестивалентного металу витрачено 280 мл кисню (н. у.). Визначте молярну масу металу. 1.12. Обчисліть густину за воднем таких газів: а) хлороводню НCl; б) сірководню Н2S; в) амоніаку NH3. 1.13. Для розчинення 16,8 г металу потрібно 14,7 г сульфатної кислоти. Визначте еквівалентну масу металу та об'єм водню, що виділився. 1.14. Арсен сульфід містить 38% сірки. Еквівалентна маса сірки дорівнює 16 г/моль. Обчисліть еквівалентну масу і валентність арсену. 1.15. Обчисліть масу 80 молекул натрій силікату в г й а.о.м. 1.16. Визначте об'єм 20 еквівалентів водню при н.у. 1.17. При розчиненні 4,8 г металу виділилося 2,694 л водню (н. у.). Визначте еквівалентну масу металу. 1.18. Газоподібна сполука Нітроґену з Гідрогеном містить 12,5% (мас.) Гідрогену. Густина сполуки за воднем дорівнює 16. Знайдіть молекулярну формулу сполуки. 1.19. При спалюванні 0,511 г тривалентного металу витрачено 100 мл кисню (н. у.). Визначте молярну масу металу. 1.20. Однакова кількість металу взаємодіє з 0,6 г кисню і з 9,6 г галогену. Обчисліть еквівалентну масу галогену. 1.21. У якій кількості речовини сірки (ІV) оксиду вміщується така сама кількість атомів сірки, що й у піриті FeS масою 24 г? 1.22. При з’єднанні 5,6 г феруму з сіркою утворилося 8,8 г ферум (ІІ) сульфіду. Знайдіть еквівалентну масу феруму, якщо еквівалентна маса сірки 16 г/моль.
1.23. Яка формула поташу, якщо масовий склад цієї речовини становить: К – 56,6%; С – 8,7%; О – 34,8%. 1.24. Обчисліть масову частку вуглецю у кальцій карбіді CaC2. 1.25. 1,355 г ферум (ІІІ) хлориду взаємодіє без залишку з 1 г натрій гідроксиду, еквівалентна маса якого дорівнює 40 г/моль. Визначте еквівалентну масу феруму. 1.26. Скільки атомів уміщується в 17 г хрому? 1.27. Скільки молекул йоду вміщується у 50,8 г I2? 1.28. Який об’єм нітроген (ІІ) оксиду утворюється при взаємодії 5∙1020 молекул Нітроґену з киснем? 1.29. Скільки молей складають 4,8 г водень флуориду? 1.30. Який об’єм за н.у. займають 2,7∙1022 молекул газу?
Завдання 2. Будова атома
2.1. Що таке квантові числа? Які значення вони можуть приймати? 2.2. Складіть електронні й електронно-графічні формули атомів елементів з порядковими номерами 16 і 22. 2.3. Напишіть електронні формули атомів елементів з порядковими номерами 9 і 28. Розподіліть електрони цих атомів по квантових осередках. До якого електронного сімейства належить кожен з цих елементів? 2.4. Напишіть електронні формули атомів фосфору і ванадію. Розподіліть електрони цих атомів по квантових осередках. До якого електронного сімейства належить кожен з цих елементів? 2.5. Яке максимальне число електронів може знаходитися на s-, p-, d- і f-орбіталях даного енергетичного рівня? Чому? 2.6. Напишіть електронні формули атомів марганцю і селену. До якого електронного сімейства належить кожен з цих атомів? 2.7. Які орбіталі атома заповнюються електронами раніш: 4s або 3d; 4s або 4p? Чому? Складіть електронну формулу атома елемента з порядковим номером 21. 2.8. Складіть електронні формули атомів елементів з порядковими номерами 17 і 29. В останнього відбувається провал одного 4s-електрона на 3d-підрівень. До якого електронного сімейства належить кожен з цих елементів? 2.9. Які орбіталі атома заповнюються електронами раніш: 4d або 5s; 6s або 4p? Чому? Складіть електронну формулу атома елемента з порядковим номером 43. 2.10. Що таке ізотопи? Чим можна пояснити, що в більшості елементів періодичної системи атомні маси виражаються дробовим числом? Чи можуть атоми різних елементів мати однакову масу? Як називаються подібні атоми? 2.11. У чому сутність a-,
2.12. Складіть електронні формули атомів елементів з порядковими номерами 14 і 40. Які електрони цих атомів є валентними? 2.13. Яку радіоактивність називають штучною? Ізотоп якого елемента утвориться в результаті ядерної реакції, що відбувається при бомбардуванні ядер 2.14. Складіть електронні формули атомів елементів з порядковими номерами 16 і 28. До якого електронного сімейства належить кожен з цих елементів? 2.15. Ізотоп якого елемента утвориться в результаті ядерної реакції, що відбувається при бомбардуванні ядер 2.16. Скільки і які значення може приймати магнітне квантове число ml при орбітальному квантовому числі l = 0; 1; 2 і 3? Які елементи в періодичній системі називаються s-, p-, d- і f-елементами?Наведіть приклади. 2.17. Які значення можуть приймати квантові числа n, l, ml і ms, що характеризують стан електронів у атомі? Які значення вони приймають для зовнішніх електронів атома магнію? 2.18. Чим відрізняється послідовність у заповненні атомних орбіталей в атомах d-елементів від послідовності заповнення їх в атомах s - і p - елементів? Складіть електронну формулу атома елемента з порядковим номером 46 з огляду на те, що, знаходячись у п'ятому періоді, атоми цього елемента на п'ятому енергетичному рівні не містять жодного електрона. 2.19. Складіть електронні формули атомів елементів з порядковими номерами 24 і 33 з огляду на те, що в першому відбувається провал одного 4s-електрона на 3d-підрівень. До якого електронного сімейства належить кожен з цих елементів? 2.20. Значення якого квантового числа визначає кількість s-, p - і d-електронів у атомі кобальту? 2.21. У чому полягає принцип Паулі? Чи може бути на якомусь підрівні атома p7 - або d12 - електронів? Чому? Складіть електронну формулу атома елемента з порядковим номером 22 і визначте його валентні електрони. 2.22. Складіть електронні формули атомів елементів з порядковими номерами 32 і 42 з огляду на те, що в останнього відбувається провал одного 5s-електрона на 4d-підрівень. До якого електронного сімейства належить кожен з цих елементів? 2.23. У природних сполуках хлор знаходиться у вигляді ізотопів 2.24. Природний магній складається з ізотопів 2.25. Природний галій складається з ізотопів 2.26. Складіть повні рівняння реакцій радіоактивного розпаду: а) ж) 2.27. Який тип радіоактивного розпаду спостерігається при таких перетвореннях: а) г) 2.28. Як змінюються масове число і заряд атома ізотопу: а) при послідовному випусканні однієї a-частинки і двох b-частинок; б) при поглинанні ядром двох протонів і випусканні двох нейтронів; в) при поглинанні однієї a-частинки і викиданні двох нейтронів?
2.29. Скільки a- і b-частинок повинно було загубити ядро
|
|||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 508; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.134.190 (0.009 с.) |


 b- і b+-радіоактивного розпаду? Ізотоп якого елемента утвориться в результаті послідовного випромінювання 4a- і 2b- частинок атомним ядром
b- і b+-радіоактивного розпаду? Ізотоп якого елемента утвориться в результаті послідовного випромінювання 4a- і 2b- частинок атомним ядром 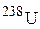 ?
?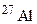 атомів протонами, якщо при цьому поглинається один протон і виділяється одна a-частинка? Складіть рівняння цієї ядерної реакції.
атомів протонами, якщо при цьому поглинається один протон і виділяється одна a-частинка? Складіть рівняння цієї ядерної реакції.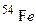 атомів a-частинками, якщо при цьому поглинається одна a-частинка і виділяється один нейтрон. Складіть рівняння цієї ядерної реакції.
атомів a-частинками, якщо при цьому поглинається одна a-частинка і виділяється один нейтрон. Складіть рівняння цієї ядерної реакції. [75,5% (мас.)] і
[75,5% (мас.)] і 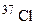 [24,5% (мас.)]. Обчисліть середню атомну масу природного хлору.
[24,5% (мас.)]. Обчисліть середню атомну масу природного хлору.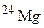 ,
, 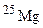 і
і 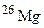 . Обчисліть середню атомну масу природного магнію, якщо вміст окремих ізотопів у атомних відсотках відповідно дорівнює 78,6; 10,1 і 11,3.
. Обчисліть середню атомну масу природного магнію, якщо вміст окремих ізотопів у атомних відсотках відповідно дорівнює 78,6; 10,1 і 11,3.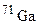 і
і 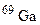 . У якому кількісному співвідношенні знаходяться між собою числа атомів цих ізотопів, якщо середня атомна маса галію дорівнює 69,72?
. У якому кількісному співвідношенні знаходяться між собою числа атомів цих ізотопів, якщо середня атомна маса галію дорівнює 69,72?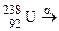 ; б)
; б) 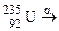 ; в)
; в) 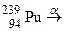 ; г)
; г) 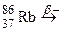 ; д)
; д) 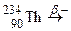 ; е)
; е) 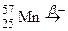 ;
;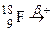 . Зазначте випадки, коли дочірній атом є ізобаром материнського атома.
. Зазначте випадки, коли дочірній атом є ізобаром материнського атома.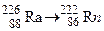 ; б)
; б) 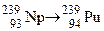 ; в)
; в)  ;
;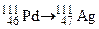 ?
?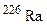 для одержання дочірнього елемента з масовим числом 206, що належить IV групі періодичної системи елементів? Назвіть цей елемент.
для одержання дочірнього елемента з масовим числом 206, що належить IV групі періодичної системи елементів? Назвіть цей елемент.


