
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 7. Нітроген та його сполукиСодержание книги
Поиск на нашем сайте Основні теоретичні відомості
До головної підгрупи V групи належать Нітроген N, Фосфор Р, Арсен As, Стибій Sb і Бісмут Ві. Елементи побічної підгрупи V групи є металами. Атоми елементів головної підгрупи V групи у зовнішньому електронному шарі містять s2р3-електрона. Маючи по п'ять електронів у зовнішньому електронному шарі атомів, ці елементи в цілому виявляють неметалічні властивості. Проте здатність до приєднання електронів виявлена у них значно слабкіше, ніж у галогенів і елементів головної підгрупи VI групи. Елементи головної підгрупи V групи виявляють максимальний ступінь окиснення +5, а мінімальний -3. Із збільшенням протонного числа елемента збільшуються радіуси атомів, зменшуються енергії їх йонізації та електронегативності. Неметалічні властивості, які яскраво виявлені в Азоту, послаблюються в разі переходу до Бісмуту. Металічні властивості починають виявлятися в Арсену, Стибій приблизно однаковою мірою виявляє як металічні, так і неметалічні властивості, а Бісмут переважно виявляє металічні властивості. У ряду N—Р—As—Sb—Ві посилюється здатність до утворення позитивно заряджених йонів, і навпаки від Бісмуту до Нітрогену зі збільшенням електронегативностей елементів посилюється їх здатність до утворення сполук з гідрогеном і металами. Сполуки з гідрогеном найлегше утворює нітроген. Здатність до утворення сполуки зі ступенем окиснення +5 від Нітрогену до Бісмуту послаблюється. Розпаровування s-електронів у атома Нітрогену майже виключено, тому Нітроген частіше виявляє нижчу валентність, ніж найвищу. Алотропія для Нітрогену, з цих самих міркувань, не характерна. На зовнішньому енергетичному рівні атом Нітрогену містить 5 електронів, які розміщуються на чотирьох валентних орбіталях 2s2, 2р1х, 2р1у, 2р1z. Внаслідок відсутності d-підрівня Нітроген не може переходити у збуджений стан. У зв’язку з цим максимальна валентність Нітрогену в сполуках дорівнює 4. Ступінь окиснення Нітрогену в його сполуках змінюється у широких межах від – 3 до +5:
У більшості сполук Нітрогену хімічний зв'язок між атомами ковалентний, тому ступінь окиснення Нітрогену та його валентність не співпадають. Основна маса Нітрогену зосереджена в атмосфері у вигляді простої речовини (78 об. часток %). Зв’язаний Нітроген утворює мінерали у формі нітратів: чилійська NаNО3, і індійська КNО3 і норвезька Са(NО3)2 селітра. Крім того Нітроген входить до складу білкових тіл усіх рослинних і тваринних організмів. В техніці азот отримують фракційною перегонкою рідкого повітря. У лабораторії азот одержують нагріванням суміші розчинів хлориду амонію і нітриту натрію. Спочатку як проміжний продукт утворюється нітрит амонію. Це термічно нестійка сполука, яка при подальшому нагріванні розкладається: NH4Сl + NаNО2 = NH4NО2 + NаСl. NH4NO2=N2↑ +2H2O. Азот високого ступеня чистоти добувають термічним розкладанням азиду натрію: 2NaN3 = 3N2↑ + 2Na. Азот можна добути також за реакціями: (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O; 2N2O = 2N2 + O2; 3CuO + 2NH3 = N2 + 3Cu + 3H2O. За звичайних умов азот — безбарвний газ, без запаху і смаку. Азот погано розчиняється у воді, не отруйний, не підтримує дихання живих організмів. Азот вважається хімічно пасивною речовиною. Атом Нітрогену має три неспарених електрони і може утворювати три ковалентні зв'язки. У молекулі N2 атоми сполучені потрійним зв'язком, один з як є σ-зв'язком, а два інші — π-зв'язками, тому молекула N2 надзвичайно міцна. Саме внаслідок міцності молекули азот хімічно малоактивний. За кімнатної температури він реагує тільки з літієм. У разі активації молекул N2 (нагрівання, наявність каталізатора, дія електричного розряду) азот виступає як окисник і лише у разі взаємодії з фтором і киснем — як відновник. Атомарний азот, який можна добути під дією на N2 електричного розряду, активний навіть за кімнатної температури, він реагує з металами і неметалами з утворенням нітридів: 3Mg + N2 = Mg3N2; 2В + N2 = 2BN. Властивості нітридів закономірно змінюються за періодами і групами періодичної системи. В малих періодах простежується перехід від основних нітридів до кислотних (Na3N — основний, A1N — амфотерний, P3N5 — кислотний). Нітриди s-елементів І та II груп періодичної системи — кристалічні речовини, досить активні сполуки; вони легко розкладаються водою з утворенням лугу й аміаку: Na3N + 3Н2О = 3NaOH + NH3↑. Нітриди d-елементів — металічні сполуки. За складом вони найчастіше відповідають формулам: MeN (TiN, VN, CrN), Me2N (Nb2N, Cr2N, Mo2N) і Мe3N (Ti3N, V3N, Mo3N). Нітроген утворює такі сполуки з Гідрогеном: аміак, гідразин, азидну кислоту, гідроксиламін. У промисловості одержують аміак прямим синтезом з азоту та водню:
Реакцію проводять при температурі 450 – 500°С і тиску ≈ 30МПа у присутності залізного каталізатора активованого оксидами (Аl2О3, К2О та ін.). У лабораторних умовах аміак одержують нагріванням сумішей амоній хлориду з кальцій гідроксидом: 2NH4C1 + Са(ОН)2 = 2NH3↑ + СаС12 + 2Н2О. У разі охолодження водного розчину аміаку можна добути кристалогідрати типу NH3·Н2О і 2NH3·Н2О. За звичайних умов аміак безбарвний газ з рідким специфічним запахом. При вдиханні значних кількостей аміаку відбувається подразнення слизових оболонок очей та органів дихання. Аміак майже у 1,7 рази легший за повітря, 1 л його має масу 0,77 г. При охолодженні до – 33,4°С аміак скраплюється, а при – 77,8°С твердіє. Перевезти у рідкий стан аміак можна і при звичайній температурі, але при високому тиску. Легкість переходу газоподібного аміаку в рідкий стан пояснюється полярністю зв’язків N – Н в його молекулі і міцних міжмолекулярних водневих зв’язків. Аміак – полярна речовина тому він чудово розчиняється у полярному розчиннику – воді. При 0 °С один об’єм води поглинає 1200 об’ємів газоподібного аміаку. Легка розчинність аміаку у воді пояснюється міцними водневими зв’язками, які утворюються за рахунок донарно - акцепторного механізму. Утворені при цьому гідроксиди – іони обумовлюють лужне середовище розчину. Виходячи з низької константи дисоціації можна сказати, що гідрат аміаку NH4OH це слабка основа:
Рівновага дисоціації гідрату аміаку значно зміщена ліворуч. Тому говорити про існування іонної сполуки NH4OH (гідроксиду амонію) не можна. Концентрований водний розчин аміаку містить 25% (мас.) NH3 і має густину 0,91 г/см3. У медичній практиці застосовують розчин аміаку з масовою часткою 10% під назвою нашатирний спирт. У хімічному відношенні аміак досить активний. Оскільки Нітроген у NH3 має нижчий ступінь окиснення – 3, аміак виявляє тільки відновні властивості. На повітрі аміак не горить, але в атмосфері кисню він окислюється до вільного азоту: 4N3-H3 + 3О2° = 2N2° +6Н2О2- У присутності платинового каталізатора окиснення аміаку перебігає до нітроген (ІІ) оксиду: 4N3-H3 + 3О2° = 2N2+О↑ +6Н2О2-. Аміак виявляє відновні властивості також у реакціях з іншими окисниками. Так, розчин аміаку при нагріванні знебарвлює розчин калій перманганату: 2N3-H3 + 2КМn+7О4 = N2° + 2Мn+4О2 + 2КОН + 2Н2О Крім реакцій окиснення, аміак вступає в реакції заміщення. Атоми гідрогену в молекулі NH3 можуть заміщуватись на атоми металів. Особливо під час взаємодії з активними металами аміак поводить себе подібно до води, під час нагрівання натрій витісняє водень з NH3: 2Na + 2NH3 = 2NaNH2 + H2↑; 2Na + NH3 = Na2NH + H2↑. Далі може утворюватись і нітрид натрію Na3N. Сполуки типу NaNH2, Na2NH мають сольову природу і називаються відповідно амідом та імідом натрію. Аміди лужних металів і нітриди, які утворені активними металами при кімнатній температурі гідролізуються:
Мg3N2 + 6H2O 3Мg(ОН)2 + 2NH3 Одна з найважливіших властивостей аміаку здатність утворювати солі амонію. При взаємодії аміаку з протоном утворюється йон амонію NH4+. NH3 + HC1 = NH4C1; NH3 + HNO3 = NH4NO3. Під час взаємодії з кислотами амоній гідроксид також утворює солі: NH3 + Н2О + НС1 = NH4C1 + Н2О. Більшість солей амонію добре розчиняється у воді. Погано розчинними є NH4C1O4, NH4ReO4. За розчинністю солі амонію подібні до солей калію. Оскільки водний розчин аміаку є слабкою основою, то солі амонію в розчинах гідролізують. Розчини солей, утворених, аміаком і сильною кислотою мають слабко кислу реакцію:
Солі амонію відрізняються від солей лужних металів леткістю в разі нагрівання. Солі амонію можуть розкладатися оборотно і необоротно. Оборотно розкладаються солі амонію, аніон яких не є окисником або виявляє слабкі окиснювальні властивості, наприклад:
Солі амонію, аніони яких є окисниками, розкладаються необоротно — відбувається окисно-відновна реакція: NH4NO3 = N2O + 2Н2О. У цій реакції окиснюється йон амонію, а відновлюється нітрат-йон. Крім NH3 відомі дві інші гідрогені сполуки Нітрогену - гідразин N2H4 і гідроксиламін NH2ОН. Обидві речовини важливі як для неорганічної, так і органічної хімії. Реакція окиснення аміаку гіпохлоритом натрію відбувається з утворенням гідразину: 2NH3 +NaOCl = NaCl + N2H4 + H2O. З водою і спиртом гідразин змішується у будь-яких співвідношеннях. Водні розчини мають лужну реакцію. З кислотами гідразин утворює два ряди солей – солі гідрозонію [N2H6]Cl2 і [N2H5]Cl. У зв’язку з тим, що в гідразин Нітроген знаходиться в проміжному ступені окиснення (-2), гідразин виявляє окисно-відновну двоїстість з перевагою відновної активності. 5N2-2H4 +4КМn+7О4 + 6Н2SО4 = 5N2° + 4Мn+2SО4 + 2К2SО4 + 16Н2О Відновити гідразин до NH3 можна лише сильними відновниками: Zn° + N2-2H4 + 4НСl = 2N-3H4C1 + ZnСl2 Під час взаємодії нітритної кислоти з гідразином у водному розчині відбувається окисно-відновна реакція, внаслідок якої утворюється азидна кислота: N2H4 + HNO2 = HN3 + 2Н2О. Гідроксиламін NH2ОН можна представити як похідне аміаку, в якому атом Гідрогену заміщений на групу ОН. Одержують гідроксиламін відновленням нітратів або нітритів: HNO3 + 2Н2 = NH2ОН + Н2O. Гідроксил амін з водою утворює гідрат NH2ОН·Н2O, а з кислотами - солі гідроксил амонію, наприклад [NH3ОН]Cl. Ступінь окиснення атома Нітрогену в молекулі гідроксил аміну дорівнює – 1. Тому він може виявляти як відновні, так і окисні властивості наприклад, у реакції: 4Fe+2SО4 + 2N-1H2ОН + 3Н2SО4 = 2Fe+32(SО4)3 + (N-3H4)2SО4 + 2Н2О, гідроксиламін виступає у ролі окисника, а в реакції: 2N-1H2ОН + І2° + 2КОН = N2° + 2КІ-1 + 4Н2O в ролі відновника. Азидна кислота належить до слабких кислот. Водні розчини її дисоціюють:
Солі азидної кислоти називають азидами. Нітроген з оксигеном утворює шість оксидів: N2O, NO, N2O3, NO2, N2O4, N2O5, в яких виявляє ступені окиснення відповідно +1, +2, +3, +4, +4, +5. Всі оксиди нітрогену за винятком N2O дуже отруйні. Нітроген (І) оксид N2O – одержують термічним розкладанням амоній нітрату: N-3H4N+5O3 N2O несолетворний оксид, тому в воді розчиняється мало і не взаємодіє з нею. При нагріванні N2Oлегко розкладається на азот і кисень: 2N2O = 2N2° + О2° Нітроген (ІІ) оксид NO. Основним промисловим способом одержання NO є окиснення аміаку в присутності каталізаторів. NO – безбарвний, малорозчинний у воді газ. Він є несолетворним оксидом, тому з водою не реагує. Нітроген (ІІ) оксид характеризується окисно-відновною двоїстістю, однак переважаючою є відновна функція. За кімнатної температури й атмосферного тиску окиснення NO відбувається миттєво: 2NO + О2 = 2NO2. Взаємодіючи з сильними відновниками, NO відновлюється: 2NO + 2H2 = N2 +2Н2О Ця реакція відбувається з вибухом, оскільки виділяється велика кількість енергії. Нітроген (ІІІ) оксид N2O3 одержують охолодженням суміші NO2 з NO.
Нітроген (ІІІ) оксид – кислотний оксид, він легко поглинається лугами, утворюючи нітрити: N2O3 + 2NaОН = 2NaNO2 + Н2О. Внаслідок розчинення N2O3 у воді утворюється нітритна кислота НNO2. Нітритна кислота НNO2 відома лише в розчині. Це кислота середньої сили. Нітритна кислота нестійка сполука, вона розкладається з виділенням NO і NO2. 2НN+3O2 = N+4O2↑ + N+2O + 2Н2О. Остання реакція є реакцією самоокислення-самовідновлення, її використовують для виявлення нітрит-йонів. Солі НNO2 називаються нітритами. Нітрити лужних і лужноземельних металів добре розчинні у воді. Всі нітрити отруйні. Нітрити, як солі слабкої кислоти легко розкладаються іншими кислотами: NaNO2 + H2SO4 = NaHSO4 + НNO2 Нітритна кислота та її солі завдяки наявності атома Нітрогену з проміжним ступенем окиснення (+3) можуть виявляти як окисні, так і відновні властивості, наприклад: 2NaN+3O2 + 2КІ-1 + 2H2SO4 = І20 + 2N+2O + K2SO4 + Na2SO4 + 2Н2О. Окисник
2І-1 -2ē → І20 2 1 відновник, пр. окиснення;
5NaN+3O2 + 2КМn+7О4 + 3H2SO4 = 2Mn+2SO4 + 5NaN+5O3 + K2SO4 + 3H2O. Відновник N+3 - 2ē → N+5 2 5 відновник, пр. окиснення; Мn+7 +5ē → Mn+2 5 2 окисник, пр. відновлення. Нітроген (ІV) оксид NO2 – бурий газ із специфічним запахом, важчий за повітря, подразнює дихальні шляхи, дуже отруйний. Промисловий метод одержання NO2: 2NO + О2 = 2NO2 У кислотно-основних перетвореннях NO2 поводить себе як кислотний оксид, він добре розчиняється у воді з утворенням нітратної та нітратної кислот: 2N+4O2 + Н2О = НN+3O2 + НN+5O3. У разі взаємодії з лугами NO2 утворює нітрит і нітрат: 2NO2 + 2КОН = KNO3 +KNO2 + Н2О. Нітроген (V) оксид N2O5 одержують дегідратацією нітратної кислоти за допомогою Р2О5, або окисненням NO2 озоном: 2HNO3 + Р2О5 = 2НРО3 + N2O5, 6NО2 + О3 = 3N2O5. N2O5 – найсильніший окисник серед оксидів Нітрогену. Внаслідок розчинення N2O5 у воді утворюється нітратна кислота НNO3: N2O5 + Н2О = 2НNO3. У промисловості нітратну кислоту добувають каталітичним окисненням NH3 до NO, потім NO окиснюють киснем повітря до NO2 і суміш NO2 з надлишком повітря поглинають водою або розбавленим розчином нітратної кислоти. Сумарне рівняння цієї реакції можна записати так: 4NO2 + 2Н2О + О2 = 4HNO3. Висококонцентрована нітратна кислота має буре забарвлення внаслідок того, що під дією світла частково розкладається з утворенням NO2, який має буре забарвлення: 4HNO3 = 4NO2↑ + О2↑ + 2Н2О. Нітратна кислота - одна з найсильніших кислот, у розведених водних розчинах вона повністю дисоційована на йони: HNO3 → Н+ + NO3¯. З хімічної точки зору нітратна кислота є сильним окисником. Вона окислює більшість металів і неметалів. Неметали при дії нітратної кислоти окислюються у оксигеновмісні кислоти з вищим ступенем окиснення кислотоутворюючого неметалу, наприклад: S° + 6НNО3 = H2S+6O4 + 6NО2 + 2Н2О, 3Р° + 5НNО3 + 2Н2О = 3H3Р+5O4 + 5NО. Нітратна кислота взаємодіє з усіма металами (за винятком золота, платини, танталу, родію, іридію), перетворюючи їх на нітрати. Деякі метали концентрована HNO3 пасивує. Такі метали, як Cr, Fe, A1 під дією концентрованої нітратної кислоти переходять у пасивний стан, але розчиняються в розбавленій HNO3. Нітратні кислота може відновлюватися до різних продуктів NО2, N2O3, NО, N2O, N2 і NН4NO3. Метали, які розташовані у ряді напруг від Н до Аu, розчиняються у концентрованій HNO3 з виділенням NО2. З розведеною нітратною кислотою процес перебігає з виділенням оксиду нітрогену (ІІ): Сu + 4HNO3(конц.) = Сu(NO3)2 + 2NO2↑ + 2H2O, 3Аg + 4HNO3(р.) = 3АgNO3 + NO↑ + 2H2O. Метали середньої активності (від Fе до Н) відновлюють концентровану нітратну кислоту до NO, а дуже розбавлену до NН4NO3: 3Рd + 8НNO3(p.) = 3Рd(NO3)2 + 2NО + 4H2O; 4Fе + 10НNO3(дуже р.) = 4 Fе(NO3)2 + NH4NO3 + 3H2O. Активні метали розташовані у ряді напруг значно лівіше водню (від Zn до Lі), концентровану нітратну кислоту відновлюють до оксиду нітрогену (І): 4Са + 10НNО3(конц.) = 4Са(NO3)2 + N2O + 5H2O, а дуже розведену НNO3 відновлюють до NН4+: 4Mg + 10НNO3(дуже p.) = 4Mg(NO3)2 + NН4NО3 + 3H2O; Більш сильну окислювальну дію виявляє суміш концентрованих нітратної та хлоридної кислот (1:3) – «царська водка» та нітратної та фторидної кислот. Реакції розчинення золота, платини, силіцію у суміші кислот можна подати у вигляді таких рівнянь: Аu° + HN5+O3 + 4НСl = Н[Au3+Cl4] + N2+O↑ + 2H2O, Pt° + 4HN5+O3 + 18НСl = 3Н2[Pt4+Cl6] + 4N2+O↑ + 8H2O, 3Si° + 4HN5+O3 + 9H2F2 = 3Н2[Si2+F6] + 4N2+O↑ + 8H2O. Солі НNO3 – нітрати, добре розчинні у воді. Розчини нітратів мають слабкі окислювальні властивості. Цинк і алюміній у лужному розчині відновлюють нітрати і нітрити до аміаку: 4Zn + NаNO3 +7NаОН + 6H2O = 4Nа2[Zn(ОН)4] + NН3↑. Нітрати досить стійкі при звичайних температурах, але при нагріванні розкладаються з виділенням кисню. При розкладанні нітратів металів, які розташовані у ряді стандартних електродних потенціалів зліва від магнію, утворюються нітрити металів і кисень, наприклад: 2KNO3 = 2KNO2 + О2↑, Ва(NO3)2 = Ва(NO2)2 + О2↑. Нітрити металів від Мg до Сu перетворюються на оксиди, наприклад: 2Сu(NO3)2 = 2СuO + 4NО2 + О2↑. При термічному розкладі нітратів неактивних металів виділяється вільний метал: 2АgNO3 = 2Аg + 2NO2 + О2↑, Нg(NO3)2 = Нg + 2NO2 + О2↑. Нітрити натрію, калію, амонію і кальцію, які використовують як нітратні добрива, називають селітрами. Фосфор досить поширений елемент (0,08 % маси земної кори). В природі він зустрічається виключно у зв’язаному стані. Найважливішими природними сполуками фосфору є мінерали фосфорит Са3(РО4)2 і апатит, який у своєму складі містить, крім Са3(РО4)2, СаF2 або СаСl2. У вільному стані фосфор буває в кількох модифікаціях. Найбільше значення мають так звані білий і червоний фосфор. Білий фосфор являє собою безбарвну соскоподібну речовину з жовтуватим відтінком, через що його називають також жовтим фосфором. Утворюється при швидкому охолодженні парів фосфору (tпл = 44,1°С, tкіп. = 280°С). Білий фосфор надзвичайно отруйний, легкозаймистий (tзайм. = 40°С). Практично не розчинний у воді, але добре розчинний у сірковуглеці СS2. Червоний фосфор являє собою порошкоподібну речовину червоно-бурого кольру. Утворюється при тривалому нагріванні білого фосфору в герметично закритому посуді при температурі близько 250°С. Червоний фосфор не отруйний і в сірковуглеці не розчиняється (tзайм. = 260°С). Чорний фосфор утворюється з білого при нагріванні його до 200-220°С при підвищеному тиску. Схожий на вигляд на графіт, жирний на дотик і важче інших видозмін, є напівпровідником. У вільному стані фосфор одержують шляхом відновлення фосфату кальцію вугіллям в присутності діоксиду сіліцію: Са3(РО4)2 + 3SіО2 = 3СаSіО3 + Р2О5 Р2О5 + 5С = 2Р + 5СО↑. З киснем фосфор сполучається досить енергійно, особливо білий, виділяючи значну кількість тепла і утворюючи геміпентаоксид фосфору Р2О5: 4Р° + 5О2° = 2Р25+О52- Фосфор легко реагує і з іншими неметалами, особливо з хлором, яким він навіть при невеликому нагріванні енергійно взаємодіє з утворенням безбарвних кристалів пентахлориду фосфору: 2Р° + 5Сl2° = 2Р5+Сl51- При дуже високій температурі фосфор, подібно до азоту, може сполучатися з багатьма металами, утворюючи фосфіди: 2Р° + 3Са° = Са3Р23- З воднем фосфор безпосередньо не взаємодіє. Але посереднім шляхом можне одержати сполуки фосфору з воднем: Са3Р2 + 6НСl = 3СаСl2 + 2РН3↑. Фосфін РН3 – безбарвний газ з запахом чеснока, дуже ядовитий, має слабо виражені основні властивості. Утворює солі лише з більш сильними кислотами (НСlО4, НСl): РН3 + НСl = РН4Сl. З киснем фосфор утворює кілька оксидів, з яких найважливіший Р2О5. Даний ангідрид дуже енергійно взаємодіє з водою, навіть може віднімати елементи води від інших сполук. На повітрі швидко розпливається. При сполученні фосфатного ангідриду з водою при звичайних умовах утворюється мета фосфатна кислота: Р2О5 + Н2О = 2НРО3. При нагріванні молекула мета фосфатної кислоти приєднує одну молекулу води перетворюється в ортофосфатну кислоту: НРО3 + Н2О = Н3РО4. Ортофосфатна кислота (Н3РО4) має важливе практичне значення, її часто називають просто фосфатною кислотою. Фосфатна кислота представляє собою безбарвну кристалічну речовину (tпл = 42,35°С). У воді розчиняється дуже добре і водному розчині є кислотою середньої сили. В промисловості її одержують при дії сульфатної кислоти на розмелений фосфат кальцію: Са3(РО4)2 + 2Н2SО4 = 3СаSО4↓ + 2Н3РО4. В лабораторії фосфатну кислоту можна отримати окисненням фосфору 30%-ною НNО3: 3Р + 5 НNО3 + 2Н2О = 3Н3РО4 + 5NО↑. Солі фосфатної кислоти мають назву фосфати. Оскільки ортофосфатна кислота є триосновною, від неї походить три ряди солей, наприклад: Н3РО4 + NаОН = NаН2РО4 + Н2О, Н3РО4 + 2NаОН = Nа2НРО4 + 2Н2О, Н3РО4 + 3NаОН = Nа3РО4 + 3Н2О. Відповідно назви: перша - дигідрофосфат натрію, друга – гідрофосфат натрію, третя – нормальним фосфатом натрію. Дигідрофосфати металів добре розчиняються у воді. Усі нормальні фосфати, за винятком фосфатів натрію, калію і амонію, у воді нерозчинні. Гідрофосфати за розчинністю у воді займають проміжне місце. Але гідро фосфати і нерозчинні у воді фосфати легко розчиняються навіть у слабких органічних кислотах. Деякі солі ортофосфатної кислоти застосовують у сільському господарстві у якості фосфорних добрив (Са3(РО4)2, Са(Н2РО4)2, СаНРО4·nН2О, NН4Н2РО4 і т.д.).
Лабораторна робота
Дослід 1. Одержання амоніаку і вивчення його властивостей. (Тяга!) У суху пробірку внести по мікрошпателю амоній хлориду і кальцій гідроксиду. Перемішати вміст пробірки скляною паличкою та обережно нагріти. До отвору пробірки піднести послідовно: вологу смужку червоного паперу і пояснити зміну його забарвлення та скляну паличку, змочену концентрованою хлоридною кислотою і спостерігати утворення білого нальоту амоній хлориду. Скласти рівняння реакцій одержання амоніаку; взаємодії амоніаку з водою і хлоридною кислотою. Дослід 2. Рівновага у розчині амоніаку У три пробірки внести 5-6 крапель розчину амоніаку і додати 1-2 краплі фенолфталеїну. Потім одну пробірку з розчином амоніаку обережно нагріти, а в другу додати амоній хлорид. Порівняти колір розчину у всіх трьох пробірках. Пояснити вплив температури і додавання
Дослід 3. Термічний розклад солей амонію. (Тяга!) У суху пробірку внести 1 мікрошпатель амоній хлориду, обережно нагріти дно пробірки. Відмітити утворення білого нальоту у верхній частині пробірки. Написати рівняння оборотньої реакції термічного розкладу амоній хлориду. Дослід 4. Окисно-відновні властивості нітритів (Тяга!) а). У пробірку внести 3-4 краплі розчину калій йодиду та такий же об’єм розчину сульфатної кислоти. Потім додати 2-4 краплі розчину калій нітриту. Написати рівняння реакції, враховуючи, що нітрит-йон відновлюється до оксиду нітрогену (II). б). У пробірку з 3-4 краплями розчину калій перманганату підкисленого 2-3 краплями розчину сульфатної кислоти, додати 2-4 краплі розчину калій нітриту. Відмітити зникнення червоно-фіолетового забарвлення перманганат-йону. Написати рівняння реакції. Зробити висновок про окисно-відновну двоїстість нітритної кислоти та нітритів. Дослід 5. Окисні властивості нітратної кислоти. (Тяга!) а). У суху пробірку налити 1-2 мл нітратної кислоти, нагріти під тягою. В гарячу кислоту обережно внести тліючу вуглинку. Спостерігати горіння вугілля та виділення червоно-бурого газу б). У дві пробірки внести по 3-4 краплі свіжоприготованого розчину
Контрольні запитання та задачі 1. Охарактерізувати положення Нітрогену в періодичній системі Д.І.Менделєєва. Написати електрону формулу атома Нітрогена. З точки зору будови атома розглянути можливі валентні стани та ступені окиснення Нітрогена. 2. Написати рівняння реакцій одержання азоту: а) термічним розкладом амоній дихромату та амоній нітриту; б) взаємодією амоніаку з оксидом купруму (II) при нагріванні; в) спалюванням амоніаку при відсутності каталізатора. 3. Написати рівняння реакцій одержання амоніаку: а) з нітриду алюмінію; б) з амоній хлориду; в) з азоту та водню. 4. Написати продукти термічного розкладу нітратів:
5. Написати рівняння реакції диспропорціонування фосфору в лужному середовищі, підібрати коефіцієнти методом електронного балансу. 6. Написати рівняння реакцій взаємодії концентрованої та розведеної нітратної кислоти з цинком, міддю, миш’яком та сурмою. 7. Закінчити рівняння реакцій та підібрати коефіцієнти методом електронного балансу: a) b) c) d) e) 8.Написати йонні та молекулярні рівняння реакцій гідролізу:
Тема 8. р-елементи VI групи Основні теоретичні відомості
До головної підгрупи шостої групи належать: Оксиген О, Сульфур S, Селен Se, Телур Те і радіоактивний елемент Полоній Ро. Атоми елементів головної підгрупи у зовнішньому електронному шарі містять s2р4-електрони. Атом Оксигену відрізняється від атомів інших елементів цієї підгрупи відсутністю d-підрівня на останньому енергетичному рівні, тому він, як правило, може виявляти ковалентність, що дорівнює двом, за винятком таких сполук, наприклад як О3, CO тощо. На відміну від Оксигену, Сульфур, Селен, Телур, Полоній можуть виявляти ковалентність не тільки два, а й чотири і шість. Це пояснюється тим, що число неспарених електронів в атомах цих елементів може збільшуватись за рахунок розпаровування s- і р-електронів з переходом їх на d-орбіталі зовнішнього електронного шару. У разі переходу від Оксигену до Полонію радіуси їхніх атомів збільшуються, а енергія йонізації та відносна електронегативність — зменшуються. Тому найближче до металів слід розміщувати Полоній. Всі інші елементи цієї групи — неметали. Активність їх як неметалів від Оксигену до Телуру послаблюється. Одночасно від Сульфуру до Полонію послаблюється здатність виявляти негативний ступінь окиснення, який у сполуках з металами і гідрогеном, як правило, дорівнює -2. Оксисен найпоширеніший елемент у земній корі і його вміст становить 47 мас %. Кисень – проста речовина, утворена оксисеном, міститься в атмосферному повітрі. У зв’язаному стані оксисен входить до складу води, кварцу, силікатів, алюмосилікатів, сполук тваринного та рослинного походження. В промисловості кисень одержують фракціонною перегонкою рідкого повітря та електролізом води. У лабораторії кисень одержують за рахунок термічного або каталітичного розкладу сполук, багатих на оксисен: 2KMnO4 2KСlO3 Оксиген виявляє широкий діапазон ступенів окиснення в сполуках. У зв’язку з тим, що атому Оксигену не вистачає двох електронів до завершення зовнішнього енергетичного рівня, він легко може приймати їх від менш електронегативних елементів, виявляючи мінімальний ступінь окиснення -2 (Н2О, КОН, Н2SО4). У пероксидах Оксиген має ступінь окиснення -1 (Н2О2, Nа2О2), в над пероксидах - Молекула О2 досить стійка. Як і для інших р-елементів 2-го періоду, максимальна ковалентність оксигену дорівнює чотирьом. За хімічною активністю кисень поступається лише галогенам. Він утворює сполуки з усіма елементами, за винятком легких інертних газів Не, Nе, Аr. За звичайних умов кисень не є сильним окисником. Інакше ми б не змогли спостерігати за розмаїтістю квітів та кольорів, які нас оточують. Лише при підвищеній температурі зв'язок у молекулі О2 руйнується (D 494 кДж/моль), і тоді кисень починає реагувати з усіма простими речовинами, за виключенням галогенів, інертних газів та благородних металів Аg, Аu, Рt, Rh. 4Fe + 3О2 = 2Fe2O3; 4Р + 5О2 = Р4О10; S + О2 = SO2. Реакції окиснення відбуваються з різною швидкістю. Повільне окиснення органічних речовин називається гниттям. Окиснення, що відбувається з інтенсивним виділенням теплової та світлової енергії, називається горінням. Існує не лише молекулярний Оксиген О2, а ще й озон О3, його друга алотропна форма. Озон добувають у спеціальних приладах – озонаторах: 3О2 = 2О3 У природі озон утворюється з кисню повітря під час грози, а також у розрідженній атмосфері на висоті 20 – 30 кілометрів під дією ультрафіолетових променів. Озоновий шар має неоціненне значення для розвитку життя на Землі: поглинаючи ультрафіолетові промені, він захищає все живе від згубної дії зовнішнього гамма-випромінення, а також поглинає інфрачервоні промені, що йдуть від Землі, таким чином перешкоджаючи її охолодженню. Озон – важкий газ синього кольору, з різким запахом, отруйний. О3 – один з дуже сильних окисників, окислює золото та платину. При дії на метали утворює пероксидні сполуки. Навіть така стійка до окиснення речовина, як срібло, під дією озону перетворюється на пероксид аргентуму: 2Аg + 3О3 = Аg2О2 + 2О2. Озон окиснює всі метали (крім золота і платинових металів) і більшість неметалів. Внаслідок взаємодії озону з лужними металами утворюються озоніди: К + О3 = КО3. Озон іди – сполуки до складу молекул яких входять катіони металів та озонід–йони О3-. Наявністю в йоні О3- неспареного електрона зумовлює парамагнетизм озонідів. Озон іди забарвлені в червоний колір. Озон використовують для знезараження питної води. На відміну від обробленої хлором води, яка містить шкідливі неорганічні та органічні сполуки, озонована вода абсолютно нешкідлива для використання в народному господарстві та побуті. Приєднуючи два електрони, молекула кисню перетворюється на пероксид-йон О22-, в якому атоми Оксигену зв’язані одним двохелектронним зв’язком. Похідні О22- називаються пероксидами. Найбільше практичне значення з усіх пероксидів має пероксид гідрогену Н2О2. У лабораторії та медицині використовують 3%- і 30%-і розчини Н2О2 (останній називають пергідролем). Пероксид гідрогену добувають кількома способами. Наприклад: H2S2O8 + 2Н2О = 2H2SO4 + Н2О2. Пероксид гідрогену відганяють від сульфатної кислоти за зниженого тиску. Пероксид гідрогену легко розкладається за реакцією самоокиснення-самовідновлення: 2Н2О2 = 2Н2О + О2. Отже, з точки зору окисно-відновних перетворень пероксид гідрогену може виявляти властивості як окисника, так і відновника. Наприклад, у реакції: 2КІ + Na2O2 + 2H2SO4 = І2 + Na2SO4 + K2SO4 + 2Н2О пероксид гідрогену виявляє окиснювальні властивості, а під час взаємодії з дуже сильними окисниками — відновні: 2КМnО4 + 5Н2О2 + 3H2< |
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1768; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.017 с.) |

 N2 + 3Н2 2NH3.
N2 + 3Н2 2NH3. NH3 + Н2О NH3·Н2О NH4+ + ОН-.
NH3 + Н2О NH3·Н2О NH4+ + ОН-. NaNH2 + H2O NaOH + NH3↑.
NaNH2 + H2O NaOH + NH3↑. NH4C1 + Н2О NH3 + Н2О + НС1.
NH4C1 + Н2О NH3 + Н2О + НС1. NH4C1 NH3 + НС1.
NH4C1 NH3 + НС1. HN3 Н+ + N-3.
HN3 Н+ + N-3. N2+1O + 2Н2О.
N2+1O + 2Н2О. NO2 + NO N2O3
NO2 + NO N2O3 N+3 + 1ē → N+2 1 2 окисник, пр. відновлення;
N+3 + 1ē → N+2 1 2 окисник, пр. відновлення; на зміщення наступних рівноваг:
на зміщення наступних рівноваг:

 + 8,85 ккал.
+ 8,85 ккал.
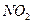 . Написати рівняння реакції.
. Написати рівняння реакції. . В одну з них додати 5 крапель концентрованої нітратної кислоти, нагріти та прокип’ятити 2-3 хв. Після охолодження додати в кожну з пробірок 2-3 краплі розчину амоній роданіду
. В одну з них додати 5 крапель концентрованої нітратної кислоти, нагріти та прокип’ятити 2-3 хв. Після охолодження додати в кожну з пробірок 2-3 краплі розчину амоній роданіду 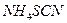 . Відмітити, в якій із пробірок міститься йон
. Відмітити, в якій із пробірок міститься йон  . Написати рівняння реакцій.
. Написати рівняння реакцій.
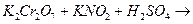






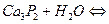
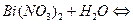
 K2MnО4 + MnO2 + O2↑.
K2MnО4 + MnO2 + O2↑. 2KСl + 3O2↑.
2KСl + 3O2↑. (КО2), а в озонідах -
(КО2), а в озонідах -  (КО3). Крім негативних, Оксиген утворює сполуки з флором із позитивними ступенями окиснення: +1(О2F2), +2(ОF2), +4(О3).
(КО3). Крім негативних, Оксиген утворює сполуки з флором із позитивними ступенями окиснення: +1(О2F2), +2(ОF2), +4(О3).


