
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 9. Р-елементи vіі групиСодержание книги
Поиск на нашем сайте
Основні теоретичні відомості
До VII групи головної підгрупи періодичної системи відносяться Флуор F, Хлор Сl, Бром Вr, Йод І і Астат At, який не має стабільних ізотопів. Елементи назвали галогенами, що з грецької перекладається як «ті, що народжують солі». Таку назву вони отримали за властивість безпосередньо сполучатися з металами, утворюючи солі: Флориди, хлориди, броміди та йодиди. Галогени відносяться до р -елементів, на їх зовнішньому енергетичному рівні знаходиться сім електронів. Це відповідає номеру групи, до якої вони належать. Загальна електронна конфігурація валентного шару: ns2np5. Ці елементи найбільш електронегативні у відповідних періодах. До завершення зовнішньої електронної оболонки, властивої благородним газам, не вистачає одного електрона. Ось чому всі галогени – сильні окисники, їх атоми легко перетворюються на галогенід-йони Г− з електронною оболонкою сусіда по періоду − благородного газу ns2np5. Радіус атома в ряді F−Сl−Вr−І−At зростає, проте зменшується електронегативність і окислювальна активність галогенів, що свідчить про ослаблення неметалічних властивостей. Флор – найбільш виражений неметал, а у Йода з’являються деякі ознаки металу. Усі галогени існують у вигляді двоатомних молекул Е2 (нульовий ступінь окиснення), мають молекулярну кристалічну решітку, за звичайних умов фтор і хлор – це гази, йод легко переходить у газоподібний стан (сублімація йоду). У нижньому ступені окиснення галогени легко утворюють солі. У хімічних сполуках усі галогени (крім Флуору) виявляють весь набір непарних позитивних ступенів окиснення +1, +3, +5, +7. Це головним чином, кисневмісні кислоти та їх солі. В оксидах галогени також виявляють парні ступені окиснення, наприклад СlО2, Сl2О6, але ці сполуки термодинамічно нестійкі та нехарактерні. У зв’язку з відсутністю d-підрівня в атомі Флору, його хімічна поведінка суттєво відрізняється від інших галогенів. З цієї причини хімічні властивості Флору розглядають окремо. Властивості Флору та його сполук. Флор найбільш електронегативний з усіх елементів періодичної системи (4,00), то його атом здатний лише приймати електрон, виявляючи єдиний ступінь окиснення в сполуках -1. Флуор досить поширений елемент. Його вміст у земній корі складає 2,8·10-2%. Найважливіші мінерали Флору: CaF2 — плавиковий шпат (флюорит), Na3AlF6 — кріоліт та Са3(РО4)2·CaF2 — флуорапатит. Фтор як просту речовину добувають електролізом розплаву KF·2HF (температури 80—120 °С) або KF·HF (за температури 240—300 °С). Лише електричний струм в жорстких умовах здатний анодно окиснити флуорид-йон до вільного фтору. Внаслідок високої хімічної активності фтор спричиняє корозію майже усіх матеріалів. Назва «Флуор» з грецької перекладається як «загибель», що повністю відповідає дійсності. Виняток складає нікель та його сплави, на поверхні яких утворюється з фтором захисна плівка NіF2. Саме тому обладнання для виробництва та зберігання фтору виготовляють з нікелю. Фтор за звичайних умов — це газ світло-жовтого кольору з різким неприємним запахом. Температура плавлення фтору становить -220,6 °С, температура кипіння -187,7 °С. Молекула фтору складається з двох атомів, сполучених σ р-р зв’язком. Агрегатний стан ковалентних молекул типу Е2 суттєво залежить від сил міжмолекулярної взаємодії. Чим менша здатність молекул галогенів деформуватися, тим слабші сили Ван-дер-Ваальса. У молекулі F2 електронна оболонка розміщена близько біля ядра, тому вона мало деформується. Ось чому фтор, на відміну від інших галогенів, легкий газ. Висока хімічна активність фтору обумовлена, з одного боку, малою енергією зв’язку в молекулі F2 (152 кДж/моль), з іншого – великим значенням енергії утворених ним зв’язків: Е(Н−F) = 566 кДж/моль, Е(S−F) = 582 кДж/моль. Фтор енергійно взаємодіє з усіма простими речовинами, за винятком О2, Не, Ne, Аr. Ксенон горить у середовищі фтору яскравим полум'ям, при цьому утворюється сполука XeF4. Криптон взаємодіє з фтором лише в електричному розряді. В середовищі фтору горять навіть так речовини, як азбест і вода. У сполуках з Флуором елементи дуже часто виявляють свої найвищі ступені окиснення. У реакціях фтор виступає дуже активним окисником, окислюючи навіть таку інертну сполуку, як вода: 2Н2O + 2F2 = 4НF + О2. Велике значення енергії зв’язку F—Si зумовлює розчинення оксиду сіліцію(ІV) у вологому фьорі: SiO2 + 2F2 = SiF4 + О2. З воднем фтор взаємодіє з вибухом навіть на холоді з утворенням Флориду гідрогену: Н2 + F2 = 2НF. Флуорид гідрогену у промисловості одержують за реакцією витиснення його з СаF2 концентрованоюН2SО4: СаF2 + Н2SО4(к) = СаSО4 + 2НF↑. Флуорид гідрогену при температурі вище 19,5°С – безбарвний газ, надзвичайно отруйний, а нижче цієї температури – безбарвна рідина. У рідкому та газоподібному стані флуорид гідрогену внаслідок утворення міжмолекулярних водневих зв’язків асоційований в (НF)n, n змінюється від 1 до 4 у пароподібному, n > 4 – у рідкому флуориді гідрогену. Водний розчин флуориду гідрогену – флуоридна кислота (плавикова) – кислота середньої сили:
F+HF HF2−. За рахунок водневих зв’язків флуорид-йони з молекулами НF утворюють гідрогендифлуорид-йон лінійної будови. Тому під час нейтралізації флуоридної кислоти гідроксидом калію утворюється гідрогендифлоурид калію: 2HF + КОН → KHF2 + H2O. Фторидна кислота єдина серед галогеноводневих кислот утворює кислі солі. Це ще одне підтвердження, що кислота за звичайних умов існує у вигляді димера H2F2. Флуоридна кислота здатна роз'їдати кварц і скло, борати і силікати. Вона взаємодіє із сполуками Силіцію і Бору за такими рівняннями реакцій: SiO2 + 4HF(г) = SiF4 + 2Н2О; В2О3 + 8HF = 2H[BF4] + 3Н2О; SiO2 + 6HF = H2[SiF6] + 2Н2О. Саме з цієї причини кислоту не можна зберігати в скляному посуді. Її зберігають у флуоропластикових ємностях. Солі флуоридної кислоти називаються флуоридами. Більшість їх отримують дією розчину НF на оксиди, гідроксиди, карбонати тощо. Наприклад: 2HF + Zn(ОН)2 → ZnF2 + 2H2O. Усі флуориди, крім флуоридів натрію, калію, рубідію, цезію та амонію малорозчинні у воді. Слід відмітити, що АgF, на відміну від інших галогені дів Аргентуму, у воді розчиняється добре. Флориди неметалів та вищі флуориди металів одержують реакцією фторування простих речовин: 2Аu + 3F2 = 2АuF3, 2Ві + 5F2 = 2ВіF5, Р4 + 10F2 = 4РF5. Флуорид-йон здатний утворювати досить стійкі флуорокомплекси. Так, РF5, одержаний згідно з останньою реакцією, приєднуючи флуорид-йон, утворює гексафлуорофосфат (V) – йон: РF5 + F− = [РF6]−. Флориди, до складу яких входять елементи з вищими ступенями окиснення, як правило, сильно гідролізують. Флуориди, як і фтороводень, отруйні. Іноді флуориди, подібно до оксидів, поділяють на основні, кислотні й амфотерні. Під час взаємодії кислотних флуоридів з основними утворюються комплексні сполуки, при цьому елемент кислотного флуориду входить до складу комплексного аніона: 2NaF + SiF4 = Na2[SiF6]; Гексафторосилікат (ІV) натрію KF + SbF5 → K[SbF6]. Гексафторостибат(V) калію Амфотерні фториди A1F3 здатні взаємодіяти як з основними, так і з кислотними фторидами: A1F3 + 3KF → K3[A1F6]; Гексафтороалюм (ІІІ) калію 2A1F3 + 3SiF4 → Al2[SiF6]3. Гексафторосилікат (ІV) алюмінію Серед оксигеновмісних сполук Флору найбільше вивчені дифлоурид Оксигену ОF2 та дифлуорид диоксигену О2F2. Перший отримують, пропускаючи фтор крізь розведений розчин гідроксиду натрію: 2F2 + 2NaOH = 2NaF + OF2 + H2O. OF2 − світло-жовтий, дуже реакційно здатний газ. О2F2 отримують дією електричного розряду на суміш кисню з фтором. Усі флуориди оксигену термодинамічно нестійкі та характеризуються сильними окисними властивостями. OF2 — сильний окисник, здатний окиснювати водень, Нітроген аміаку: 2Н2+ OF2 = 2HF + H2O; 4NH3 + 3OF2 = 2N2 + 6HF + 3Н2О. Флуор і його сполуки знаходять широке застосування. Велику кількість фтору переробляють на гексафторид урану, який використовують для розділення ізотопів Урану. Багато фтору йде на фторування органічних сполук, синтез різних холодоагентів (фреонів), добування фторопластів, зокрема тефлону. Суміш зріджених фтору, кисню та озону (до 60 % О3) є енергійним окисником ракетних палив. Плавикову (флуоридну) кислоту використовують для травлення скла і видалення піску з металічного литва, для розкладання різних силікатів, у хімічному аналізі. Хлор у природі. Добування і властивості хлору. Хлор — типовий неметал. Як для сильно електронегативного елемента для Хлору характерний ступінь окиснення -1 (НС1, NaCl, KC1 тощо). У сполуках із більш електронегативними елементами — Флуором, Оксигеном, Нітрогеном — Хлор виявляє позитивні ступені окиснення: +1 (гідрохлорити NaClO, КС1О тощо), +3 (хлорити КСlО2, NaC1О2 тощо), +5 (хлорати КС1О3, NaC1О3), +7 (перхлорати КСlО4, NaC1О4). Хлор належить до досить поширених елементів (0,02 ат. %). Трапляється він у зв'язаному стані у вигляді хлоридів — солей хлоридної кислоти. Найпоширенішими мінералами Хлору є кам'яна сіль NaCl (галіт), сильвін КС1, сильвініт КС1·NaCl, карналіт КС1·MgCl2·6Н2О. Велика кількість хлоридів міститься в морській воді, входить до складу живих організмів. У природних сполуках Хлор перебуває у вигляді нуклідів 35С1 (75,53 %) і 37С1 (24,47 %). Радіоактивні нукліди 33С1,34С1,36С1,38С1 і 39С1 добуто штучно. Хлор — елемент, необхідний для підтримки життєдіяльності живих організмів. Хлорид натрію NaCl входить до складу плазми крові, хлоридна кислота є складовою частиною шлункового соку. У промисловості хлор як просту речовину добувають електролізом водного розчину хлориду натрію. Невеликі кількості хлору можна добути в лабораторних умовах, окиснюючи хлороводень або хлориди за наявності кислоти. Здебільшого окисниками є оксиди або солі металів у вищих ступенях окиснення: 2КМnО4 + 16НС1 = 5С12↑ + 2КС1 + 2МnС12 + 8Н2О; 2KMnO4 + 10NaCl + 8H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 5Cl2↑ + 8H2O. Хлор у лабораторних умовах добувають в апараті Кіппа з хлоридної кислоти і хлорного вапна (як окисника): 4НС1 + СаОС12 → СаС12 + 2С12 + 2Н2О. Молекула хлору С12 досить міцна (енергія її дисоціації становить 239 кДж/моль) за рахунок додаткового π-зв'язування. Розщеплення молекули С12 на атоми стає помітним лише за температури вищої від 1000 °С або в разі прямого сонячного освітлення. Хлор — жовто-зелений газ з різким запахом, температура плавлення його становить -101 °С, температура кипіння -34 °С, отруйний. Вдихання хлору спричинює подразнення слизових оболонок. Хлор добре розчиняється у воді. За наявності NaCl розчинність хлору знижується. Хлорна вода (розчин хлору у воді) зберігає запах і забарвлення газоподібного хлору. Під час розчинення хлору у воді відбувається його гідратація; гідрат хлору С12·8Н2О можна виділити у вигляді зелено-жовтих кристалів у процесі охолодження хлорної води. У хімічному відношенні хлор активний окисник. Він безпосередньо сполучається майже з усіма металами. Наприклад, нагрітий натрій згоряє в атмосфері хлору з утворенням хлориду: 2Nа + Сl2 = 2NаСl. Якщо метал виявляє декілька ступенів окиснення, то він окислюється хлором до максимального ступеня, наприклад: 2Fе + 3Сl2 = 2FеСl3. Хлор взаємодіє також з багатьма неметалами. Так, водень горить у хлорі, утворюючи хлороводень: Н2 + Сl2 Реакція перебігає бурхливо, але для її початку необхідно освітлювати реакційну суміш, що пов’язано з ланцюговим механізмом цієї реакції. У зв’язку з тим, що в ряду галогенів із зростанням заряду ядра зменшується окисна активність, хлор здатний витісняти бром та йод із їх сполук з Гідрогеном та металами. Цю властивість хлору використовують для одержання брому та йоду в промислових умовах: 2КВr + Сl2 = Вr2 + 2КСl, 2NаІ + Сl2 = І2 + 2NаСl. З киснем, азотом та благородними газами хлор безпосередньо не взаємодіє. Хлор активний окисник: 2Fe+2Cl2− + Сl20 = 2Fe+3Cl3; 2К2Мn+6О4 + С120 = 2КМn+7О4 + 2КС1− Відновні властивості хлор виявляє лише під час взаємодії з фтором перебігові яких сприяє лужне середовище: С12 + 2КОН → КС1 + КСlО + Н2О. Хлорид гідрогену. Хлоридна кислота. Для Хлору ступінь окиснення −1 є найстійкішим, він виявляється в хлороводні і хлоридах. У промисловості НСl добувають синтезом із простих речовин: Н2º + Сl2º = 2Н+1Сl-1. Значно меншу кількість НСl одержують дією концентрованої сульфатної кислоти на кристалічний натрій хлорид: 2NаСl + Н2SО4(к.) = НСl + Nа2SО4 Хлороводень за звичайних умов — це безбарвний газ з температурою кипіння -84,9 °С і температурою плавлення -114,2 °С, з різким запахом Хлороводень за звичайних умов — це безбарвний газ з температурою кипіння -84,9 °С і температурою плавлення -114,2 °С, з різким запахом, подразнює органи дихання, не горить, не підтримує горіння. У вологому повітрі хлорид гідрогену димить, утворюючи з водяною парою дрібні краплини хлоридної кислоти. Хлорид гідрогену добре розчиняється у воді (1 об'єм Н2О за температури 20 °С поглинає близько 450 об'ємів НС1). Водний розчин НС1 — сильна одноосноосновна хлоридна (соляна) кислота. Концентрована хлоридна кислота містить 37% НС1, густина її становить 1,19 г/см3. Таку кислоту інакше називають димучою хлоридною кислотою. Транспортують її у великих скляних бутилях. Солі хлоридної кислоти називаються хлоридами. Хлоридна кислота активна, вона розчиняє метали, що стоять лівіше водню в електрохімічному ряді напруг. Роль окисника металів виконує катіон Н+. В результаті таких реакцій утворюються хлориди металів і виділяється водень: Fеº + Н+1Сl = Fе+2Сl2 + Н2º. Під час взаємодії з сильними окисниками хлоридна кислота виявляє відновні властивості, наприклад: Мn+4О2 + 4НСl-1 = Мn+2Сl2 + Сl2° + 2Н2О. Як сильна мінеральна кислота, НСl виявляє всі властивості кислот: взаємодіє з основами, основними та амфотерними оксидами, амфотерними гідроксидами, деякими солями, витісняє слабкі кислоти з боратів, силікатів, карбонатів, фосфатів металів. Солі хлоридної кислоти добре розчиняються у воді, за винятком солей аргентуму AgCl, купруму (І) CuCl, плюмбуму РbС12, талію (І) Т1С1 та меркурію (I) Hg2Cl2. Властивості хлоридів залежно від характеру хімічного зв'язку закономірно змінюються за групами і періодами періодичної системи, наприклад: Елемент Na Mg Al Si P S Хлорид NaCl, MgCl2 A1C13 SiCl4, PC15, SC14 Хімічна природа Основні Амфотерні Кислотні Хлориди з йонним зв'язком між атомами — це кристалічні речовини з високими температурами плавлення, з ковалентним — гази, рідини або легкоплавкі тверді речовини, хлориди з йонно-ковалентним зв'язком займають проміжне положення. Основні хлориди не гідролізують на відміну від кислотних, які гідролізують практично повністю: РС15 + 4НОН = Н3РО4 + 5НС1. Кислотні хлориди називаються хлорангідридами. Основні і кислотні хлориди здатні взаємодіяти між собою; основні хлориди є донорами пар електронів за рахунок йонів Сl, кислотні хлориди — акцепторами пар електронів, наприклад: 2NaCl + ТіСl4 → Na2[TiCl6]. Гексахлоротитанат (ІV) натрію Амфотерні хлориди взаємодіють як з кислотними, так і з основними хлоридами: 2NaCl + ZnCl2 = Na2[ZnCl4]; Тетрахлороцинкат натрію ZnCl2 + ТіСl4 = Zn[TiCl6]. Гексахлоротитанат цинку Хлор безпосередньо з киснем не взаємодіє, що зумовлено невеликою енергією зв'язку Сl—О і неможливістю використати високі температури для здійснення такої реакції. Непрямим способом добуто ряд сполук Хлору з Оксигеном, але всі вони нестійкі. У оксигеновмісних сполуках Хлор виявляє різноманітні ступені окиснення від +1 до +7. Найбільш важливими та цікавими є кисневмісні кислоти та їх солі. Оксиди вивчені значно менше, головним чином внаслідок їх нестійкості.
Оксигеновмісні сполуки хлору
Сl2О – отруйний, жовто-бурий газ із різким запахом хлору, легко зріджується при температурі +3°С. Оксид хлору (І) – ендотермічна сполука, легко розкладається з вибухом: 2С1+12О2- → 2С12º + О2º. Добувають Сl2О дією на окисид ртуті хлором: HgO + 2С12 = HgCl2 + С12О. Оксид хлору (І) – сильний окисник, у присутності таких відновників, як сірка, фосфор, органічні речовини – вибухає: Sº + 2С12+1О → S+4О2 + 2Сl2º. У воді Сl2О розчиняється з утворенням гіпохлоритної (хлорнуватистої) кислоти: С12О + Н2О → 2НСlО. Гіпохлоритна кислота утворюється також при гідролізі хлору: С12º + Н2О → НС1-1 + НСl+1О. Гіпохлоритна кислота НСlО — дуже слабка, слабкіша за Н2СО3 (К = 5·10-8) і надзвичайно нестійка. Розбавлений розчин її поступово розкладається, в цьому разі відбуваються перетворення, які можна розділити на три типи: 1) реакція внутрішньомолекулярного окиснення-відновлення: НСlО = НС1 + О; 2) реакція розкладу: 2НС1О = Н2О + С12О; 3) реакція самоокиснення-самовідновлення: 3НСlО → 2НС1 + НСlО3. Кожному типу перетворень відповідають певні умови, змінюючи які, можна провести реакцію практично цілком у якому-небудь одному напрямку. Під дією світла відбувається реакція згідно з рівнянням (1), за наявності зневоднювальних сполук — реакція (2), у разі нагрівання — реакція (3). Тому під час пропускання хлору в холодний і гарячий розчини гідроксиду калію реакції відбуваються за різними рівняннями: 2КОН (хол.) + С12 → КС1 + КСlО + Н2О; 6КОН (гар.) + 3С12 → 5КС1 + КС1О3 + 3Н2О, тобто в гарячому розчині КОН замість гіпохлориту калію КСlО утворюється хлорат КСlО3. Гіпохлоритна кислота — сильний окисник. Завдяки утворенню НСlО під час взаємодії хлору з водою виявляються вибілювальні властивості хлору (сухий хлор не вибілює). Внаслідок взаємодії хлору з гідроксидом кальцію утворюється хлорне, або білильне, вапно — змішана сіль хлоридної і гіпохлоритної кислот: Са(ОН)2 +С12 → Са(ОС1)С1 + Н2О. Хлорне вапно — це білий порошок з різким запахом, має сильні окиснювальні властивості. Його використовують для вибілювання тканин, паперу, для дезінфекції. Під дією оксиду карбону (ІV) у вологому повітрі хлорне вапно розкладається з виділенням гіпохлоритної кислоти НСlО, яка і вибілює рослинні волокна: 2СаОС12 + СО2 + Н2О = СаСО3↓ + СаСl2 + 2НС1О. Хлоритна кислота НС1О2 утворюється у водному розчині взаємодією суспензії бірій хлориду з сульфатною кислотою з наступним відділенням сульфату барію фільтруванням: Ва(СlО2)2 + Н2SО4 = 2НСlО2 + ВаSО4↓ Хлоритна кислота (НС1О2) існує тільки у водних розчинах, є кислотою середньої сили. Навіть у розведеному водному розчині вона швидко розкладається:
Ангідрид хлоритної кислоти невідомий. Практичного значення хлоритна кислота не має. Її солі – хлорити більш стійкі, ніж сама кислота. Хлорити у кислому середовищі виявляють сильні окисні властивості. Але при взаємодії з більш сильними окисниками (Сl2, КмnО4, К2Сr2О7 тощо) – сама окиснюється до хлоратної кислоти або її солей. Хлоратна кислота НСlО3 існує лише у водному розчині. Це сильна одноосновна кислота, близька до НСl та НNО3. Одержують її дією розведеної сульфатної кислоти на хлорати: Ва(СlО3)2 + Н2SО4 = 2НСlО3 + ВаSО4↓ Хлоратна кислота має сильні окисні властивості. Концентровані розчини її запалюють деревину, окислюють такі речовини, як Н2S, SО2 та ін.: 3SО2 + НСlО3 + 3Н2О = НСl + Н2SО4. Солі хлоратної кислоти називають хлоратами. Найбільше значення має калій хлорат КСlО3 (бертолетова сіль). Її одержують, пропускаючи хлор крізь гарячий концентрований розчин калій гідроксиду: 3С12 + 6КОН = КСlО3 + 5КСl + 3Н2О. Хлорат калію під час нагрівання за наявності каталізатора (МnО2) легко розкладається: 2КСlО3 Суміші бертолетової солі з різними горючими речовинами здатні вибухати під впливом удару. Тому бертолетову сіль застосовують для виготовлення запалів, у піротехніці, сірниковій промисловості. У разі нагрівання хлорату калію без каталізатора він розкладається згідно з рівнянням: 2 КСlО3 = 3КСlО4 + КС1. Водні розчини хлоратів мають незначну окисну активність, тоді як тверді хлорати – дуже сильні окисники. Калій хлорат у лужному середовищі в розплаві здатний окиснювати такий окисник як МnО2: 3МnО2 + КСlО3 + 6NаОН = 3Nа2МnО4 + КСl + 3Н2О. Оксид хлору (VІІ) Сl2О7 – найбільш стійкий з усіх оксидів хлору. Це безбарвна масляниста рідина, вибухонебезпечна при нагріванні. Внаслідок значної стабільності Сl2О7 з водою реагує повільно з утворенням перхлоратної кислоти: Сl2О7 + Н2О = 2НСlО4. Перхлорат на кислота НСlО4 найбільш стійка з оксигеновмісних кислот хлору. Це безбарвна, димуча на повітрі рідина. Перхлорат на кислота з масовою часткою 100 % малостійка, в той час як її водні розчини стабільні. НСlО4 нарівні з НІ, є найсильнішою з відомих кислот. Безводна НСlО4 – сильний окисник, але у водних розчинах її окисні властивості слабкіші ніж у хлоратної кислоти. Водночас у разі нагрівання у твердому стані перхлорати поводяться як дуже сильні окисники і розкладаються з утворенням кисню: НСlО4 Майже всі перхлорати добре розчинні у воді (за винятком солей калію, рубідію та цезію). Порівнюючи оксигеновмісні кислоти хлору за окиснювальними властивостями і силою, можна зробити висновок: зі збільшенням ступеня окиснення Хлору сила кислоти зростає, а окиснювальна здатність зменшується:
НСlО НС1О2 НСlО3 НС1О4 Посилення окиснювальної здатності кислоти
Бром. Йод. Властивості сполук брому і йоду. Бром і Йод — повні аналоги. Завдяки наявності одного неспареного електрона на останньому енергетичному рівні (s2p5) Бром і Йод дуже подібні до Флуору і Хлору. У сполуках Бром і Йод виявляють ступені окиснення -1, 0, +1, +3, +5, стійкими є також сполуки Йоду (VІІ). Однак найбільш характерними є ступені окиснення -1 і +5. Бром і Йод досить поширені елементи на Землі. Бром і Йод трапляються у морській воді, у водах деяких озер у вигляді бромідів калію, магнію, натрію; Йод здебільшого нагромаджується у тканинах деяких водоростей. Значна кількість Йоду є в підземних бурових водах; у вигляді солей КІО3 і КІО4 він міститься у покладах селітри в Чилі і Болівії. В організм людей і тварин Йод надходить з водою та рослинною їжею і накопичується в основному у щитовидній залозі. У разі нестачі Йоду розвивається захворювання — зоб. Щоб запобігти йому, необхідно добавляти у воду для пиття йодовмісні сполуки. У разі вдихання простої речовини брому подразнюються слизові оболонки. Бром спричинює появу опіків і виразок на шкірі. Розчинність простих речовин брому і йоду у воді порівняно невелика, краще вони розчиняються в органічних розчинниках. За наявності розчинів КВr та КІ розчинність брому і йоду зростає, що пояснюється хімічною взаємодією брому і йоду з відповідними галогенідами, внаслідок якої утворюються полігалогеногалогеніди типу КІ3, КІ5 і навіть КІ9. Бром і йод можна добути аналогічно хлору окисненням бромоводню та йодоводню різними окисниками, наприклад: К2Сr2О7 + 6КІ + 7H2SO4 = 4K2SO4 + Cr2(SO4)3 + 3І2 +7H2O. Оскільки хлор сильніший окисник, під час добування брому і йоду часто як окисник використовують хлор: 2КВr + С12 = 2КС1 + Вr2. Витіснення брому та йоду хлором застосовують не тільки в лабораторних, а й у заводських масштабах. Йод добувають з йодидів, що містяться в нафтових водах, фільтруючи їх крізь шар хлориду аргентуму. Оскільки розчинність AgІ нижча, ніж AgCl, то розчинні йодиди внаслідок взаємодії з сіллю Аргентуму, осаджуються: AgCl + КІ → AgІ + КС1. Розкладаючи йодид аргентуму, добувають вільний йод. Бром – темно-червона рідина з різким подразнюючим запахом. Слово „бромос” грецькою мовою означає „сморідний”. Температура кипіння брому +58,8 ºС, плавлення - +7,2 ºС. Йод – це чорно-сіра тверда речовина з металічним блиском. Він легко сублімується, утворюючи фіолетову пару, яка складається з молекул І2. Молекули брому та йоду неполярні, в зв’язку з цим легко розчиняються в неполярних розчинниках (бензолі, сірковуглеці, хлороформі), утворюючи червоні (Вr2) і фіолетові (І2) розчини. Цим користуються при їх промисловому добуванні та в аналітичній хімії для екстракції їх з води у розчинники, які не змішуються з водою. Бром та йод – достатньо сильні окисники, однак їх активність значно нижча за активність фтору і хлору. З багатьма металами і неметалами бром взаємодіє за звичайної температури, а йод – при нагріванні. Вони безпосередньо не реагують з киснем, азотом, вуглецем та благородними газами. Особливо чітко зменшення хімічної активності у групі галогенів зверху вниз виявляється при взаємодії брому та йоду з воднем:
Так, якщо взаємодія фтору з воднем відбувається з вибухом на холоді, хлор при кімнатній температурі при освітленні, то бром з воднем реагує при значному нагріванні, а реакція йоду з воднем навіть при нагріванні перебігає не до кінця – в системі встановлюється рівновага. У зв’язку з цим НВr і НІ як правило одержують гідролізом броміду та йодиду фосфору (ІІІ): РГ3 + 3Н2О = 3НГ + Н2[РНО3]. Бромід та йодид гідрогену за звичайних умов газоподібні. У водному розчині вони утворюють сильні кислоти – бромідну (НВr) та йодидну (НІ). Солі бромідної і йодидної кислт називають бромідами і йодидами. У ряду HF—НС1—НВr—НІ сила кислот зростає. У такій самій послідовності зменшується стійкість молекул кислот і збільшується їхня відновна активність. Збільшення кислотності в цьому ряду пояснюється зменшенням міцності хімічного зв’язку молекул галгеноводнів внаслідок і Гідрогену. Цей фактор є домінуючим, незважаючи на те, що полярність газоподібних молекул в ряду HF—НС1—НВr—НІ значно зменшується. Однак коли газоподібний галогеноводень потрапляє у воду, протони перетворюються на іони гідроксонію Н3О+. Це значно ізолює їх від аніонів. Взаємна поляризація Гідрогену та галогену зменшується. Таким чином, незважаючи на найбільш ковалентний характер зв’язку в газоподібному НІ, його розчин у воді є найсильнішою мінеральною кислотою. Відновна активність галогенід – йонів також збільшується від F- до І-. Наприклад, НF і НСl з концентрованою сульфатною кислотою не взаємодіють, НВr відновлює Н2SО4 до SО2, а НІ навіть до Н2S. 2HBr + H2SO4 = Вr2 + SO2 + 2Н2О; 8НІ + H2SO4 = 4І2 + H2S + 4Н2О. Тому на відміну від HF і НС1 бромоводень і йодоводень добувають гідролітичним розкладанням бромідів і йодидів фосфору, а не взаємодією бромідів і йодидів калію з концентрованою H2SO4: РІ3 + 3НОН = Н3РО3 + 3НІ; РВr3 + 3НОН = Н3РО3 + 3НВr. Броміди і йодиди, подібно до фторидів і хлоридів, можуть бути основними, амфотерними і кислотними. Кислотні броміди і йодиди здатні гідролізувати повністю: ВВr3+ 3НОН = Н3ВО3 + 3НВr; РІ3 + 3НОН = Н3РО3 + 3НІ. Більшість бромідів та йодидів добре розчиняється у воді. Винятком є AgBr, AgІ, CuBr, CuІ, PbBr2, PbІ2 і деякі інші. Для Брому і Йоду також відомі оксигеновмісні сполуки, в яких галогени виявляють ступені окиснення +1, +3, +5, +7. Так, під час взаємодії галогенів з холодними розчинами лугів утворюється суміш галогенідів і солей гіпогалогенітних кислот: Вr2º + 2КОН = КОВr+1 + КВr-1 + Н2О; І2º + 2КОН = КОІ+1 + КІ-1 + Н2О. Кислоти НВrО та НІО, що називаються гіпобромітною і гіпойодитною, у вільному стані нестійкі, дуже швидко розкладаються, належать до слабких кислот. У ряду НС1О—НВrО—НІО їх сила зменшується. Кислоти НВrО і НІО у водному розчині піддаються диспропорціонуванню (особливо швидко ця реакція йде для НІО): 3НІ+1О = 2НІ-1 + НІ+5О3, а далі процес відбувається з утворенням вільного йоду: НІ+5О3+5НІ-1 = 3І2º+3Н2О. Кислоти НС1О, НВrО, НІО належать до сильних окисників: 5НС1+1О + І2º + Н2О = 5НС1-1 +2НІ+5О3. Окиснювальна активність кислот у ряду НС1О—НВrО—НІО послаблюється. Солі НВrО та НІО називаються гіпобромітами та гіпойодитами, вони стійкіші, ніж відповідні кислоти. У водних розчинах за кімнатної температури ці солі піддаються повільному диспропорціонуванню, в разі нагрівання швидкість реакції зростає: 3КІ+1О = 2КІ-1 + КІ+5О3. У ступні окислення +3 оксигеновмісні кислоти Брому та Йоду невідомі, так як при спробі їх одержання вони миттєво диспропорціонують з утворенням галогенід- та галогенат-йонів. Бром та Йод у ступені окислення +5 утворюють відповідно ароматну НВrО3 та йодатну НІО3 кислоти. Це сильні кислоти. НВrО3 існує лише у розчинах, а НІО3 виділена у вільному стані. Одержують НВrО3 шляхом окислення бромної води хлором: Вr2 + 5Сl2 + 6Н2О= 2НВrО3 + 10НСl НІО3 одержують окисленням твердого йоду нітратною кислотою з масовою часткою 96%: І2 + 10НNО3 = 2НІО3 + 10NО2 + 4Н2О. У вільному стані броматна кислота нестійка, вона розкладається на Вr2, О2 і Н2О. Йодатна кислота НІО3 — стійка кристалічна сполука, розкладається лише під час нагрівання з утворенням йодатного ангідриду І2О5 і Н2О (для НСlО3 та НВrО3 ангідридів не виявлено). Йодатний ангідрид виявляє окисні властивості, у разі нагрівання до температури 300 °С розкладається на йод і кисень. Кислоти НСlО3, НВrО3, НІО3 належать до сильних одноосновних кислот. У ряду НСlО3—НВrО3—НІО3 сила кислот послаблюється. В такій самій послідовності послаблюються й окисні властивості цих кислот. Солі – бромати та йодати – утворюються внаслідок нейтралізації їх кислот лугами, наприклад: НІО3 + КОН = КІО3 + Н2О. Бромати і Йодати сильні окисники. Так, при окисненні бромід-йонів бромат-йонами у кислому середовищі утворюється вільний бром: 5КВr + КВrО3 + 3Н2SО4 = 3Вr2 + 3К2SО4 + 3Н2О. Аналогічна реакція відбувається за участю йодид- та йодат-йонів. Оксиди брому та йоду в інших ступенях окислення практичного значення не мають. У вільному стані перброматна кислота НВrО4 не виділена. Вона відома лише у водному розчині, за силою наближається до перхлоратної кислоти. Пербромати утворюються при окисленні броматів фтором у лужному середовищі: NаВrО3 + F2 + 2NаОН = NаВrО4 + 2NаF + Н2О. Пербромати мають дуже сильні окисні властивості. Окисленням йод атів хлором у лужному середовищі добувають солі перйодатної кислоти: NаІО3 + Сl2º + 2NаОН = NаІО4 + 2NаСl + Н2О. Перйодатна кислота кристалізується з водного розчину двома молекулами води НІО4·2Н2О. Практично добуто солі Nа5ІО6 та Аg5ІО6, тому можна вважати, що НІО4·2Н2О не кристалогідрат, а ортоперйодатна кислота. Н5ІО6. Кислотні властивості перйодатної кислоти НІО4 значно слабкіші, а окиснювальні — сильніші, ніж перхлоратної кислоти НС1О4. Оксид йоду(VІІ) І2О7 не добуто. Під час нагрівання Н5ІО6 розкладається: 2Н5ІО6 = І2О5 + О2↑ + 5Н2О. Внаслідок взаємодії броматів із вільним фтором також утворюються сполуки Брому з найвищим ступенем окиснення. NaBrO3 + F2 + 2NaOH = NaBrO4 + 2NaF + H2O. Сполуки Брому і Йоду знаходять широке застосування. У більшості органічних синтезів використовуються бром та йод, бромід і йодид фосфору, йодоводень. Бромід аргентуму застосовується у фотосправі. Із солей бромідної НВr кислоти важливим є бромід натрію, який використовується у медицині як заспокійливий засіб для лікування нервових хвороб. Під назвою «білий йод» у медицині застосовуються також йодиди натрію і калію.
Лабораторна робота
Дослід 1. Одержання хлору (під тягою!) а) Помістити у пробірку 2-3 кристали перманганату калію і поставити її у штатив. Обережно додати декілька крапель концентрованої соляної кислоти. Який газ виділяється (визначити по запаху і по кольору)? Написати рівняння реакції. б) У пробірку насипати трохи дихромату калію і додати 5-10 крапель концентрованої соляної кислоти. Суміш злегка підігріти. Що спостерігається? Написати рівняння реакції. Дослід 2. Одержання водневих сполук галогенів У пробірку з газовідвідною трубкою помістіть 2-3 мікрошпателі хлориду натрію, додайте 3-4 краплі концентрованої сірчаної кислоти та обережно нагрійте. До отвору газовідвідної трубки послідовно піднесіть зволожений синій лакмусовий папір та скляну паличку, попередньо змочену в розчині аміаку. Поясніть, що спостерігається. Напишіть рівняння реакцій. Дослід 3. Порівняння відновних властивостей гідрогеновмісних (під тягою!) У три пробірки внесіть по 1-2 мікрошпателі: у першу — хлориду натрію, у другу — броміду калію, у третю — йодиду калію та додайте по 2-4 краплі концентрованої сірчаної кислоти. Спостерігайте появу білого диму галогеноводнів в першу мить в усіх пробірках. Відмітьте через деякий час зміну забарвлення кольору парів у другій та третій пробірках. Напишіть рівняння окислювально-відновних реакцій між утвореними НВr та НІ і надлишком концентрованої
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 494; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.227.192 (0.013 с.) |

 HF + Н2О Н3О+ + F−;
HF + Н2О Н3О+ + F−; 2НСl.
2НСl. 3НСl+3О2 НС1-1 + 2НСl+5О3.
3НСl+3О2 НС1-1 + 2НСl+5О3. 2КС1 + 3О2↑.
2КС1 + 3О2↑.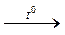 КСl + 2О2↑
КСl + 2О2↑ Підвищення стійкості і сили кислоти
Підвищення стійкості і сили кислоти Н2 + Г2 2НГ
Н2 + Г2 2НГ


