
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 6. Станум, плюмбум та їх сполукиСодержание книги
Поиск на нашем сайте
Основні теоретичні положення
Германій, станум, плюмбум — належать до малопоширених елементів. Найважливішими мінералами Стануму і Плюмбуму є SnO2 — олов'яний камінь (каситерит) та PbS — свинцевий блиск (галеніт). Германій добувають відновленням оксиду германію (ІV) воднем при температурі 800 – 1000 °С: GеO2 + 2Н2 = Gе + 2Н2O. Для добування олова і свинцю (простих речовин стануму і плюмбуму) спочатку збагачують руду методом флотації. Олово добувають за реакцією: SnO2 + 2С = Sn + 2СО↑. Під час добування свинцю спочатку випалюють його сульфід: 2PbS + 3О2 = 2РbО + 2SO2. Оксид плюмбуму (ІІ), що утворився, відновлюють оксидом карбону (ІІ), що є продуктом неповного окиснення коксу: РbО + CO = Pb + СО2. Германій – це крихка речовина сріблясто-сірого кольору, схожа на метал. Олово – сріблясто-білий легкоплавкий метал. За звичайних умов існує у вигляді стабільної β-модифікації (біле олово), яке за низької температури поступово переходить у алмазоподібну α-модифікацію (сіре олово). Перехід β-Sn → α-Sn прискорюється у присутності деякої кількості α-Sn, частинки якого діють як центри кристалізації. Протягом цього переходу метал перетворюється на сірий порошок із значним збільшенням питомого об’єму. Олов’яні вироби при цьому практично розсипаються. Це явище здобуло назву «олов’яної чуми». Чистий свинець—це голубувато-білий метал з характерною для металів кубічною гранецентрованою структурою. Зміна структури простих речовин у ряду Ge — Sn— Pb відповідає зміні їхніх фізичних властивостей. Ge і α-Sn — напівпровідники, a β-Sn і Pb — метали. Посилення металічних властивостей у ряду Ge — Sn — Pb зумовлює також зміну хімічних властивостей цих елементів. Найвищий ступінь окиснення елементів Ge, Sn, Pb дорівнює +4. Із збільшенням протонного числа елемента зростає стабільність елементів зі ступенем окиснення +2. Отже, для германію й стануму характернішим є ступінь окиснення +4, а для плюмбуму — +2. Саме цим можна пояснити той факт, що сполуки германію (ІІ) і стануму(ІІ) — сильні відновники, а сполуки плюмбуму (ІV) — сильні окисники. За звичайних умов усі три речовини стійкі по відношенню до води та повітря. На поверхні свинцю знаходиться матова оксидна плівка, яка захищає його від подальшого окиснення. Германій і олово при підвищеній температурі окислюються киснем до вищих оксидів: Ge + O2 = GeO2; Sn + O2 = SnO2. У цих умовах свинець окислюється до оксиду плюмбуму (ІІ): 2Pb + O2 = 2PbO. В електрохімічному ряді напруг германій розміщений за воднем, тому з кислотами-неокисниками не взаємодіє. Олово і свинець розміщені безпосередньо перед воднем, тому олово повільно розчиняється в розведеній НСl: Sn + 2HC1 = SnCl2 + H2↑. З концентрованою НСl воно реагує легко: Sn + 4HC1 = H2[SnCl4]+ H2↑. Свинець у розведених хлорид ній і сульфатній кислотах практично не розчиняється внаслідок утворення на його поверхні малорозчинних PbCl2 і PbSO4. Як і олово, свинець краще розчиняється у концентрованій хлорид ній кислоті, оскільки при цьому утворюється розчинна у воді комплексна сполука: Pb + 4HC1 = H2[PbCl4]+ H2↑. Розведена і концентрована нітратна кислота по-різному діє на германій, олово і свинець. У розведеній HNO3 олово, утворюючи нітрат стану му (ІІ), виявляє металічні властивості: 3Sn + 8HNO3 = 3Sn(NO3)2 + 2NO↑ + 4H2O. Свинець взаємодіє з HNO3 будь-якої концентрації як метал, і утворює внаслідок реакції сіль Pb(NO3)2: 3Pb + 8HNO3(р.) = 3Pb(NO3)2 + 2NO↑ + 4H2O. Посилення металічних властивостей у ряду Ge — Sn — Pb виявляється під час взаємодії цих речовин з концентрованою нітратною кислотою: Ge + 4HNO3 = GeO2 + 4NO2↑ + 2H2O; Sn + 4HNO3 = H2SnO3 + 4NO2↑ + H2O; (H2SnO3 - β-станатна кислота) Pb + 4HNO3 = Pb(NO3)2 + 2NO2↑ + 2H2O. Концентрована сульфатна кислота окиснює Ge до GeO2: Ge + 2H2SO4(к.) Олово в концентрованій H2SO4 утворює: Sn + 4 H2SO4(к.) Свинець в концентрованій H2SO4 розчиняється з утворенням розчинної кислої солі: Pb + 3 H2SO4(к.) = Pb(НSO4)2 + SO2↑ + 2H2O. Концентровані луги здатні розчиняти олово з утворенням станітів і виділенням водню: Sn + 2NaOH = Na2SnO2 + Н2↑. У водних розчинах станіти існують в гідратованій формі Na2[Sn(OH)4]. Свинець у лугах розчиняється повільно; інтенсивніше відбувається розчинення в розбавлених розчинах лугів за підвищеної температури. У цьому разі утворюються гідроксоплюмбіти: Рb + 2КОН + 2Н2О = К2[Рb(ОН)4] + Н2↑. Германій розчиняється в розчинах лугів за наявності окисників з утворенням германатів — солей германатної кислоти: Ge + 2КОН + 2Н2О2 = K2[Ge(OH)6]. За хімічними властивостями германій, олово, свинець переважно є металами. Проте з активними металами вони взаємодіють подібно до силіцію, утворюючи германіди, станіди та плюмбіди. Якщо на германіди, станіди, плюмбіди подіяти кислотою-неокисником, то можна добути газоподібні сполуки, подібні до силанів. Так, германоводень, або герман, GeH4 можна добути за реакцією: Mg2Ge + 4НСl = GeH4↑+ 2MgCl2. Одночасно з GeH4 утворюються дигерман Ge2H6 та тригерман Ge3H8. Станан SnH4 — газ, малостійка сполука. Ще менш стійким є плюмбан РbН4, який не вдалося виділити у вигляді індивідуальної речовини, а можна тільки довести, що РbН4 утворюється під час деяких реакцій. Олово і германій за звичайних умов стійкі проти дії кисню і добре зберігаються на повітрі. Тому олово використовують для покриття заліза. Для елементів підгрупи германію відомі оксиди типу ЕО, ЕО2. При нагріванні простих речовин на повітрі утворюються оксиди германію (ІV) і стануму (ІV) - GеО2 і SnO2, та оксид плюмбуму (ІІ) – PbO. Оксиди GеО і SnO менш стабільні крім PbO. Плюмбум утворює PbO2, Pb2O3 і Pb3O4 (сурик), який є сіллю ортоплюмбатної кислоти Pb2(PbO4) Оксид плюмбуму (ІV) одержують розкладанням сурику (Pb3O4) у нітратній кислоті або окисненням солей (ІІ) сильними окисниками (Сl2, СаСlО2): Рb3О4 + 4HNO3 = РbО2↓ + 2Pb(NO3)2 + 2Н2О. Рb(СН3СОО)2 + СаОС12 + Н2О = РbО2↓ + СаС12 + 2СН3СООН. Усі оксиди елементів підгрупи Германію малорозчинні у воді, тому відповідні їм гідроксиди можна одержати непрямим шляхом. Оксиди у нижчому ступені окиснення амфотерні, хоча легше взаємодіють з кислотами, що свідчить про перевагу їх основного характеру: SnО + HС1 = SnС12 + H2O, PbО + H2SO4 = PbSO4 + H2O. Ці оксиди також розчиняються у водних розчинах лугів: PbО + 2КОН + H2O = К2[Pb(OH)4]. Гідроксиди германію, стануму та плюмбуму у ступені окиснення +2 одержують дією розведених лугів на відповідні водорозчинні солі: SnС12 + 2NаОН = Sn(ОН)2↓ + 2NаС1, Pb(NO3)2 + 2NаОН = Pb(ОН)2↓ + 2NаNO3. Гідроксиди Е(ОН)2 амфотерні. У Gе(ОН)2 переважають кислотні властивості, у Pb(ОН)2 – основні, він розчиняється в кислотах, з утворенням солей плюмбуму (ІІ) та тільки в концентрованих розчинах лугів, з утворенням гідроксоплюмбітів. Pb(ОН)2 + 2HС1 = PbС12 + H2O, 2Pb(ОН)2 + 2NаОН = Nа2[Pb(OH)4]. З оксидів і гідроксидів германію, стануму і плюмбуму можна добути солі, діючи на них кислотами: у кислому середовищі найлегше утворюються солі двовалентних металів. Солі Германію (ІІ), Стануму (ІІ) - дуже сильні відновники. Так, солі стануму (ІІ) в лужному середовищі здатні відновлювати бісмут до вільного металу:
2Bi+3(NO3)3 + 3Sn+2(NO3)2 + 18NaOH = 2Ві°↓ + 3Na2[Sn+4(OH)6] + 12NaNO3.
Ця реакція використовується в аналітичній хімії для якісного виявлення бісмуту і солей стануму (ІІ). Солі Стануму (ІІ) є сильними відновниками також і в кислому середовищі. Так SnС12 здатний відновлювати солі Мангану, Хрому, Ванадію: 3Sn+2С12 + 14HС1 + К2Сr2+6О7 = 3Sn+4Сl4 + 2Сr+3Сl3 + 2КСl + 7H2O. SnС12 – один із найпоширеніших у неорганічній та органічній хімії відновників. GеО2, SnO2, PbO2 - амфотерні оксиди, в яких переважають кислотні властивості. Вони взаємодіють з лугами з утворенням відповідно гідроксогерманатів, гідроксостанатів і гідроксоплюмбатів: GeO2 + 2КОН + 2Н2О = K2[Ge(OH)6]. Оксидам ЕО2 відповідають дуже слабкі кислоти — германатна, станатна (олов'яна) і плюмбатна. Сполуки ЕО2, що осідають з водних розчинів, завжди містять деяку кількість зв’язаної води, тому їхні формули можна записати ЕО2·хH2O. Гідратований оксид SnO2·xН2О існує в α- і β-формах. α-станатна кислота осаджується під дією лугів на розчини солей стануму (ІV): SnCl4 + 4NH4OH = H2SnО3↓ + 4NH4C1 + H2O, а β-станатна кислота — під дією концентрованої нітратної кислоти на олово: Sn + 4НNO3(конц.) = H2SnО3 + 4NO2 + H2O. α-станатна кислота розчиняється в кислотах і лугах: H2SnО3 + 4НС1 = SnCl4 + 3H2O; H2SnО3 + 2NaOH + H2O = Na2[Sn(OH)6]. β-станатна кислота не розчиняється ні в кислотах, ні в лугах. Така відмінність пояснюється тим, що β-станатна кислота має більші часточки. З часом осад α-станатної кислоти поступово перетворюється на β-станатну кислоту. PbO2 є сильним окисником, оскільки Плюмбум стійкіший у ступені окиснення +2, тому він здатний окислювати йони Мn+2 до МnО4-: 2Mn(NO3)2 + 5РbО2 + 6HNO3 = 2HMnO4 + 5Pb(NO3)2 + 2H2O. При дії концентрованої НСl на PbO2 утворюється PbСl4 – жовта важка рідина, яка легко розкладається на PbСl2 і Сl2: Pb+4O2 + 4НСl-1 = Pb+2Сl2 + Сl2° +2H2O.
Лабораторна робота
Дослід 1. Дія на олово і свинец кислот (під тягою). У три пробірки налити 1-2 мл концентрованих кислот: хлоридної, сульфатної і нітратної. У кожну пробірку вмістити по шматочку олова і спостерігати за дією кислот без нагрівання і під час нагрівання. Повторити дослід, замінивши олово на свинець. Записати відповідні рівняння реакцій. Дослід 2. Одержання і властивості гідроксидів стануму (II) і плюмбуму (II). У дві пробірки налити по 3-4 краплі розчину Аналогічно виконати дослід з розчином Написати рівняння відповідних реакцій. Зробити висновки про амфотерність добутих гідроксидів. У якого із гідроксидів Дослід 3. Відновні властивості а). До розчину тетрагідростанат (II) натрію, одержаного у досліді 2 додати по краплям б). У пробірку налити 3-4 краплі Дослід 4. Окислювальні властивості оксиду свинцю (IV). У суху пробірку внести 1 мікрошпатель діоксиду свинцю, 1 мл сульфатної кислоти і додати 4-5 крапель калій йодиду. Пробірку нагріти, дати відстоятися осаду і визначити колір розчину. Написати рівняння реакції. Контрольні запитання та задачі 1. На основі електронної будови атомів р-елементів IV групи вказати їх можливі ступені окиснення та найбільш характерні координаційні числа в сполуках. 2. Написати формули можливих оксидів та гідроксидів р-елементів IV групи та характеризувати їх кислотно-основні властивості. 3. Закінчити рівняння реакцій та підібрати коефіцієнти методом електроного балансу: а) б) в) г)
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 896; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.01 с.) |

 GeO2 + 2SO2↑ + 2H2O.
GeO2 + 2SO2↑ + 2H2O. і краплями та з перемішуванням додати розчин
і краплями та з перемішуванням додати розчин 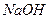 до утворення білого осаду. Потім в одну пробірку додати 2-3 краплі розчину хлоридної кислоти, у другу – надлишок 30% розчину натрій гідроксиду до повного розчинення осадів.
до утворення білого осаду. Потім в одну пробірку додати 2-3 краплі розчину хлоридної кислоти, у другу – надлишок 30% розчину натрій гідроксиду до повного розчинення осадів. . Подкислити розчин не хлоридною, а нітратною кислотою (чому?).
. Подкислити розчин не хлоридною, а нітратною кислотою (чому?). чи
чи  більш виражені амфотерні властивості?
більш виражені амфотерні властивості? та
та  .
. до утворення чорного осаду. Написати рівняння реакції.
до утворення чорного осаду. Написати рівняння реакції. , додати 5-6 крапель
, додати 5-6 крапель  і прокип’ятити розчин. Утворюється бурий осад
і прокип’ятити розчин. Утворюється бурий осад 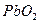 . Написати рівняння реакції.
. Написати рівняння реакції. д)
д) 
 ж)
ж) 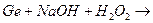
 к)
к) 
 л)
л) 



