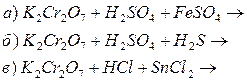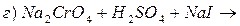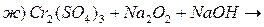Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 10. Хром та його сполукиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Основні теоретичні відомості
Хром Сr, Молібден Мо і Вольфрам W відносяться до d-елементів VI групи побічної підгрупи періодичної системи. В їх атомах добудовуються (n-1)d-підрівні. У зв’язку з тим, що електронна конфігурація d5, яка відповідає наполовину заповненому d-підрівню, є стійкою, d-елементи відповідних періодів прагнуть досягти цього стабільного d5 –стану. У Хрому і Молібдену спостерігають проскок одного електрона з ns- на (n-1)d-підрівень. У Вольфрама під зовнішнім ns- та перед зовнішнім (n-1)d-підрівнями, на яких містяться валентні електрони, знаходиться завершений 4f14 – підрівень. Цей підрівень стабілізує стан атомів без проскоку електрона. На відміну від р-елементів у d-елементів не спостерігається закономірної зміни енергії іонізації. Так, у ряді Сr—Мо—W збільшуються перший потенціали йонізації, що зумовлює послаблення металічних властивостей від Хрому до Вольфраму. Атомні та іонні радіуси Молібдену і Вольфраму близькі внаслідок лантоїдного стиску. Тому вони схожі за фізичними та хімічними властивостями, але істотно відрізняються від Хрому. Згідно з номером групи, в багатьох своїх сполуках Хром, Молібден та Вольфрам знаходяться у ступені окиснення +6, який особливо типовий для Молібдену та Вольфраму. Крім ступеня окиснення +6, Хром має стійкі сполуки у ступені окиснення +2 та +3. Як і інші d-елементи, Хром, Молібден та Вольфрам утворюють комплексні сполуки з координаційним числом 6 (рідше 4). У нижчому ступені окиснення для них більш характерні катіонні комплекси [Сr(Н2О)6]2+, на проміжному – катіонні та аніонні [Сr(Н2О)6]3+, [Сr(ОН)6]3-, а у вищому ступені окиснення – тільки аніонні СrО42-, [МоF8]2-. У природі хром та його аналоги зустрічаються виключно у зв’язаному стані. Із мінералів найбільше значення мають FеО·Сr2О3 – хромистий залізняк, РbСrО4 – крокоіт, МоS2 – молібденіт. Чистий Хром одержують відновленням Сr2О3 алюмінієм: Сr2О3 + 2Аl = 2Сr + Аl2О3. Молібден та Вольфрам відновлюють воднем з їх оксидів: МоО3 + 3Н2 = Мо + 3Н2О. Хром, Молібден та Вольфрам – білі блискучі метали. Вони дуже тверді та тугоплавкі. Вольфрам – найбільш тугоплавкий з металів, його температура плавлення +3395°С. Хоча Сr, Мо та W знаходяться у ряді напруг перед воднем і їх стандартні електродні потенціали мають від’ємне значення, вони у хімічному відношенні досить інертні, за звичайних умов стійкі по відношенню до води та кисню повітря, мало піддаються корозії завдяки утворенню на поверхні тонкої, але щільної оксидної плівки. Хімічна природа оксидної плівки значно впливає на взаємодію цих металів з кислотами. Хром реагує з розведеними НСl та H2SO4, оскільки оксидна плівка Сr2О3 має амфотерні властивості і під впливом кислот поступово руйнується: Сr + 2НС1(розб.) = СrС12 + Н2↑; Cr + 2H2SO4 (розб.) = CrSO4 + Н2↑. Молібден та Вольфрам у кислотах-неокисниках не розчиняються. Це пояснюється тим, що пасивуючі плівки на їх поверхні складаються з кислотних оксидів (МоО3, WО3). У концентрованих H2SO4 і HNO3 переходить у пасивний стан. Молібден повільно реагує з HNO3 і концентрованою H2SO4, активніше з царською водою, сумішшю HNO3 і HF. Вольфрам розчиняється тільки в суміші HNO3 і HF. Під час розчинення Мо в гарячій концентрованій H2SO4 відбувається реакція Мо + 5H2SO4(конц.) = H2[MoО2(SО4)2] + 3SO2↑ + 4Н2О. Розчинення вольфраму в суміші HNO3 і HF відбувається з утворенням міцного фторокомплексу: W + 8HF + 2HNO3 = H2[WF8] + 2NO↑ + 4Н2О. За високих температур Мо і W здатні взаємодіяти з розплавами лугів за наявності окисників з утворенням молібдатів і вольфраматів: 2Мо + 2Na2CO3 + 3О2 = 2Na2MoO4 + 2СО2; W + 3NaNO3 + 2NaOH = Na2WO4 + 3NaNO2 + H2O. При нагріванні порошкоподібний Сr, Мо та W легко згоряють у кисню: 4Сr + 3О2 = 2Сr2О3, 2Мо + 3О2 = 2МоО3, 2W + 3О2 = 2WО3. Слід зазначити, що при цьому хром окислюється до Сr2О3, а Мо таW утворюють оксиди у вищому ступені окиснення +6. У сполуках з оксисеном Хром виявляє ступені окиснення +2, +3, +4, +6 і утворює відповідні оксиди СrО, Сr2О3, СrО2, СrО3. СrО2 нерозчинний у воді, важко розчиняється в кислотах та лугах. Гідроксид який йому відповідає невідомий. СrО – основний оксид, нестійкий, навіть при незначному нагріванні диспропорціонує: 3СrО = Сr2О3 + Сr Солі хрому (ІІ), утворені сильними кислотами, розчинні у воді. Взаємодією СrСl2 з лугами у без кисневому середовищі утворюється осад хром (ІІ) гідроксиду жовтого кольору: СrС12 + 2NаОН = Сr(ОН)2 + 2NаС1. Сr(ОН)2 – виявляє основні властивості, тому легко розчиняється у кислотах з утворенням катіона гексааквахрому (ІІ): (жовтий)Сr(ОН)2 + 2НСl + 4Н2О = [Сr(Н2О)6]Сl2(синій) Сполуки Хрому (ІІ) сильні відновники. Сr(ОН)2 легко окислюється киснем повітря, а СrС12 подібно до активних металів, здатний відновлювати Гідроген навіть із води і кислот не окисників: 2СrС12 + 2Н2О = 2СrОНС12 + Н2↑, 2СrС12 +2НС1 = 2СrС13 + Н2↑. Хром (ІІІ) оксид Сr2О3 – амфотерний оксид є порошком темно-зеленого кольору, нерозчинним у воді, розведених розчинах кислот та лугів. Як амфотерний оксид, Сr2О3 у дрібнодисперсному стані розчиняється у сильних кислотах і концентрованих розчинах лугів. Сr2О3 + 3НС1 + 9Н2О = 2[Сr(Н2О)6]3+С13; Сr2О3 + 6NaOH + 3Н2О = 2Na3[Cr(OH)6]3-. При сплавлені з оксидами лужних металів та лугами Сr2О3 утворює мета хроміти зеленого кольору: Сr2О3 + 2NaOH = 2NaСrO2 + Н2О. Хром (ІІІ) гідроксид – амфотерний, добувають його під дією лугів на розчинні солі хрому (ІІІ): СrСl3 + 3NaOH = Сr(OН)3 + 3NaСl. Свіжодобутий Сr(OН)3 добре розчиняється в кислотах і лугах: Сr(ОН)3 + 3НС1 + 3Н2О = [Сr(Н2О)6]С13; Сr(ОН)3 + 3NaOH = Na3[Cr(OH)6]. Аквакомплекс [Сr(Н2О)6]3+ має синьо-фіолетове забарвлення, як і кристалогідрати солей Хрому(Ш). Знаходячись у проміжному ступені окиснення, сполуки хрому (ІІІ) мають окисно-відновну двоїстість. Так, з сильними відновниками Сr2О3 виявляє окисні властивості: 2Аl + Сr2О3 = Аl2О3 + 2Сr. В окисно-відновних реакціях солі хрому(Ш) можуть виступати як відновники, що найкраще виявляється в лужному середовищі: Cr2(SO4)3 + 3Вr2 + 16NaOH = 2Na2CrО4 + 6NaBr + 3Na2SO4 + 8H2O. Внаслідок окиснення солей Хрому(ІІІ) утворюються хромати — солі хроматної кислоти Н2СrО4. Цю кислоту модна добути під час розчинення кислотного оксиду СrО3 у воді. Водний розчин Н2СrО4 – це кислота середньої сили. Хроматна кислота Н2СrО4, як і дихроматна Н2Сr2О7, відома лише в розчині. У водних розчинах вони перебувають у стані рівноваги: 2Н2СrО4 Хромати лужних та лужноземельних металів, магнію, амонію, талію, плюмбуму мають жовте забарвлення, дихромати — оранжеве. Розчинними у воді є лише солі лужних металів, магнію і кальцію. В кислих розчинах, як правило, утворюються дихромати, в лужних — хромати. Із солей хрому (VІ) найбільше значення має дихромат калію К2Сr2О7. На відміну від жовтого хромату він забарвлений у червоно-оранжевий колір і краще розчиняється у воді. Розчини дихроматів мають кислу реакцію середовища, що пояснюється їх гідролізом:
Наведена рівновага у кислому середовищі зміщена ліворуч, у лужному – праворуч. Таким чином можна здійснити взаємні перетворення хроматів підкисленням у дихромати, дихроматів підлужненням у хромати: 2К2СrО4 + H2SO4 = К2Сr2О7 + K2SO4 + Н2О, К2Сr2О7 + 2КОН = 2К2СrО4 + Н2О. Сполуки Хрому (VІ) — сильні окисники. У сухому вигляді хромати гірше вступають в окисно-відновні реакції, ніж у розчині. Сухий дихромат амонію під час нагрівання розкладається, що також є наслідком відновлення хрому (VІ): (NH4)2Cr2О7 = Сr2О3 + N2↑ + 4H2O↑ Під час відновлення дихроматів у кислому середовищі утворюються похідні катіонного комплексу [Сr(Н2О)6]3+: К2Сr26+О7 + 4H2SO4 + 3Nа2S4+O3 = Сr23+(SO4)3 +3Nа2S6+O4 + К2SO4 + 4Н2О; у нейтральному середовищі – гідроксид хрому (ІІІ): К2Сr26+О7 + 3(NH4)2S2- + Н2О = 2Сr3+(ОН)3↓ + 3S°↓ +6NН3↑ + 2КОН; У лужному середовищі – похідні аніонного комплексу [Сr(ОН)6]3-: К2Сr26+О7 + 3(NH4)2S2- +4КОН + Н2О = 2К3[Сr3+(ОН)6] + 3S°↓ +6NН3↑. Найбільшу окислювальну активність хромати виявляють у кислому середовищі. Тому дихромат калію в суміші з концентрованою сульфатною кислотою використовують для миття хімічного посуду (хромова суміш - К2Сr2О7 + H2SO4). Сполуки Мо і W з нижчими ступенями окиснення цих елементів ще менш стійкі, ніж відповідні сполуки Хрому і легко окислюються. Найбільш типовим ступенем окиснення Молібдену і Вольфраму є +6. СrО3, МоО3 і WО3 – це типові кислотні оксиди, яким відповідають кислоти: Н2СrО4 – ароматна, Н2МоО4 – молібденатна, Н2WО4 – вольфрамат на. Кислотна функція їх знижується в ряду Сr—Мо—W. МоО3 і WО3 на відміну від СrО3, у воді не розчиняються, а відповідні їм кислоти слабкі. Кислотна природа МоО3 і WО3 виявляється при розчинені їх у лігах: МоO3 + 2КОН = K2МоO4 + Н2О, WO3 + 2КОН = K2WO4 + Н2О.
Лабораторна робота
Дослід 1. Отримання та властивості хром (III) гідроксиду У дві пробірки внести 3-5 крапель розчину хром (III) нітрату та додати краплями розчин натрій гідроксиду до утворення осаду. Відмітити колір осаду. Потім в одну із пробірок додати декілька крапель розчину сульфатної кислоти, а в другу – надлишок розчину натрій гідроксиду. Написати рівняння відповідних реакцій. Які властивості здатен проявляти хром (III) гідроксид? Відзначити забарвлення отриманих осадів. Продукт взаємодії хром (III) гідроксиду з лугом зберегти до досліду 2. Дослід 2. Окиснення сполук хрому (III) До розчину гексагідроксохромат (III) натрій додати 3-5 крапель 3%-ного розчину гідроген пероксиду. Суміш нагріти до переходу забарвлення розчину з зеленого у жовтий. Написати рівняння окиснення Дослід 3. Гідроліз солей хрому До розчину хром (III) нітрату додати нейтральний розчин лакмусу. Пояснити зміну забарвлення лакмусу. Написати рівняння відповідної реакції. Дослід 4. Умови існування в розчині хроматів і дихроматів У пробірку внести 2-3 краплі розчину калій хромату. Відмітити колір, який характерний для хромат-йону. Додати 1-2 краплі розчину сульфатної кислоти. Відмітити забарвлення одержаного розчину, обумовленого дихромат-йонами. До одержаного розчину краплями додати розчин натрій гідроксиду до зміни забарвлення. Написати молекулярні та йоні рівняння переходу хромату в дихромат та навпаки. Яка рівновага встановлюється у водних розчинах хроматів і дихроматів? Як впливає середовище на зміщення цієї рівноваги? Дослід 5. Окисні властивості сполук хрому (VI) У пробірку внести 2-3 краплі розчину калій дихромату, 2-3 краплі розчину сульфатної кислоти та додати 3-4 краплі натрій сульфіту. Спостерігати зміну забарвлення розчину. Написати рівняння реакції, підібрати коефіцієнти методом електронного балансу.
Контрольні запитання та задачі 1. На основі електронної будови атома Хрому вказати його можливі ступені окиснення. 2. Охарактерізувати кислотно-основні властивості оксидів та гідроксидів хрому при переході від нижчих ступенів окиснення до вищих. 3. Написати молекулярні та йонні рівняння гідролізу 4. Внаслідок взаємодії надлишку калій йодиду з розчином калій дихромату в кислому середовищі добуто 1,005 г вільного йоду. Обчислити масу калій дихромату в розчині. 5. Закінчити рівняння реакцій, підібрати коефіцієнти методом електроного балансу:
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 521; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.008 с.) |

 Н2Сr2О7 + Н2О.
Н2Сr2О7 + Н2О. Сr2О72- + Н2О 2НСrО4- 2Н+ + 2СrО42-
Сr2О72- + Н2О 2НСrО4- 2Н+ + 2СrО42-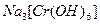 гідроген пероксидом.
гідроген пероксидом.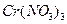 та
та 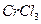 .
.