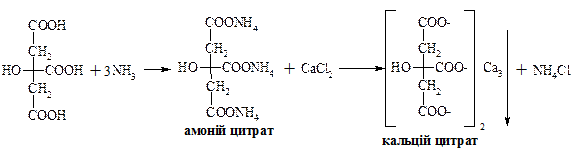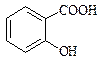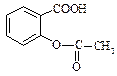Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аміни. Азо- та діазосполуки. Азобарвники.Содержание книги Поиск на нашем сайте
Стрептоцид (сульфаніламід)
Перший представник групи лікарських препаратів – сульфаніламідів, які є великою групою хіміотерапевтичних лікарських препаратів антибактеріальної дії. За своєю хімічною будовою сульфаніламіди належать до заміщених амідів сульфанілової кислоти. Загальна формула сульфаніламідів має вигляд:
Яскравими представниками цієї групи препаратів є етазол та сульфадиметоксин, в структурі яких замісники в амідній групі мають гетероциклічну природу.
Вихідною речовиною для синтезу сульфаніламідів є анілін. Подібно до первинних амінів стрептоцид вступає в реакції діазотування та азосполучення. Діазотування стрептоциду:
Реакція азосполучення:
ТЕМА: Діазотування стрептоциду. Одержання азобарвника.
Обладнанн: пробірки хімічні, штативи для пробірок, спиртівки, мікролопатки, пробіркотримачі. Реактиви: лід, дистильована вода, натрій гідроксид (10%), калій гідроксид, хлоридна кислота, стрептоцид, розчин крохмалю, фенол, нітрит натрію, універсальний індикаторний папір. Це необхідно знати та вміти
Хід роботи I. Виконання дослідів ДОСЛІД №1. Діазотування стрептоциду. В пробірку помістіть 1 краплю розчину стрептоциду у та 6 крапель 10% розчину хлоридної кислоти. Додайте в пробірку, періодично збовтуючи, 6-8 крапель 5% розчину нітриту натрію та кусочок льоду. Одержаний розчин збережіть для наступного досліду.
ДОСЛІД №2. Одержання азобарвника. В пробірку помістіть 3-4 краплі рідкого фенолу та 4-5 крапель 10% розчину гідроксиду натрію до повного розчинення фенолу. Додайте 1 краплю одержаного розчину до розчину солі діазонію, добутої в попередньому досліді. З’являється червоне забарвлення.
II. Оформлення результатів Результати спостережень оформляють вкінці кожного досліду, відповідно до запитань. III. Висновок У висновку підбиваються підсумки роботи та узагальнюються результати досліджень.
Завдання для контролю кінцевого рівня знань
3-бромбензендіазонійхлориду? Напишіть схему реакйії.
ПРАКТИЧНЕ ЗАНЯТТЯ №8 Гетерофункціональні кислоти Гідроксикислоти. Винна кислота (2,3-дигідроксибутандіова)
Змішаний калієво-натрієвий тартрат – сегнетова сіль – при взаємодії з купрум(ІІ) гідроксидом в лужному середовищі дає комплексну сполуку яскраво-синього кольору.
Винна кислота проявляє властивості, характерні для карбонових кислот, так і для спиртів. Лимонна кислота (2-гідроксипропан-1,2,3-трикарбонова кислота)
Цитрат натрію використовують для консервування донорської крові. Протизгортальна дія базується на тому, що цитрат натрію зв’язує йони кальцію, які приймають участь у процесі згортання, у нерозчинний цитрат кальцію.
Фенолокислоти Саліцилова кислота (2-гідроксибензенова кислота)
Саліцилова кислота має два центри кислотності – карбоксильну групу та фенольну групу. Вона володіє сильними кислотними властивостями. Ацетилсаліцилова кислота (аспірин) – одержують ацилюванням саліцилової кислоти оцтовим ангідридом, це складний ефір саліцилової кислоти.
При взаємодії саліцилової кислоти з хлоридом феруму (ІІІ) утворюється фіолетове забарвлення, тоді як ацетилсаліцилова кислота, в якій відсутня вільна фенольна гідроксильна група, таку реакцію не дає. Ця реакція використовується при виявленні доброякісності ацетилсаліцилової кислоти. Ацетилсаліцилова кислота як складний ефір здатна гідролізувати в кислому та лужному середовищах. Це слід враховувати при виборі умов зберігання ацетилсаліцилової кислоти: заборонений контакт з вологою. При гідролізі утворюються саліцилова та оцтова кислоти. Добувають аспірин взаємодією саліцилової кислоти з оцтовим ангідридом. ТЕМА: Вивчення властивостей винної, лимонної та саліцилової кислот. Обладнання: пробірки хімічні, штативи для пробірок, спиртівки, мікролопатки, пробіркотримачі. Реактиви: лід, дистильована вода, натрій гідроксид (10%), калій гідроксид, хлоридна кислота, анілін, винна кислота, лимонна кислота, саліцилова кислота, ацетилсаліцилова кислота, розчин глюкози, етанол, купрум(ІІ) сульфат (2%), розчин аміаку, феруму(ІІІ)хлорид, кальцій хлорид, 0,5 % розчин глюкози, фенілсаліцилат, універсальний індикаторний папір.
Це необхідно знати та вміти
Хід роботи I. Виконання дослідів
|
||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1041; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.209.114 (0.011 с.) |

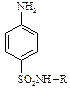

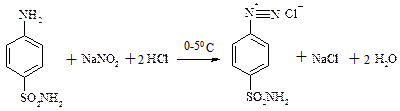
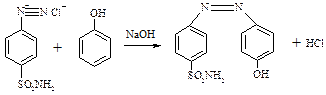
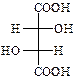 В природі зустрічається D-(+)-винна кислота (один із стереоізомерів), що міститься в багатьох рослинах, особливо у винограді, який є сировиною для її одержання. Виділяється у вигляді кислої калієвої солі („винний камінь”) в процесі винного бродіння виноградного соку. Солі та складні ефіри винної кислоти називають тартратами.
В природі зустрічається D-(+)-винна кислота (один із стереоізомерів), що міститься в багатьох рослинах, особливо у винограді, який є сировиною для її одержання. Виділяється у вигляді кислої калієвої солі („винний камінь”) в процесі винного бродіння виноградного соку. Солі та складні ефіри винної кислоти називають тартратами.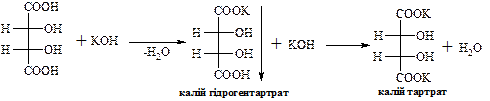
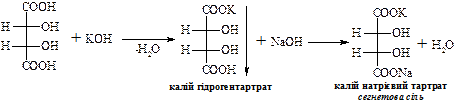
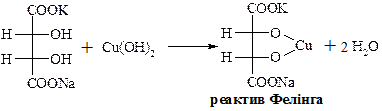
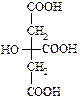 – безбарвна кристалічна речовина, добре розчинна у воді. Вперше була виділена К. В. Шеєллє з лимонного соку, де її вміст сягає 10 %. Під дією сульфатної кислоти лимонна кислота як α-гідроксикислота розкладається з утворенням ацетондикарбонової та мурашиної кислот. Солі лимонної кислоти називають цитратами.
– безбарвна кристалічна речовина, добре розчинна у воді. Вперше була виділена К. В. Шеєллє з лимонного соку, де її вміст сягає 10 %. Під дією сульфатної кислоти лимонна кислота як α-гідроксикислота розкладається з утворенням ацетондикарбонової та мурашиної кислот. Солі лимонної кислоти називають цитратами.