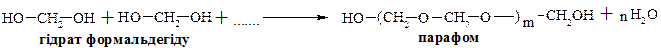Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ДОСЛІД №1. Окиснення етанолу.Содержание книги Поиск на нашем сайте
В пробірку помістіть 2 краплі етанолу, 2 краплі розчину калій біхромату та краплю розчину сульфатної кислоти. Отриманий оранжевий розчин злегка нагрійте над полум’ям спиртівки до початку зміни забарвлення. Вже через декілька секунд з’являється зеленкувате забарвлення розчину, характерне для солей хрому (ІІІ). Одночасно відчувається запах оцтового альдегіду. 1. Запишіть схему реакції окиснення етанолу. 2. Який окисник використано в досліді? По якому признаку можемо зробити висновок про відновлення цього реагенту?
ДОСЛІД №2. Утворення купрум (ІІ) гліцерату. В пробірку помістіть 2 краплі розчину купрум(ІІ) сульфату та 5 крапель розчину натрій гідроксиду. Утворюється блакитний драглистий осад купрум(ІІ) гідроксиду. Додайте 3 краплі гліцерину та збовтайте вміст пробірки. Осад переходить в розчин, який набуває інтенсивно синього забарвлення. 1. Запишіть схему реакції, яка лежить в основі “розчинення” осаду гідроксиду купруму (ІІ). 2. Який структурний фрагмент повинен бути в молекулах спиртів для того, щоб вони розчиняли гідроксид купруму (ІІ)? 3. З якою метою можна використовувати цю реакцію? ДОСЛІД №3. Окислення двохатомних фенолів. Візьміть 3 клаптики фільтрувального паперу. В центр кожного клаптика нанесіть по одній краплині розчину пірокатехіну, резорцину та гідрохінону. В середину кожної з отриманих плям нанесіть по 1 краплині 10 % розчину натрій гідроксиду. Зверніть увагу на вихідний колір плям, а також на швидкість появи забарвлення внаслідок окислення фенолів киснем повітря. 1. Напишіть схеми реакцій окиснення гідрохінону та пірокатехіну. Назвіть продукти окислення. 2. За швидкістю появи забарвлення зробіть порівняльний аналіз про швидкість окислення гідрохінону, пірокатехіну та резорцину.
ДОСЛІД №4. Кольорові реакції фенолів з хлоридом феруму (ІІІ). Приготуйте 4 пробірки. В 1-у помістіть 1 краплю 3 % водного розчину фенолу, в 2-у ¾ 3 краплі 1 % розчину пірокатехіну, в 3-ю ¾ 3 краплі 1 % розчину резорцину, в 4-у ¾ 3 краплі 1 % розчину гідрохінону. В кожну пробірку додайте по 1 краплі 1 % розчину ферум(ІІІ) хлориду. В 1-й пробірці з’являється синьо-фіолетове забарвлення, в 2-ій ¾ зелене, в 3-ій ¾ синьо-фіолетове та в 4-ій ¾ синє, що відразу ж змінюється на жовте. 1. З якою метою використовуються реакції фенолів з хлоридом феруму (ІІІ) у фармацевтичному аналізі? II. Оформлення результатів Результати спостережень оформляють вкінці кожного досліду, відповідно до запитань. III. Висновок У висновку підбиваються підсумки роботи та узагальнюються результати досліджень. Завдання для контролю кінцевого рівня знань 1. Напишіть структурні формули спиртів складу С5Н11ОН 2. Напишіть структурні формули таких спиртів: 2-Метилгексанол-2; 2,2-Диметилбутанол-1; 2-Метилбутандіол-1,2; 3,4-Диметилпентанол-2; 2-Фенілгександіол-1,2; Гідрохінон, Пірокатехін, Резорцин, Гліцерин. 3. Закінчіть запропоновані схеми хімічних реакцій: a) пропанол + бромистоводнева кислота → b) окиснення бутанолу-1 c) етанол →(Н2SO4 140°C) d) внутрішньомолекулярна дегідратація бутанолу-2 4. Напишіть рівняння хімічних реакцій, за допомогою яких можна здійснити такі перетворення:
б) метанол → → метилпропіловий етер → алюміній метанолят в) етен → етанол → етен → йодетан → бутен-1 → бутанол (напишіть структурну формулу і дайте назву одержаного бутанолу) г) пропан→ фенол → фенолят натрію → Х → 2,4,6-трибромфенол
5. Як добути пропанол-1 з: пропену; 1-хлорпропану. Напишіть рівняння реакцій. 6. Порівняйте властивості фенолу та етанолу. Відповідь підтвердіть за допомогою рівнянь хімічних реакцій. 7. Для нейтралізації суміші етилового спирту та фенолу витратили 65,31 мл розчину натрій гідроксиду з масовою часткою лугу 20% (густина становить 1,225 г\мл). При взаємодії такої самої кількості вихідної суміші з надлишком натрію виділилось 6,72 л газу (н. у.). розрахуйте масові частки компонентів у вихідній суміші (%). ПРАКТИЧНЕ ЗАНЯТТЯ №5 Альдегіди та кетони Метаналь (формальдегід, мурашиний альдегід) Н-СН=О − безбарвний газ з різким запахом, добре розчинний у воді. Водний 35-40 % розчин формальдегіду називають формаліном. В промисловості формальдегід добувають окисненням метанолу киснем повітря в присутності каталізаторів (срібло або мідь).
При взаємодії формальдегіду з аміаком утворюється гексаметилентетраамін (уротропін). Ця сполука була вперше синтезована та вивчена А. М. Бутлеровим. При нагріванні розчину уротропіну в присутності кислоти він повільно гідролізує з утворенням вихідних сполук – формальдегіду та аміаку.
Уротропін застосовують для лікування захворювань сечових шляхів. Терапевтичний ефект полягає у дезінфікуючій дії формальдегіду, який виділяється при кислотному гідролізі уротропіну. В лужному середовищі уротропін стійкий, тому при лужній реакції сечі хворого уротропін не здійснює лікувального ефекту. Формальдегід використовують в якості вихідної сировини для отримання пластмас (фенолформальдегідних смол), а також для приготування мертвих противірусних вакцин. При тривалому зберіганні формаліну відбувається полімеризація та утворений полімер, параформ, випадає у вигляді білого осаду. Реакція полімеризації формальдегіду була відкрита та досліджена А. М. Бутлеровим. При нагріванні параформу в присутності кислот знову утворюється формальдегід. Припускають, що процесу полімеризації піддається гідрат формальдегіду.
Етаналь (ацетальдегід, оцтовий альдегід) СН3СН=О – безбарвна рідина з характерним запахом. Його отримують найчастіше окисненням етанолу. Використовують для добування оцтової кислоти та в якості вихідної сировини для синтезу багатьох органічних сполук. Аналогічно формальдегіду здатний до полімеризації в присутності кислоти. При полімеризації трьох молекул ацетальдегіду утворюється паральдегід, що являє собою рідину. При нагріванні в присутності кислот він деполімеризується з утворенням вихідного ацетальдегіду.
Паральдегід застосовується в медичній практиці як снодійний та заспокійливий засіб. ТЕМА: Добування та вивчення властивостей альдегідів. Обладнання: пробірки хімічні, штативи для пробірок, спиртівки, чашки Петрі. Реактиви: етиловий спирт, натрій гідроксид (10%), сульфатна кислота (розв.), калій біхромат (5%), купрум(ІІ) сульфат (2%), резоцин (1%), формалін, нітрат аргентуму (5%), розчин аміаку (10%), фенолфталеїн, фуксин.
Це необхідно знати та вміти
Хід роботи I. Виконання дослідів
|
||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 922; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.238.6 (0.006 с.) |


 → метилсульфатна кислота
→ метилсульфатна кислота