
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 3. Берилій. Магній. Лужноземельні металиСодержание книги
Поиск на нашем сайте ПЕРЕДМОВА
Лабораторний практикум складено відповідно до типової програми дисципліни “Загальна і неорганічна хімія” (Неорганічна хімія) для студентів першого курсу, що навчаються за напрямком підготовки – 6.051301 – хімічна технологія; галузі знань – 0513 – Хімічна технологія та інженерія та напряму підготовки – 6.051701 – харчові технології та інженерія; галузі знань – 0517 – Харчова промисловість та переробка сільськогосподарської продукції. У практикумі наведено лабораторні роботи з основних розділів дисципліни. Мета практикуму – закріплення теоретичного матеріалу з вивчення властивостей елементів та їх сполук. Метою практикуму також є набуття студентами навичок роботи з хімічними речовинами, оволодіння методиками їх дослідження, прийомами роботи з приборами та обладнанням хімічних лабораторій. Практикум складено таким чином, щоб навчити студента самостійно виконувати експеримент, формулювати і узагальнювати висновки. Опису лабораторних завдань передують стислі теоретичні введення і умови виконання робіт. Закінчуються теми переліком контрольних питань і задачами для самостійного їх розв’язання. Саме така структура практикуму на наш погляд є ефективною для оптимального засвоєння студентами теоретичного матеріалу. Кількість лабораторних робіт і їх тематика розраховані на навчальні плани вказаних спеціальностей, але окремі роботи можуть бути використані при вивчені даної дисципліни та підготовці до іспиту.
Тема 1. Комплексні сполуки
Основні теоретичні відомості
Комплексні сполуки — це сполуки, здатні утворювати в твердому стані кристалічні ґратки, у вузлах яких розміщуються комплексні йони, здатні існувати також у розчині. Найбільш вдало будову і властивості комплексних сполук пояснює координаційна теорія, розроблена швейцарським хіміком, лауреатом Нобелівської премії А. Вернером у 1893 р. Згідно з координаційною теорією А. Вернера, молекула комплексної сполуки складається з йона-комплексоутворювача (займає центральне місце), лігандів, що перебувають у безпосередній близькості і разом з йоном-комплексоутворювачем становлять внутрішню сферу; комплексна сполука має також зовнішню сферу, якщо заряди у внутрішній сфері не скомпенсовані. Атом (йон) металу (або неметалу, наприклад H[BF4], H2[SiF6]), який приєднує до себе протилежно заряджені йони або нейтральні молекули, утворюючи комплексний йон, називається комплексоутворювачем, або центральним йоном, а протилежно заряджені йони або молекули, які безпосередньо з ним сполучені, називаються адендами, або лігандами. Ліганди розміщуються навколо центрального йона по-різному залежно від його координаційного числа. Координаційне число атома-комплексоутворювача може дорівнювати від 2 до 12; найчастіше воно має значення 2, 4, 5 та 6. Число лігандів, безпосередньо сполучених з центральним атомом (йоном), визначається координаційним числом цього атома (йона). Оскільки координаційне число залежить від природи центрального атома (йона) і лігандів, природи розчинника, умов утворення комплексної сполуки, воно є змінною величиною. Для одного й того самого йона-комплексоутворювача координаційні числа не є постійними; так для Al3+, Co2+, Zn2+ відомі координаційні числа 4 і 6. Лігандами можуть бути електронейтральні молекули (Н2О, NH3, NO і т.д.), а також негативно заряджені йони (О2-, ОН-, NO2-, CN-, Cl-, Br-, I-, CO3- і т.д.). Найважливішими комплексними сполуками з нейтральними лігандами є амінокомплекси та аквакомплекси. Амінокомплекси — це комплексні сполуки, лігандами яких є молекули аміаку. Такі комплекси можуть утворювати йони Аргентуму (І), Купруму (ІІ), Кадмію, Цинку, Ніколу, Кобальту під час взаємодії з водним розчином NH3. Вони досить стійкі. Якщо на важкорозчинні сполуки цих металів, добутки розчинності яких більші, ніж константи нестійкості відповідних аміакатів, подіяти аміаком, то вони перейдуть у розчин у вигляді йонів: [Ag(NH3)2]+, [Cu(NH3)4]2+, [Cd(NH3)4]2+, [Zn(NH3)4]2+, [Ni(NH3)6]3+, [Co(NH3)6]2+, [Co(NH3)6]3+. Аквакомплекси — це комплексні сполуки, лігандами яких є молекули води. До аквакомплексів належать: [А1(Н2О)6]С13; [Со(Н2О)6]С12; [Сr(Н2О)6]С13 тощо, які у розчині дисоціюють з утворенням комплексних катіонів: [А1(Н2О)6]3+; [Со(Н2О)6]2+; [Сr(Н2О)6]3+. Комплексні сполуки, в яких центральний атом координує круг себе негативно заряджені кислотні залишки, називається ацидокомплексами. Це комплексні сполуки, лігандами яких є аніони, наприклад: K3[Co(NO2)6], K2[PtCl6], K3[FeF6], K4[Fe(CN)6], K2[CoCl4]. Заряд комплексного йона дорівнює алгебричній сумі зарядів простих йонів, що входять до його складу. На величину заряду комплексного йона не впливають електронейтральні молекули, що входять до його складу, наприклад: Fe3+ + 6CN- = [Fe(CN)6]3- (+3 - 6 = -3); Cu2+ + 4NH3 = [Cu(NH3)4]2+ (+2 + 0 = +2). Дисоціація комплексних сполук відбувається за типом дисоціації сильних електролітів: [Zn(NH3)4]Cl2 → [Zn(NH3)4]2+ + 2Сl-. Це означає, що йони Хлору можна легко зв'язати реактивами, які утворюють з ними важкорозчинні солі. Видалити молекули аміаку значно важче, оскільки дисоціація комплексних йонів відбувається незначною мірою:
Дисоціація цих йонів підлягає закону дії мас і з кількісного боку оцінюється константою нестійкості або константою стійкості:
Константою нестійкості комплексної сполуки називається константа рівноваги процесу дисоціації комплексних йонів:
Величина константи нестійкості комплексної сполуки залежить від її природи і від температури. За сталої температури ця величина стала для даної сполуки і не залежить від її концентрації. Чим більша величина константи нестійкості комплексної сполуки, тим більшою мірою ця сполука дисоціює на йони у водних розчинах. Пониження концентрації одного з компонентів, що входять до складу комплексу, може призвести до його руйнування. Візьмемо розчини двох солей нікелю: NiSO4, [Ni(NH3)6]SO4, в яких мають місце рівноваги:
[Ni(NH3)6]SO4 [Ni(NH3)6]2+ + SO42- [Ni(NH3)6]2+ Ni2+ + 6NH3 При додаванні розчину NаОН в першому розчині випаде осад Ni(ОH)2, а в другому осаду не утвориться. Для утворення осаду необхідно, щоб добуток концентрації йонів СNi2+·С2ОН- перевищило величину добутку розчинності ДРNi(ОH)2. Комплексний йон [Ni(NH3)6]2+ хоч і дисоціює на йони Ni2+ і молекули NH3, але настільки мало, що концентрація СNi2+ недостатня для досягнення величини ДР, тому осаду не утворюється. При додаванні до розчинів NiSO4 і [Ni(NH3)6]SO4 амоній сульфіду випадає осад NiS. Нікель сульфід значно менш розчинний (ДРNiS = 1,4·10-24), ніж гідрооксид нікелю (ДР Ni(ОH)2 = 7,0·10-14). Концентрація йонів Ni2+ навіть у розчині комплексної солі достатня для досягнення величини ДРNiS. Якщо йони S2- зв’язують йони Ni2+, то в системі, що знаходиться у рівновазі: [Ni(NH3)6]2+↔ Ni2+ + 6NH3 зміщується рівновага в бік дисоціації комплексного йону, що призводить до повного руйнування комплексного йону.
Лабораторна робота
Дослід 1. Виявлення йонів, що входять до складу подвійної солі У три пробірки налити по 5 крапель розчину Дослід 2. Йони комплексної солі а) До 2 крапель ферум (III) хлориду б) до 2 крапель розчину гексаціаноферат (III) калію Дослід 3. Одержання сполук з комплексним катіоном У дві пробірки взяти по 4-5 крапель розчину купрум (II) сульфату і ніколь (II) сульфату і додати в кожну краплями розчин амоніаку до утворення осадів основних солей. Далі додати надлишок амоніаку до повного розчинення осадів, що відбувається внаслідок утворення комплексних сполук. Порівняти забарвлення вихідних і одержаних розчинів. Наявність яких йонів обумовлює забарвлення розчинів? Скласти молекулярні і йоні рівняння реакцій утворення основних солей та їх розчинення у надлишку амоніаку. Назвати одержані комплексні сполуки. Дослід 4. Одержання сполук з комплексним аніоном а) У пробирку налити 3-5 крапель хром (III) нітрату б) У пробірку налити по 3-4 краплі концентрованих розчинів кобальт (II) хлориду Дослід 5. Комплексні сполуки в реакціях обміну. а) До 2-3 крапель розчину купрум (II) сульфату додати стільки ж крапель розчину гексаціаноферат (II) калію б) До 2-3 крапель розчину ферум (II) сульфату додати такий же об’єм розчину гексаціаноферат (III) калію Дослід 6. Комплексні сполуки в окисно-відновних реакціях. Налити у пробірку 2-3 краплі розчину Дослід 7. Гідратна ізомерія комплексних сполук Декілька темно-зелених крісталів
Дати назву цим ізомерам. Дослід 8. Стійкість і руйнування комплексних йонів а) До розчину комплексної сполуки (дослід 4б) додавати по краплям воду та спостерігати зміну забарвлення. Скласти рівняння електролітичної дисоціації комплексних йонів. Як зміщується рівновага при додаванні води? Як впливає концентрація розчину на стійкість комплексних сполук? б) У двох пробірках одержати комплексну сполуку купруму(II) з амоніаком (див. дослід 3). В одну пробірку додати 3-4 краплі розчину Контрольні запитання та задачі
1. У наведених комплексних сполуках 2. Визначити заряд для комплексних йонів 3. Написати координаційні формули сполук з координаційним числом кобальту (III), що дорівнює 6: 4. Написати рівняння первинної та вторинної дисоціації комплексних сполук
5. З позиції методу ВЗ визначити тип гібридизації АО комплексоутворювача та просторову будову комплексного йону 6. Користуючись константами нестійкості розмістити у Кнест Кнест Кнест 7. Написати рівняння реакцій, які перебігають з утворенням комплексних сполук з координаційним числом 6: а) б) в)
Тема 2. Лужні метали
Основні теоретичні відомості
До головної підгрупи І групи елементів періодичної системи належать лужні метали: Літій Li, Натрій Na, Калій К, Рубідій Rb, Цезій Cs, Францій Fr. У зовнішньому електронному шарі атомів лужних металів розміщується по одному електрону, у передостанньому електронному шарі атома Літію міститься два електрони, а у решти атомів лужних металів по вісім електронів. Тому атоми цих елементів легко віддають один електрон, тобто мають низьку енергію йонізації, яка зменшується в підгрупі зверху вниз. Послаблення зв'язку електрона з ядром (зниження енергії йонізації) зумовлено зростанням радіусів атомів і екрануванням позитивно зарядженого ядра електронами внутрішніх шарів. Тому лужні метали легко утворюють катіони Ме+. по схемі: Ме – 1 е- = Ме+. Всі лужні метали проявляють ступінь окиснення +1 та валентність 1. Радіуси атомів збільшуються зі збільшенням порядкового номеру елемента, і в цьому ж напрямку збільшуються їх відновна активність. Всі лужні метали дуже сильні відновники. Зі збільшенням протонних чисел елементів радіуси їхніх атомів зростають, енергії йонізації зменшуються, а металічні властивості посилюються. Отже, найактивнішим з лужних металів є Францій. Зберігаються лужні метали під шаром керосину, так як на повітрі вони досить швидко окислюються за рівнянням: 4Ме + О2 = 2 Ме2О Лужні метали дуже м'які, легкоплавкі. Для літію, натрію, калію і рубідію характерний сріблясто-білий блиск, для цезію — золотистий. На повітрі лужні метали легко тьмяніють (Rb і Cs здатні самозайматися), реакція прискорюється під дією вологи. Лужні метали мають високі електро- і теплопровідність. Робота з лужними металами потребує обережності, оскільки вони легко займаються, бурхливо реагують з водою та іншими речовинами. Завдяки дуже високій активності лужні метали здатні реагувати з сухим воднем під час нагрівання з утворенням гідридів Ме, з азотом під час нагрівання з утворенням нітридів Ме3N. Рубідій і цезій у кисні здатні самозайматися, натрій і літій займаються лише під час нагрівання. Тільки літій утворює оксид Li2O, а всі інші лужні метали — пероксиди або надпероксиди. Так, натрій внаслідок взаємодії з киснем утворює пероксид Na2O2, а К, Rb, Cs — надпероксиди МеО2. Пероксиди і надпероксиди лужних металів — сильні окисники. Оксиди натрію, калію, рубідію і цезію можна добути окисненням у разі нестачі кисню або під час взаємодії стехіометричних кількостей металу і пероксиду. Оксиди Li2O і Na2O — безбарвні, К2О і Rb2O — мають жовте забарвлення, Cs2O — оранжеве. Пероксиди можна розглядати як солі пероксиду гідрогену Н2О2. Під час розчинення у воді пероксиди повністю гідролізують, оскільки кислотні властивості Н2О2 виражені дуже слабко: Na2O2 + 2Н2О = 2NaOH + Н2О2. Оксиди лужних металів дуже енергійно взаємодіють з водою з утворенням лугів: К2О + Н2О = 2КОН. Ще енергійніше з водою реагують самі лужні метали, причому зі збільшенням протонного числа елемента інтенсивність взаємодії його з водою зростає (Rb і Cs реагують з водою з вибухом): 2К + 2Н2О = 2КОН + Н2↑ Гідроксиди лужних металів, особливо літію, натрію і калію, дуже важливі сполуки. Водні розчини гідрооксидів є сильними основами і виявляють сильно лужну реакцію внаслідок дисоціації їх на йони за загальною схемою:
Гідроксиди лужних металів розчиняються у воді з виділенням великої кількості теплоти, що свідчить про утворення гідратів. Розчини МеОН у воді дуже агресивні відносно різних речовин, тому їх називають їдкими лугами. Лужні метали енергійно взаємодіють з кислотами, наприклад: 2Li + 2HCl = 2LiCl + H2 ↑ Важливими солями лужних металів є нітрати, галогеніди, сульфати, карбонати. Всі вони розчинні у воді. Кристалізуючись, утворюють кристалогідрати, отже, вони гігроскопічні. Солі літію найбільш гігроскопічні, а солі цезію — найменш гігроскопічні. Із солей лужних металів найбільше практичне значення мають: карбонат натрію, або кальцинована сода, Na2CO3, гідрогенкарбонат натрію, або питна сода, NaHCO3 та кристалогідрат Na2CO3·10Н2О, нітрати натрію NaNО3 та калію К NО3 (добрива), хлорид натрію NаCl (поварена сіль). Якщо внести в полум'я пальника сіль лужного металу, воно набуде забарвлення, характерного для даного металу: літій забарвлює полум'я в кармінно-червоний колір, натрій — у жовтий, калій — у фіолетовий. За забарвленням полум'я можна виявляти ці елементи.
Лабораторна робота
Дослід 1. Взаємодія лужних металів з повітрям та водою. (Роботу проводити за склом витяжної шафи). а). Винути пінцетом із банки з керосином шматочок металічного літію, покласти його на фільтровальний папір і відрізати від нього ножем шматочок величиною з горошину. Звернути увагу на потускніння блискучої металічної поверхні свіжого надрізу. Добре просушити метал фільтровальним папіром і помістити у фарфорову чашку наповнену водою. Прикрити чашку склом. Спостерігайте за ходом реакції. Який газ виділяється? б). Аналогічні досліди провести з металічним натрієм та калієм. Визначити, який з металів найбільш активно взаємодіє з водою. Чи узгоджується ций висновок з його положенням в ряді стандартних електродних потенціалів. Який газ при цьому виділяється? Дослідити реакцію розчинів фенолфталеіном. Написати рівняння відповідних реакцій. Дослід 2. Взаємодія натрій пероксиду з волою. В суху пробірку внести 1 мікрошпатель натрій пероксиду і додати 4-5 крапель води. Розчин підігріти і внести у пробірку тліючу скіпку. Який газ при цьому виділяється? Після закінчення реакції до розчину додати 1-2 краплі фенолфталеїну. У який колір забарвлюється розчин в пробірці? Скласти рівняння реакцій натрій пероксиду з водою. Дослід 3 Гідроліз солей лужних металів. У три пробірки помістити окремо декілька кристалів калій хлориду, натрій карбонату, натрій фосфату. Прилити по 2-3 мл дистильованої води і додати 1 краплю лакмусу. Які солі повинні підлягати гідролізу і чому? Написати рівняння відповідних реакцій гідролізу в молекулярній та йонній формах. Дослід 4. Якісні реакції на катіони натрію а). У пробірку з 2-3 краплями розчину натрій хлориду додати таку саму кількість розчину гексагідроксостибіатат (V) калію б). До 3-4 крапель розчину калій хлориду додати 3 краплі розчину комплексної солі гексанітрокобальтат (III) натрію Скласти рівняння в молекулярній та йонній формах. Дослід 5. Забарвлення полум’я солями лужних металів. Очищену шляхом промивання в хлоридній кислоті і прожарювання ніхромову проволоку внести у розчин солі Літію, а потім в полум’я пальника. Спостерігати забарвлення полум’я. Теж саме виконати з солями Натрію та Калію. Ніхромову проволоку після кожної солі промити у хлоридній кислоті і прожарити до повного зникнення забарвлення полум’я. Контрольні запитання та задачі
1. Як змінюються фізичні і хімічні властивості елементів та простих речовин лужних металів зі збільшенням їх порядкового номера? 2. З яких сполук і якими способами добувають прості речовини натрій і калій? 3. Які сполуки утворюються під час горіння лужних металів? Напишить їх формули і зазначте, до якого класу сполук вони належать. 4. Написати рівняння реакцій добування оксидів і гідроксидів лужних металів. 5. Що відбувається з гідроксидами натрію і калію, якщо їх зберігати у відкритих посудинах? На що вони поступово перетворюються? Написати рівняння реакцій. 6. Запропонувати можливі способи переходів за наступними схемами:
7. Яку реакцію середовища мають розчини солей: а) Написати рівняння гідролізу для тих випадків, де він має місце. 8. Визначити молярну концентрацію еквівалентів 20% розчину натрій гідроксиду, якщо густина його розчину дорівнює 1,225 г/мл. Тема 4. Бор та алюміній
Основні теоретичні положення
До елементів головної підгрупи III групи належать Бор В, Алюміній А1, Галій Ga, Індій In, Талій Т1. В атомах елементів головної підгрупи в зовнішньому електронному шарі міститься по три електрони: ns2np1. Всі вони за виключенням бору, за хімічними властивостями є металами і втрачають при окиснені 3 електрони за схемою: Ме – 3е- =Ме3+. У сполуках всі елементи головної підгрупи виявляють ступінь окиснення +3, валентність 3. Проте, вони можуть виявляти і нижчий ступінь окиснення +1; ця здатність від Бору до Талію підвищується. Так, для Талію найстійкішими є сполуки зі ступенем окиснення його +1. Металічні властивості цих елементів помітно посилюються зі зростанням протонних чисел їхніх атомів. Проте вони виявлені слабкіше, ніж у відповідних елементів головних підгруп І і II груп. Бор відрізняється від інших елементів своєї підгрупи. Він більш подібний до неметалів ніж до металів. Незважаючи на те, що його атом у зовнішньому електронному шарі містить мало електронів, вони важко відщеплюються, оскільки розміщені близько до ядра. Бор перебуває у 2-му періоді на межі між металами і неметалами. У цьому разі виявляється аналогія властивостей елементів по діагоналі періодичної системи. Посилення металічних властивостей із зростанням протонного числа елементів виявляється у властивостях їхніх оксидів і гідроксидів. Так, оксид бору має кислотний характер і є ангідридом боратної кислоти, оксиди і гідроксиди алюмінію, галію й індію — амфотерні, оксид і гідроксид талію(Ш) мають основний характер. Найбільше практичне значення з усіх елементів головної підгрупи III групи мають Бор і Алюміній. Бор – перший р -елемент у періодичній системі. В незбудженому стані атом бору має будову зовнішнього електронного шару 2s22р1. Бор існує в аморфній (коричневій) та кристалічній (чорній) формах. Обидві модифікації бору не здатні до взаємодії з водою та кислотами-неокисниками. Бор під час нагрівання реагує з концентрованими розчинами Н2SО4 і НNО3, з царською водкою. Для розчинення аморфного бору найкраще використовувати концентровану нітратну кислоту, яка відновлюється до нітроген (ІV) оксиду відповідно до рівняння: В + 3HN5+O3 = H3B3+O3 + 3N4+O2 В атмосфері кисню бор та алюміній горять, утворюючи В2О3 і Al2О3. 4В + 3О2 = 2 В2О3 4Al + 3О2 = 2 Al2О3 Елементарний бор є неметалом, він, окрім відновлюючих властивостей, має також окислювальні властивості. З деякими металами він енергійно взаємодіє при нагріванні, утворюючи бориди: 3Mg + 2B = Mg3B2 Борний ангідрид утворює ряд борних кислот: ортоборну Н3ВО3, метаборну НВО2 і полі борні кислоти загальною формулою (В2О3)х·(Н2О)у, з яких найбільш простою по складу є тетраборна кислота Н2В4О7. Всі кислоти бору слабкі електроліти. У водному розчині найбільш стійкою є Н3ВО3, інші кислоти взаємодіючи з водою утворюють ортоборну: НВО2 + Н2О = Н3ВО3 Н2В4О7 + 5Н2О = 4Н3ВО3 Найбільш стійкою сіллю борної кислоти є тетроборат натрію або бура. Бура – це великі безбарвні кристали складу Nа2В4О7∙10Н2О, що утворюється під час взаємодії боратної кислоти з гідроксидом натрію. 4Н3ВО3 + 2NаОН = Nа2В4О7 + 7Н2О Водні розчини бури внаслідок гідролізу мають сильно лужну реакцію: Nа2В4О7 + 7Н2О ↔ 4Н3ВО3 + 2NаОН. При взаємодії бури з сильними кислотами утворюється борна кислота відповідно до рівняння: Nа2В4О7 + 2НСl + 5Н2О = 4Н3ВО3 + 2NаСl Прокалювання бури супроводжується спучуванням кристалів внаслідок виділення кристалізаційної води: Nа2В4О7·10 Н2О = 10 Н2О + Nа2В4О7 Розплавлена бура розчинює оксиди металів з утворенням найбільш термічно стійких солей – метаборатів: СоО + Nа2В4О7 = 2 NаВО2·Со(ВО2)2 Борний ангідрид при сплавлені також легко розчинює оксиди металів, утворюючи метаборати: СоО + В2О3 = Со(ВО2)2 Більшість мета боратів забарвлені в різні кольори. Цю властивість їх використовують при отриманні забарвлених «борних стекол» чи «перлів бури», які використовують у хімічному аналізі. Всі летучі сполуки бору забарвлюють полум’я пальника в яскраво – зелений колір. Крапля розчину борної кислоти залишає на жовтому куркумовому папері червону пляму, що переходить в зелено-чорну при змочуванні розчином лугу. Алюміній це сріблястий метал, м’який і пластичний, добре кується, витягується в дріт. На повітрі він вкривається дуже тонкою плівкою Al2О3, яка характеризується високою міцністю та щільністю. Алюміній – амфотерний елемент. На відміну від бору, для нього характерні не тільки аніонні, а й катіонні комплекси. Металічний алюміній, поверхня якого вкрита захисною плівкою Аl2О3, не реагує з водою. Якщо ж цю плівку зруйнувати, наприклад амальгамуванням, то відбуватиметься енергійна взаємодія алюмінію з водою з виділенням водню: 2Аl + 6H+OH = 3H02 + 2Al3+(OH)3 Оскільки алюміній амфотерний, він розчиняється в розбавлених розчинах кислот і лугів з утворенням гексааквакатіонних [Аl(Н2О)6]3+ та гексагідроксоалюмінат – аніонних [Аl(ОН)6]3- комплексів: 2Аl + 6НСl + 12 Н2О = 2[Аl(Н2О)6]Сl3 + 3Н2↑; 2Аl + 6NаОН + 6 Н2О = 2Nа3[Аl(ОН)6] + 3Н2↑. Проте дуже розбавлені і дуже концентровані розчини нітратної і сульфатної кислот на алюміній практично не діють – відбувається пасивація й оксидна плівка алюмінію зміцнюється. В помірно концентрованих розчинах цих кислот алюміній розчиняється. Під час нагрівання алюмінію оксидна плівка тріскається, тому в атмосфері кисню алюміній займається, енергійно взаємодіючи з ним: 4 Аl + 3О2 = 2Аl2О3 Аl2О3 – амфотерний оксид. Під час сплавляння Аl2О3 з карбонатами і гідроксидами утворюються відповідні мета- та ортоалюмінати: Аl2О3 + 2NаОН = 2NаАlО2 + Н2О; Аl2О3 + СаСО3 = Са(АlО2)2 + СО2↑. Гідроксид алюмінію Аl(ОН)3 можна добути, діючи на розчини солей алюмінію лугами: АlСl3 + 3NаОН = Аl(ОН)3↓ + 3NаСl. Як і оксид, Аl(ОН)3 – амфотерний. Свіже добутий гідроксид алюмінію легко розчиняється у кислотах і лугах: Аl(ОН)3 + 3НСl + 3Н2О = [Аl(Н2О)6]Сl3 Аl(ОН)3 + 3NаОН = Nа3[Аl(ОН)6]. Відомі дві алюміневі кислоти ортоалюмінева Н3АlО3 та метаалюмінева НАlО2. Солі останньої утворюються при сплавлінні її (або оксиду) з лугами, наступним чином: НАlО2 + NаОН = NаАlО2 + Н2О. Гідроксид алюмінію має високі адсорбційні властивості і використовується для очищення води і як протрава при фарбуванні. Алюміній здатен енергійно взаємодіяти з галогенами з утворенням розчинних у воді галогенідів. Солі алюмінію утворені слабкими кислотами (сульфід, карбонат тощо) повністю гідролізуються, тому під дією (NН4)2S на водні розчини солей алюмінію виділяється не сульфід алюмінію Аl2S3, а гідроксид алюмінію Аl(ОН)3: АlСl3 + 3(NН4)2S + 6 Н2О = 2 Аl(ОН)3↓ + NН4Сl + 3Н2S↑ Досить поширеними солями алюмінію та оксигеновмісних кислот є нітрати, перхлорати, сульфати, які добре розчиняються у воді, під час кристалогідрації утворюють кристалогідрати: Аl(СlО4)3·9 Н2О, Аl(NО3)3·4Н2О, Аl2(SО4)3·18 Н2О. Сульфат алюмінію застосовується для очищення води. Внаслідок перебігу реакції: Аl2(SО4)3 + 3Са(НСО3)2 = 3СаSО4 + 2 Аl(ОН)3↓ + 6СО2 утворюються пластівці гідроксиду алюмінію, які, осідаючи, захоплюють різні домішки.
Лабораторна робота
Дослід 1. Отримання ортоборної кислоти з тетраборату натрію (бури) У суху пробірку внести 1-2 мікрошпателя тетраборату натрію Дослід 2. Виявлення Бору в сполуках У фарфорову чашку внести декілька кристалів ортоборної кислоти, додати 1-2 краплі концентрованої сульфатної кислоти та 5-6 крапель етилового спирту. Перемішати суміш скляною паличкою та підпалити. Звернути увагу на забарвлення полум’я етилового естеру ортоборної кислоти. Записати відповідне рівняння реакції. Дослід 3. Добування “перлів” бури Кінец платинового дротика прожарити у зовнішній зоні полум’я пальника занурити у порошок бури і знову прожарити в полум’ї пальника до утворення прозорового скельця. Після охолодження скельце змочити розчином солі кобальту (або солі хрому) і прожарити до утворення прозорих забарвлених “перлів” бури. Записати рівняння реакцій. Дослід 4. Взаємодія алюмінію з водою Алюмінієвий дротик зачистити наждачним папером та помістити один кінець в пробірку з водою. Через деякий час спостерігати виділення бульбашок газу. Написати рівняння реакції взаємодії алюмінію з водою. При яких умовах можлива ця реакція? Дослід 5. Відношення алюмінію до кислот і луг. (Дослід проводити у витяжній шафі) У три сухі пробірки помістити приблизно однакові шматочки алюмінію і додати в першу 5-6 крапель розчину концентрованої хлоридної кислоти, в другу – 5-6 крапель розчину концентрованої н
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 513; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.016 с.) |

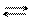 [Zn(NH3)4]2+ Zn2+ + 4NH3.
[Zn(NH3)4]2+ Zn2+ + 4NH3. .
. .
. NiSO4 Nі2+ + SO42-
NiSO4 Nі2+ + SO42-

 , в одну додати 3 каплі розчину гексанітрокобальтат (Ш) натрію
, в одну додати 3 каплі розчину гексанітрокобальтат (Ш) натрію  , в другу – 3 каплі розчину
, в другу – 3 каплі розчину 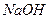 , в третю – 3 краплі розчину
, в третю – 3 краплі розчину  . На підставі спостережень зробити висновок про характер електролітичної дисоціації
. На підставі спостережень зробити висновок про характер електролітичної дисоціації  прилити 2 краплі амоній роданіду
прилити 2 краплі амоній роданіду 
 . Напишіть рівняння відповідної реакції, що є характерною для ферум (III) –йона
. Напишіть рівняння відповідної реакції, що є характерною для ферум (III) –йона  і тому при необхідності застосовується для його виявлення у відповідній якісній реакції.
і тому при необхідності застосовується для його виявлення у відповідній якісній реакції. прилийте 2 краплі амоній роданіду
прилийте 2 краплі амоній роданіду  . З’являється чи ні червоне забарвлення? В розчині
. З’являється чи ні червоне забарвлення? В розчині  присутні йони
присутні йони  і додати по краплям розчин натрій гідроксиду
і додати по краплям розчин натрій гідроксиду  дорівнює 6. Дати назву одержаній комплексній сполуці.
дорівнює 6. Дати назву одержаній комплексній сполуці.
 . Скласти рівняння реакцій. Розчин залишити для досліду 8.
. Скласти рівняння реакцій. Розчин залишити для досліду 8. . Відмітьте колір утворенного осаду та складіть рівняння реакції.
. Відмітьте колір утворенного осаду та складіть рівняння реакції. . Спостерігати утворення синього осаду. Скласти рівняння реакції.
. Спостерігати утворення синього осаду. Скласти рівняння реакції. і подкислити його 2-3 краплями 2 н.
і подкислити його 2-3 краплями 2 н.  . Далі додати 5 крапель розчину гексаціаноферат (II) калію. Знебарвлення
. Далі додати 5 крапель розчину гексаціаноферат (II) калію. Знебарвлення  розчинити у 6-7 краплях води. Відмітити забарвлення розчину. Нагріти розчин до зміни його забарвлення. Визначити будову комплексу до та після нагрівання. Висновки зробити з урахуванням кольору гідратних ізомерів:
розчинити у 6-7 краплях води. Відмітити забарвлення розчину. Нагріти розчин до зміни його забарвлення. Визначити будову комплексу до та після нагрівання. Висновки зробити з урахуванням кольору гідратних ізомерів: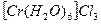 -синьо-фіолетовий
-синьо-фіолетовий -темно-зелений
-темно-зелений -світло-зелений.
-світло-зелений. . Відмітити, додавання якого реактиву спричиняє утворення осаду. Користуючись значеннями
. Відмітити, додавання якого реактиву спричиняє утворення осаду. Користуючись значеннями  комплексів та ДР гідроксиду та сульфіду купруму поясніть експериментальні дані.
комплексів та ДР гідроксиду та сульфіду купруму поясніть експериментальні дані.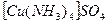 ;
; 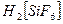 ;
;  ;
;  ;
;  указати зовнішню та внутрішню сфери, комплексоутворювач, ліганди, координаційне число комплексоутворювача, заряд комплексного йону та комплексоутворювача. Указати до яких класів неорганічних сполук належать ці комплекси. Записати їх назви.
указати зовнішню та внутрішню сфери, комплексоутворювач, ліганди, координаційне число комплексоутворювача, заряд комплексного йону та комплексоутворювача. Указати до яких класів неорганічних сполук належать ці комплекси. Записати їх назви. ;
;  ;
;  , якщо комплексоутворювачами є йони
, якщо комплексоутворювачами є йони 
 ;
; 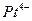 .
. ;
; 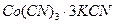 ;
;  . Назвати одержані сполуки, написати рівняння їх дисоціації.
. Назвати одержані сполуки, написати рівняння їх дисоціації. та
та  . Написати вирази їх констант нестійкості.
. Написати вирази їх констант нестійкості. .
. ;
; 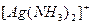 ;
;  . Якщо:
. Якщо: +
+ 
 +
+  (надл.)
(надл.)  +
+  *
* 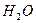 (надл.)
(надл.)  МеОН Ме+ + ОН-
МеОН Ме+ + ОН- та калію
та калію  .
. . Реакцію проводити при охолодженні розчину водою з під крана і потиранні внутрішніх стінок паличкою. Спостерігати утворення білого дрібнокристалічного осаду. Скласти рівняння реакцій в молекулярній та йонній формах.
. Реакцію проводити при охолодженні розчину водою з під крана і потиранні внутрішніх стінок паличкою. Спостерігати утворення білого дрібнокристалічного осаду. Скласти рівняння реакцій в молекулярній та йонній формах. .
.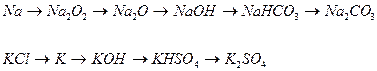
 ; б)
; б)  ; в)
; в)  .
.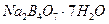 , розчинити його у 10 краплях дистильованої води та нагріти на полум’ї пальника до зникнення кристалів. До одержаного насиченого розчину додати 2-3 краплі концентрованої сульфатної кислоти. Охолодити пробірку з сумішшю під краном. Відмітити колір утворених кристалів ортоборної кислоти. Написати рівняння реакції. Пояснити, чому сульфатна кислота витисняє борну кислоту.
, розчинити його у 10 краплях дистильованої води та нагріти на полум’ї пальника до зникнення кристалів. До одержаного насиченого розчину додати 2-3 краплі концентрованої сульфатної кислоти. Охолодити пробірку з сумішшю під краном. Відмітити колір утворених кристалів ортоборної кислоти. Написати рівняння реакції. Пояснити, чому сульфатна кислота витисняє борну кислоту.


