
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення молярної концентрації еквівалента натрій гідроксиду за титрованим розчином сульфатної кислотиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В основу даного методу титриметричного аналізу лежить реакція повної нейтралізації сульфатної кислоти натрій гідроксидом. Стрибок титрування знаходиться в межах рН від 4 до 10. У якості індикатора можна використовувати як метиловий червоний, так і фенолфталеїн. Точці еквівалентності відповідає нейтральне середовище. Лабораторне обладнання: Бюретка закріплена на штативі; піпетка; дозатор; колба для титрування; воронка. Завдання: - Бюретку заповнити розчином натрій гідроксиду та встановити рівень рідини на нульову позначку. - Відібрати за допомогою піпетки 10мл розчину сульфатної кислоти з відомою концентрацією і перенести в колбу для титрування. - Додати в цю ж колбу 2-4 краплі розчину фенолфталеїну. - Титрувати розчин сульфатної кислоти розчином натрій гідроксиду до появи стійкого блідо-рожевого забарвлення. Зафіксувати об’єм аналіту, що було витрачено. - Титрування повторити ще 2 рази, дані занести до таблиці, навести рівняння реакції та розрахувати молярну концентрацію еквіваленту у розчині.
Таблиця
Об’єм розчину натрій гідроксиду розраховують як середнє арифметичне, виходячи з певної кількості дослідів:
Молярну концентрацію еквівалента натрій гідроксиду в розчині обчислюють за формулою:
c(NaOH) = c( = моль/л.
____________________________________________________________________________________________________________________________________________________________________________________________________________
Заняття 6. Буферні системи, їх біологічна роль. Мета (знати, вміти): – знати механізм дії буферних систем та їх роль у підтримці кислотно-лужної рівноваги в біосистемах; – в міти готувати буферні системи із заданим рН; – вміти визначати межі, в яких буферні системи виявляють свою дію. Основні поняття теми заняття: буферний розчин, кислотні буфери, основні буфери, амфолітние буфери, буферна ємність. Література: 1. Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [129-139] 2. Медична хімія: Підр. для вузів/В.О. Калібабчук, Л.І. Грищенко, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: Інтермед, 2006 – 460 с. [156-169]
Теоретичні питання: Буферні розчини, їх класифікація. Рівняння Гендерсона-Гассельбаха. Механізм буферної дії. Буферна ємність. Буферні системи крові. Бікарбонатний буфер, фосфатний буфер. Білкові буферні системи. Поняття про кислотно-основний стан крові.
Тести та вправи до самостійної роботи: 1. Буферний розчин – це система, що здатна зберігати постійне значення: а) добутку молярних концентрацій компонентів буфера; б) водневого показника рН; в) константи дисоціації слабкого електроліту буфера Кд; г) іонного добутку води д) константи дисоціації води Кд (Н2О).
2. Головними чинниками, що впливають на величину рН буферного розчину, є: а) іонний добуток води Кв; б) добуток молярних концентрацій компонентів буфера; в) рКд слабкого електроліту та співвідношення молярних концентрацій компонентів буфера, температура; г) концентрація буферного розчину
3. Із наведених пар речовин вибрати компоненти фосфатного буфера: а) NaH2PO4, Na3PO4; б) Na2HPO4, NaH2PO4; в) Na2HPO4, Na3PO4; г) Na3PO4, NaOH.
4. Із наведених пар речовин вибрати компоненти гемоглобінового буфера: а) HHb, KHb; б) HHb, Mg(Hb)2; в) KHb, NaHbO2; г) KHb, HHbO2.
5. Написати іонне рівняння реакції, що пояснює механізм дії амонійного буфера при додаванні до нього помірної кількості калій гідроксиду.
6. Написати іонне рівняння реакції, що пояснює механізм дії гідрокарбонатного буфера при додаванні до нього помірної кількості натрій гідроксиду.
7. Написати іонне рівняння реакції, що пояснює механізм дії ацетатного буфера при додаванні до нього помірної кількості хлоридної кислоти.
8. Користуючись величинами Кд слабких електролітів, вибрати оптимальний буфер для проведення дослідів при рН 7,40: а) рКд (СН3СООН) = 4,76; б) рКд1 (СО2∙Н2О) = 6,35; в) рКд (Н2РО4–) = 7,20; г) рКд (NH3∙H2O) = 4,74.
9. рН основного буфера дорівнює (формула Гендерсона-Гассельбаха): а) в)
10. Буферні розчини здатні: а) підтримувати постійне значення рН при безмежному розведенні; б) підтримувати постійне значення рН при додаванні будь-яких кількостей сильної кислоти або лугу; в) підтримувати постійне значення рН тільки при додаванні порівнянню невеликих кількостей сильних кислот або лугів та обмеженому розведенні.
11. Буферна ємність залежить від: а) об’єму буферного розчину; б) кількості доданої сильної кислоти чи сильної основи; в) співвідношення кількості компонентів кислотно–основної пари; г) концентрації солі у розчині і не залежить від концентрації слабкої кислоти чи слабкої основи.
12. Чим більша концентрація кожного із компонентів кислотно–основної пари, тим буферна ємність такого розчину: а) вища; б) нижча; в) не залежить від концентрації компонентів.
13. Буферна ємність розчину приймає найбільше значення, якщо: а) співвідношення концентрацій компонентів буферної суміші більше 1; б) співвідношення концентрацій компонентів буферної суміші менше 1; в) співвідношення концентрацій компонентів буферної суміші =1; г) співвідношення концентрацій компонентів буферної суміші не впливає на величину буферної ємності.
14. В міру поступового додавання до буферного розчину сильної кислоти або лугу стійкість розчину до зміни рН: а) поступово зменшується; б) залишається постійною; в) поступово збільшується; г) різко зменшується.
15. Буферні системи при поступовому додаванні значної кількості сильної кислоти або лугу змінюють рН: а) негайно, практично миттєво; б) не реагують на зміну рН; в) поступово; г) спочатку підвищують значення рН розчину на одиницю, а потім зменшують на одиницю.
16. Вкажіть область рН ефективної дії ацетатної буферної суміші: a) рН = 3,7 – 5,7; б) рН = 8,2 – 10,2; в) рН = 9,3 – 11,3; г) рН = 6,2 – 8,2.
17. Органами, що беруть участь в регуляції кислотно-основної рівноваги в організмі людини є: а) легені, залози внутрішньої секреції, печінка, мозок, серце, нирки; б) легені, шкіра, кишково- шлунковий тракт, мозок; в) печінка, кишково- шлунковий тракт, легені, серце; г) легені, нирки, кишково-шлунковий тракт, печінка, залози внутрішньої секреції, шкіра.
18. Співвідношення молярних концентрацій компонентів гідрогенкарбонатного буфера а) 18: 2; б) 20: 1; в) 15: 1; г) 18: 3.
19. Фосфатний буфер в організмі людини міститься в: а) крові, сечі, травних соках; б) крові, сечі, слині; в) крові, слині, лімфі; г) крові, соках підшлункової залози та шлунку, мозку.
20. Найбільший вміст у крові людини буферу: а) аміачного; б) фосфатного; в) гідрогенкарбонатного; г) гемоглобінового.
21. Важкі форми цукрового діабету супроводжуються порушенням кислотно-основної рівноваги в організмі і виникненням ацидозу. Яке значення рН крові відповідає цьому захворюванню: а) 7,7 – 7,9; б) 7,1 – 7,2; в) 7,35 – 7,65; г) 7,85 – 8,15; д) 8,65 – 8,85?
22. Відомо, що при ішемічній хворобі серця відбувається зміщення кислотно-основної рівноваги в кислу область. На скільки одиниць змінюється при цьому рН крові? а) збільшується на 0,7 – 1,0; б) збільшується на 1,0 – 2,0; в) зменшується на 1,5 – 2,0; г) зменшується на 0,2 – 0,3; д) збільшується на 0,4 – 0,5?
23. Буферна ємність внутрішнього середовища еритроцитів зумовлена наявністю: а) гідрогенкарбонатної (H2CO3/KHCO3) та фосфатної (KH2PO4/K2HPO4) буферних систем; б) гідрогенкарбонатної (H2CO3/KHCO3), фосфатної (KH2PO4/K2HPO4) та білкової буферних систем; в) гідрогенкарбонатної (H2CO3/KHCO3) буферної системи; г) гідрогенкарбонатної (H2CO3/KHCO3) та білкової буферних систем.
24. Гідрокарбонатна буферна система більш ефективно компенсує дію речовин:
а) які збільшують основність крові, ніж речовин, які збільшують кислотність крові; б) які зменшують кислотність крові; в) які збільшують кислотність крові; г) в однаковій мірі компенсує дію речовин, що призводять до зміни кислотно–основного стану крові.
25. Надлишок CO2 в атмосфері приводить до додаткового розчинення CO2 у крові (згідно з законом Генрі). Це, в свою чергу, викликає: а) підвищення рН крові (алкалоз); б) зниження рН крові (ацидоз); в) не змінює рН крові.
26. Яка буферна система з перерахованих буферних систем крові має найбільшу буферну ємність: а) гідрогенкарбонатна; б) гемоглобінова; в) фосфатна; г) амінокислотна.
26. Яка буферна система з перерахованих буферних систем крові має найбільшу буферну ємність: а) гідрогенкарбонатна; б) гемоглобінова; в) фосфатна; г) амінокислотна.
ЛАБОРАТОРНА РОБОТА №6
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 1071; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.163.233 (0.012 с.) |

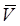 (NaOH), мл
(NaOH), мл
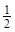 H2SO4), моль/л
H2SO4), моль/л

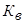 ;
;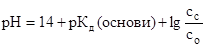 ; б)
; б)  ;
;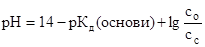 ; г)
; г) 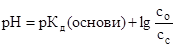 .
.
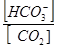 в плазмі крові при рН 7,4 має бути:
в плазмі крові при рН 7,4 має бути: амонійного буферного розчину, приготованого з 600мл розчину амоній хлориду з
амонійного буферного розчину, приготованого з 600мл розчину амоній хлориду з 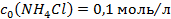 і 800мл розчину амоніаку з
і 800мл розчину амоніаку з 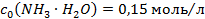 .
. 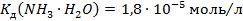
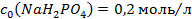 та 250мл розчину натрій гідрогенфосфату з
та 250мл розчину натрій гідрогенфосфату з 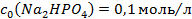 .
. 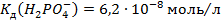 .
.
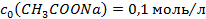 і 300мл розчину оцтової кислоти з
і 300мл розчину оцтової кислоти з 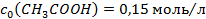 .
. 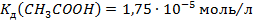
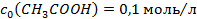 і
і 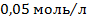 та
та 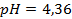 .
. 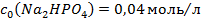 та натрій дигідрогенфосфату з
та натрій дигідрогенфосфату з 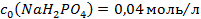 , а також води, які необхідно змішати, щоб отримати 750мл фосфатного буферного розчину з молярною концентрацією
, а також води, які необхідно змішати, щоб отримати 750мл фосфатного буферного розчину з молярною концентрацією 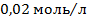 та
та 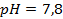 .
. 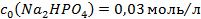 і
і 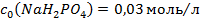 , необхідні для приготування 600мл фосфатного буферного розчину з
, необхідні для приготування 600мл фосфатного буферного розчину з 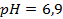 .
. 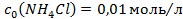 і
і 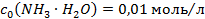 , які потрібно змішати, щоб приготувати 1500мл амонійного буферного розчину з
, які потрібно змішати, щоб приготувати 1500мл амонійного буферного розчину з 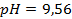 .
.  на зменшення
на зменшення 


