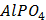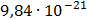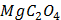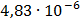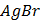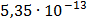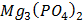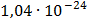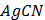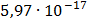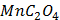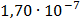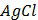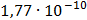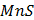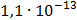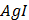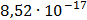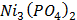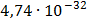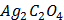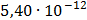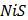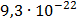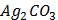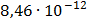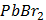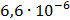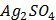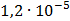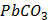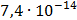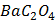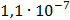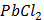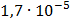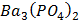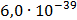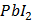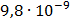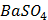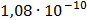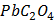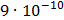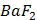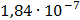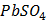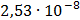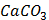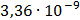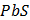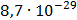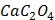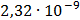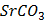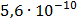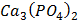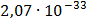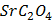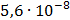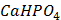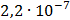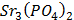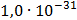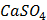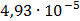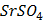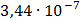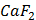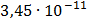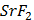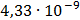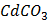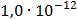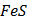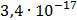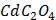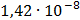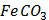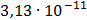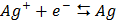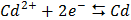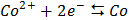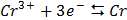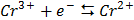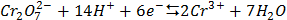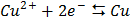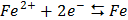Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення порогу коагуляціїСодержание книги
Поиск на нашем сайте
Згідно з емпіричним правилом Шульце-Гарді поріг коагуляції зменшується зі збільшенням заряду іонів, що викликають коагуляцію. За ознакою помутніння розчину в пробірках при додаванні розчину коагулюючого електроліту визначають його найменшу молярну концентрацію еквівалента, здатну викликати коагуляцію золю. Завдання: - Заповнити одну бюретку розчином калій дихромату (с ( - Перенести у дві пробірки за допомогою піпетки по 5мл золю ферум (ІІІ) гідроксиду. - Додати по краплях, добре перемішуючи, в одну з пробірок розчин калій дихромату, в другу - розчин калій гексаціаноферату (ІІІ) до спостереження коагуляції. - Результати занести до таблиці. Розрахувати пороги коагуляції, коагулюючу здатність, зробити висновок про відносну коагулюючу здатність електролітів.
Таблиця
Поріг коагуляції розраховують за формулою:
Коагулюючу здатність електролітів визначають як:
СК (1/2К2Cr2O7) = = ммоль/л
СК (1/3K3[Fe(CN)6]) = = ммоль/л
VК(К2Cr2O7) = = л/моль
VК(K3[Fe(CN)6]) = = л/моль
________________________________________________________________________________________________________________________________________
ЛАБОРАТОРНА РОБОТА №18 ВИЗНАЧЕННЯ ІЗОЕЛЕКТРИЧНОЇ ТОЧКИ (ІЕТ) АЛЬБУМІНУ СИРОВАТКИ КРОВІ Важливою характеристикою білка є його ізоелектрична точка - значення рН розчину, при якому максимальна кількість макромолекули білка знаходиться в ізоелектричному стані, при якому сумарний заряд макромолекул дорівнює нулю. ІЕТ можна визначити за спостереженням помутніння розчинів білків з різними значеннями рН при додаванні до них водовіднімаючого агента. Завдання: - У сім пробірок налити по 1мл відповідного буферного розчину. Ацетатні буферні суміші приготовані з розчинів, взятих у співвідношеннях, що вказані в таблиці. c0(CH3COOH) = с0(CH3COONa) = 0,1 моль/л. - В кожну пробірку додати по 1мл розчину альбуміну сироватки крові та по 0,5мл розчину водовіднімаючої речовини. Вміст пробірок перемішати. Зачекати 5 хв. - Відзначити в яких випадках спостерігається помутніння. Визначити рН та знак заряду макромолекули білка для кожного з розчинів, встановити ІЕТ альбуміну сироватки крові.
Таблиця
Обчислюють рН буферних розчинів за формулою:
Кд(СН3СООН) = 1,75∙10-5 моль/л.
рН1 = = рН2 = = рН3 = = рН4 = = рН5 = = рН6 = = рН7 = =
ДОВІДКОВА ІНФОРМАЦІЯ
МАТЕМАТИЧНІ ОПЕРАЦІЇ Логарифм числа b з основою a – це показник ступеня, в яку необхідно возвести число a, щоб отримати число b.
таблиця десяткових логарифмів
приклад розрахунку pH за значенням [H+] [H+] = 5,3∙10-1 моль/л. pH = - lg [H+] = - lg 5,3 ∙10-1 = -(0,724 - 1) = -(-0,276) ≈ 0,28 приклад розрахунку [H+] за значенням pH pH = 0,42. [H+] = anti lg (-pH) = anti lg (-0,42) = anti lg (0,580 - 1) = 3,8 ∙10-1 моль/л
ТЕРМОДИНАМІЧНІ ВЛАСТИВОСТІ ДЕЯКИХ РЕЧОВИН
ТЕПЛОТИ ЗГОРЯННЯ ДЕЯКИХ РЕЧОВИН
ДОБУТКИ РОЗЧИННОСТІ ДЕЯКИХ МАЛОРОЗЧИННИХ ЕЛЕКТРОЛІТІВ ПРИ 25ºС
СТАНДАРТНІ ЕЛЕКТРОДНІ ПОТЕНЦІАЛИ У ВОДНИХ РОЗЧИНАХ ПРИ 25ºС
РЯД АКТИВНОСТІ МЕТАЛІВ / ЕЛЕКТРОХІМІЧНИЙ РЯД НАПРУГ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 615; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.66.200 (0.011 с.) |

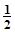 К2Cr2O7) = 2ммоль/л), а другу - розчином калій гексаціаноферату (ІІІ) (с (
К2Cr2O7) = 2ммоль/л), а другу - розчином калій гексаціаноферату (ІІІ) (с (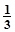 K3[Fe(CN)6]) = 2ммоль/л).
K3[Fe(CN)6]) = 2ммоль/л).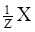 ),
ммоль/л
),
ммоль/л
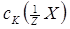 , ммоль/л
, ммоль/л
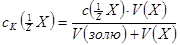
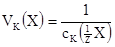
 де
де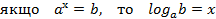
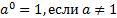
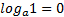
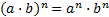
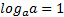
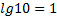
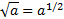
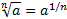
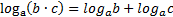
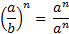
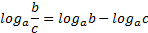
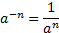
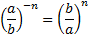
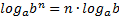
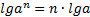
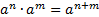
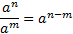
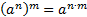
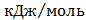
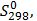
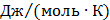
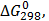
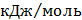
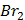
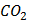
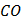
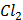
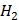
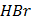
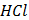
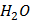
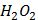
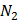

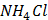
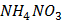
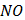
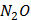
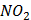
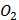
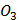
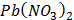
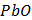
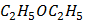
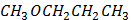
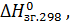
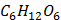 (глюкоза)
(глюкоза)
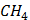
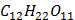 (сахароза)
(сахароза)