
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення теплот нейтралізаціїСодержание книги
Поиск на нашем сайте
Теплота нейтралізації кислот лугами залежить від характеру дисоціації кислоти у розчині. Завдання: - В склянку Дьюара або термостат ємністю 250мл перенести за допомогою мірного циліндра 25мл розчину натрій гідроксиду з с (NaOH) = 1моль/л. - Обережно занурити в ємність термометр та виміряти початкову температуру розчину (Т1). - Відміряти мірним циліндром 25мл розчину сірчаної кислоти з с (1/2 Н2SO4) = 1моль/л. - Обережно перемішуючи скляною паличкою розчин лугу, швидко долити до нього розчин кислоти. - Зафіксувати температуру після зливання розчинів (Т2). Результати вимірювань занести в таблицю. - Повторити методику з використанням розчинів наступних кислот: HCl, HNO3, CH3COOH. Навести хімічні рівняння відповідних реакцій, розрахувати значення теплот нейтралізації.
Таблиця
Розрахунки проводять за формулою: ΔНнейтр. = С – теплоємність розчину, яка дорівнює 4,18кДж/К; V(к-ти) – об’єм розчину кислоти, л; V(лугу) – об’єм розчину лугу, л; ρ – густина розчину, що приблизно дорівнює 1кг/л; c(1/z к-ти) – молярна концентрація еквіваленту кислоти, моль/л.
ΔНнейтр.(Н2SO4) = = кДж/моль ΔНнейтр.(HCl) = = кДж/моль ΔНнейтр.(HNO3) = = кДж/моль ΔНнейтр.(CH3COOH) = = кДж/моль ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Заняття 9. Кінетика біохімічних реакцій. Мета (знати, вміти): – аналізувати залежність швидкості хімічних реакцій від концентрації і температури; – інтерпретувати залежність швидкості хімічної реакції від енергії активації; – аналізувати особливості дії каталізаторів і пояснювати механізм гомогенного і гетерогенного каталізу; – аналізувати гетерогенні рівноваги в порожнині рота; – пояснювати механізм дії ферментів і аналізувати залежність швидкості ферментативних процесів від концентрації ферменту і субстрату.
Основні поняття теми заняття: швидкість хімічної реакції, константа швидкості реакції, порядок реакції, енергія активації реакції, каталіз.
Література: 1. Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [63-76] 2. Медична хімія: Підр. для вузів/В.О. Калібабчук, Л.І. Грищенко, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: Інтермед, 2006 – 460 с. [78-97]
Теоретичні питання: Хімічна кінетика як основа для вивчення швидкостей та механізму біохімічних реакцій. Швидкість реакції. Залежність швидкості реакції від концентрації. Закон діючих мас для швидкості реакції. Константа швидкості. Порядок реакції. Кінетичні рівняння реакцій першого, другого та нульового порядків. Період напівперетворення - кількісна характеристика зміни концентрації в довкіллі радіонуклідів, пестицидів тощо. Поняття про механізм реакції. Молекулярність реакції. Залежність швидкості реакції від температури. Правило Вант-Гоффа. Особливості температурного коефіцієнту швидкості реакції для біохімічних процесів. Енергія активації. Теорія активних співударів. Рівняння Арреніуса. Поняття про теорію перехідного стану (активованого комплексу). Уявлення про кінетику складних реакцій: паралельних, послідовних, супряжених, оборотних, конкуруючих, ланцюгових. Поняття про антиоксиданти. Вільнорадикальні реакції в живому організмі. Фотохімічні реакції, фотосинтез. Каталіз та каталізатори. Особливості дії каталізаторів. Гомогенний, гетерогенний та мікрогетерогенний каталіз. Кислотно-основний каталіз. Автокаталіз. Механізм дії каталізаторів. Промотори та каталітичні отрути. Уявлення про кінетику ферментативних реакцій. Ферменти як біологічні каталізатори. Особливості дії ферментів: селективність, ефективність, залежність ферментативної дії від температури та реакції середовища. Поняття про механізм дії ферментів. Залежність швидкості ферментативних процесів від концентрації ферменту та субстрату. Активація та інгібірування ферментів. Вплив екологічних факторів на кінетику ферментативних реакцій.
Тести та вправи до самостійної роботи: 1. Із наведених вказати елементарну (просту) реакцію: а) H2 + Cl2 в) H2 + I2
2. Вказати кінетичне рівняння в загальному вигляді для реакцій нульового порядку:
а) V = k[A][B]; б) V = k[A]2[B]; в) V = k; г) V = k[A].
3. Вказати одиниці, в яких вимірюється константа швидкості реакції другого порядку: а) с-1; б)
4. Константа швидкості хімічної реакції (k) не залежить від: а) природи реагуючих речовин; б) природи розчинника; в) температури; г) концентрації реагуючих речовин (в певних межах).
5. Порядок реакції за речовиною А у кінетичному рівнянні V = k[A]n[B]m дорівнює: а) [A]; б) n; в) [B]; г) m; д) n+ m.
6. Порядок реакції за O2 у кінетичному рівнянні V = k[NO]2[O2] дорівнює: а) 0; б) 1; в) 2; г) 3.
7. Загальний порядок реакції, якщо константа швидкості цієї реакції вимірюється у с-1, є: а) 0; б) 1; в) 2; г) 3.
8. Серед наведених реакцій вказати ланцюгову: а) CH3COO- + H2O = CH3COOH + OH-; б) H2 + Cl2 в) H2 + I2
9. Температурний коефіцієнт Вант-Гоффа для більшості біохімічних реакцій має значення в межах: а) 2-4; б) 4-6; в) 2-6; г) 7-9.
10. При підвищенні температури швидкість хімічної реакції, як правило, збільшуєься, тому що: а) збільшується енергія активації; б) зменшується енергія активації; в) збільшується концентрація активних молекул; г) зменшується концентрація активних молекул.
11. Вказати величини, які необхідні для визначення енергії активації за рівнянням Арреніуса: а) тільки К1 і К2; б) тільки Т1 і Т2; в) К1; К2; Т1; Т2; г) тільки К1 і Т1; д) тільки К2 і Т2.
12. Каталізатор збільшує швидкість хімічної реакції тому що: а) зменшує енергію активації; б) збільшує енергію активації; в) не впливає на енергію активації; г) спочатку збільшує, а потім зменшує енергію активації.
13. Промотор (активатор) – речовина, яка в досить незначній кількості: а) зменшує активність каталізатора; б) не впливає на активність каталізатора; в) збільшує активність каталізатора; г) спочатку збільшує, а потім зменшує активність каталізатора.
14. Інгібітор – це речовина, яка в досить незначній кількості: а) зменшує активність каталізатора; б) збільшує активність каталізатора; в) не впливає на активність каталізатора; г) спочатку збільшує, а потім зменшує активність каталізатора;
15. Ферменти (ензими) – біокаталізатори, що мають: а) вуглеводну природу; б) вуглеводневу природу; в) білкову природу; г) жирову природу.
16. Каталітична активність ферментів у порівнянні зі звичайними каталізаторами: а) менша; б) більша; в) значно більша; г) однакова.
17. Активність ферментів залежить від температури. Вказати оптимальні значення температури (у °С) для більшості ферментів: а) 30-36; б) 37-40; в) 40-43; г) 50-60.
18. Залежність швидкості ферментативної реакції від концентрації субстрату описує рівняння: а) Ареніуса; б) Вант-Гоффа; в) Міхаеліса-Ментен; г) Рауля.
20. При гідролізі сахарози в 1л водного розчину при 50оС в присутності кислоти (рН=1) за 30 хвилин утворилось 17,8 г глюкози. Визначити середню швидкість гідролізу сахарози.
21. Лужний гідроліз етилацетату – реакція 2-го порядку з константою швидкості
22. В скільки разів збільшиться константа швидкості хімічної реакції при підвищенні температури від 0 оС до 70оС, якщо γ = 2?
23. На скільки градусів слід підвищити температуру, щоб швидкість реакції зросла в 256 разів (γ = 4)?
ЛАБОРАТОРНА РОБОТА №9
|
||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 508; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.254.161 (0.007 с.) |

 к-ти), моль/л
к-ти), моль/л
 , де
, де 2HCl; б) 2H2 + O2
2HCl; б) 2H2 + O2  2H2O;
2H2O; ; в)
; в)  ; г)
; г)  .
.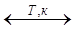 2NH3.
2NH3. при 25ºС. Вихідні концентрації такі:
при 25ºС. Вихідні концентрації такі:  ;
;  . Обчислити а) початкову швидкість реакції; б) концентрацію етилацетату та швидкість реакції в момент, коли концентрація іонів
. Обчислити а) початкову швидкість реакції; б) концентрацію етилацетату та швидкість реакції в момент, коли концентрація іонів  буде рівною
буде рівною  .
.


