
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення нормального окисно-відновного потенціалуСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Визначення ґрунтується на залежності окисно-відновного потенціалу системи від співвідношення активностей окисленої та відновленої форм речовин у розчині. Нормальний окисно-відновний потенціал дорівнює потенціалу системи, в якому співвідношення активностей окисленої та відновленої форм речовин в розчині дорівнює 1.
Завдання: - Із вихідних розчинів солей K3[Fe(CN)6] і K4[Fe(CN)6] з молярними концентраціями по 0,1 моль/л приготувати суміші згідно співвідношенню вказаному у таблиці. - За допомогою рН-метра з платиновим та хлорсрібним електродами виміряти ЕРС приготованих системи. - Занести експериментальні дані у таблицю, розрахувати відповідні значення окисно-відновних потенціалів.
Таблиця
Окисно-відновний потенціал системи обчислюють за формулою:
Стандартний окисно-відновний потенціал знаходять за рівнянням Петерса:
c([Fe(CN)6]3-) = с(K3[Fe(CN)6]) ∙ V(K3[Fe(CN)6]) / V(K3[Fe(CN)6]) + V(K4[Fe(CN)6]); с([Fe(CN)6]4-) = с(K4[Fe(CN)6]) ∙ V(K4[Fe(CN)6]) / V(K4[Fe(CN)6]) + V(K3[Fe(CN)6]).
c1([Fe(CN)6]3-) = =, моль/л
с1([Fe(CN)6]4-) = =, моль/л
c2([Fe(CN)6]3-) = =, моль/л с2([Fe(CN)6]4-) = =, моль/л
c3([Fe(CN)6]3-) = =, моль/л
с3([Fe(CN)6]4-) = =, моль/л
= =, В
= =, В
= =, В
________________________________________________________________________________________________________________________________________
Заняття 12. Сорбція біологічно-активних речовин. Іонний обмін. Хроматаграфія. Мета (знати, вміти): – робити висновки про поверхневу активність речовин на основі їх будови; – аналізувати особливості будови поверхневого шару адсорбованих молекул поверхнево- активних сполук, пояснювати принципи будови біологічних мембран; – аналізувати рівняння адсорбції та межі їх використання, розрізняти мономолекулярну і полімолекулярного адсорбцію; – інтерпретувати закономірності адсорбції речовин з розчинів на твердій поверхні; – пояснювати фізико-хімічні основи методів адсорбційної терапії; – розрізняти вибіркову і іонообмінну адсорбцію електролітів; – інтерпретувати методи хроматографічного аналізу та їх роль в медико-біологічних дослідженнях.
Основні поняття теми заняття: поверхневий натяг, поверхнево-активні речовини, абсорбція, адсорбція, іоніти, хроматографія. Література: 1. Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [178-207] 2. Медична хімія: Підр. для вузів/В.О. Калібабчук, Л.І. Грищенко, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: Інтермед, 2006 – 460 с. [206-239] Теоретичні питання: Поверхневі явища та їх значення в біології та медицині. Поверхневий натяг рідин та розчинів. Ізотерма поверхневого натягу. Поверхнево-активні та поверхнево-неактивні речовини. Поверхнева активність. Правило Дюкло-Траубе. Адсорбція на межі поділу рідина-газ та рідина-рідина. Рівняння Гіббса. Орієнтація молекул поверхнево-активних речовин у поверхневому шарі. Уявлення про структуру біологічних мембран. Адсорбція на межі поділу тверде тіло-газ. Рівняння Ленгмюра. Адсорбція із розчину на поверхні твердого тіла. Фізична та хімічна адсорбція. Закономірності адсорбції розчинених речовин, парів та газів. Рівняння Фрейндліха. Фізико-хімічні основи адсорбційної терапії (гемосорбція, плазмосорбція, лімфосорбція, ентеросорбція, аплікаційна терапія). Імуносорбенти. Адсорбція електролітів: специфічна (вибірна) та іонообмінна. Правило Панета-Фаянса. Іонообмінники природні та синтетичні. Роль адсорбції та іонного обміну в процесах життєдіяльності рослин і організмів. Хроматографія. Класифікація хроматографічних методів аналізу за ознакою агрегатного стану фаз, техніки виконання та механізму розподілу. Адсорбційна, іонообмінна та розподільча хроматографія. Застосування хроматографії в біології та медицині.
Тести та вправи до самостійної роботи: 1. Поглинання однієї речовини об’ємом іншої називається: а) адсорбцією; б) абсорбцією; в) десорбцією; г) сольватацією.
2. Як із підвищенням температури змінюється фізична адсорбція речовин: а) збільшується; б) не змінюється; в) зменшується; г) спочатку збільшується, а потім зменшується?
3. Адсорбційна рівновага характеризується: а) досягненням максимальної величини адсорбції; б) відсутністю десорбції; в) наявністю як фізичної адсорбції, так і хемосорбції; г) сталістю температури системи; д) рівністю швидкостей адсорбції та десорбції?
4. Адсорбція карбонової кислоти з розчину на твердій поверхні не залежить від: а) природи кислоти; б) природи адсорбенту; в) температури г) тиску; д) концентрації кислоти; е) природи розчинника?
5. Який з іонів вибірково адсорбуватиметься з водного розчину на кристалі аргентум хлориду: а) Ag+; б) К+; в) Cu2+; г) NO3–; д) OH–?
6. В якому з рядів катіони розташовані згідно із зростанням їх адсорбційної здатності: а) Cs+, Rb+, K+, Na+, Li+; б) Rb+, K+, Na+, Li+, Cs+; в) Li+, Na+, K+, Rb+, Cs+; г) K+, Na+, Li+, Cs+, Rb+; д) K+, Na+, Li+, Cs+, Rb+?
7. Поверхнева активність має додатнє значення для: а) С6Н12О6 б) СН3NН2 в) NaOH г) NaCl д) K2SO4?
8. Хемосорбцію можна розглядати як: а) проміжну стадію гомогенної реакції; б) проміжну стадію гетерогенної реакції; в) адсорбцію речовини на поверхні за рахунок сил Ван-дер-Ваальса; г) взаємодію речовини з поверхнею, продукти якої можна виділити у вигляді окремих фаз?
9. Адсорбція полярної речовини буде максимальною, якщо вона відбувається: а) на силікагелі з водного розчину; б) на активованому вугіллі з органічного розчинника; в) на силікагелі з органічного розчинника; г) на активованому вугіллі з водного розчину?
10. В яких одиницях вимірюється адсорбція в рівнянні Фрейндліха: а) моль/м2; б) моль/м3; в) ммоль/л; г) ммоль/г; д) ммоль/м2?
11. Характерною особливістю будови молекул поверхнево-активних речовин є: а) дифільність; б) неполярність; в) полярність; г) відсутність вуглеводневого радикалу; д) малий розмір молекули.
12. Знаючи величину граничної адсорбції речовини на поверхні, можна визначити: а) довжину молекули та її масу; б) масу молекули та енергію її зв’язку з поверхнею; в) масу молекули та площу її перерізу; г) довжину молекули та площу її перерізу; д) енергію зв’язку молекули з поверхнею та швидкість адсорбції.
13. Який з варіантів здійснення хроматографічного аналізу суміші компонентів не відноситься до площинної хроматографії: а) розділення суміші на папері для хроматографії; б) розділення суміші в колонці, заповненій адсорбентом; в) розділення суміші на алюмінієвій фользі, покритій тонким шаром адсорбенту; г) розділення суміші на скляній пластинці, покритій тонким шаром адсорбенту?
14. Який процес лежить в основі розподільчої хроматографії: а) утворення важкорозчинних сполук; б) утворення забарвлених сполук; в) розподіл речовини між двома рідинами, що не змішуються (або обмежено змішуються), у строго визначеній пропорції; г) утворення малодисоційованих сполук?
15. Скласти схему очищення води від Na2SO4 за допомогою іонітів.
16. Коефіцієнти розподілу для аспарагінової кислоти та аргініну між толуолом та водою становлять, відповідно, 0,07 та 0,41. Швидкість переміщення їх на папері в суміші толуол – вода буде: а) у аспарагінової кислоти більша, ніж у аргініну; б) у аргініну більша, ніж у аспарагінової кислоти; в) однакова у обох амінокислот.
17. Який з методів адсорбційної терапії заснований на очистці крові хворого від токсичних речовин шляхом її пропускання через колонку з адсорбентом, підключену до системи кровообігу: а) лікворосорбція; б) лімфосорбція; в) плазмосорбція; г) гемосорбція; д) аплікаційна терапія?
18. При використанні толуолу, у якості рухомої фази, води – нерухомої, а паперу – як інертного носія Rf для амінокислот: глютамінова кислота, глікокол та лейцин, відповідно дорівнюють: 0,16, 0,30, 0,79. Який висновок можна зробити щодо відносної гідрофобності цих амінокислот (розташувати їх в ряд за зростанням гідрофобності): а) глікокол, глютамінова кислота, лейцин; б) лейцин, глютамінова кислота, глікокол; в) глютамінова кислота, глікокол, лейцин; г) лейцин, глікокол, глютамінова кислота; д) глікокол, лейцин, глютамінова кислота.
19. Як зміниться поверхнева активність в гомологічному ряді спиртів, якщо довжина вуглеводневого радикалу збільшиться на дві групи –СН2–: а) зменшиться у 2 рази; б) не зміниться; в) збільшиться у 9 разів; г) збільшиться у 2 рази; д) зменшиться у 6 разів.
20. Розрахувати масу лікарського препарату саліцилату натрію, який міститься у водному розчині, якщо відомо, що на титрування фільтрату, отриманого при пропусканні його через іоніт в Н+–формі, пішло 17 мл розчину натрій гідроксиду з молярною концентрацією с (NaOH) = 0,05 моль/л. М(C7H5O2Na) = 160 г/моль.
ЛАБОРАТОРНА РОБОТА №12
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 514; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.200.151 (0.011 с.) |

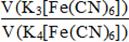

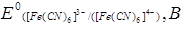
 де ЕХС = 0,222 B.
де ЕХС = 0,222 B.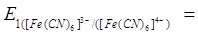 =, В
=, В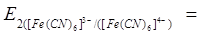 =, В
=, В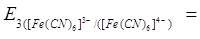 =, В
=, В , де n = __
, де n = __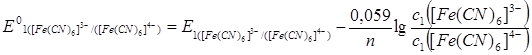 =
=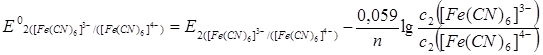 =
=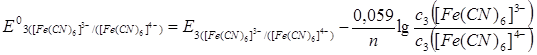 =
=



