
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення буферної ємності ацетатного буферного розчинуСодержание книги
Поиск на нашем сайте Будь-яка буферна суміш практично зберігає сталість рН лише за умови додавання невеликої визначеної кількості кислоти або лугу. Кількісною мірою здатності буферних систем підтримувати рН незмінним є буферна ємність. Вона виражається в моль/л або, частіше, в ммоль/л і обчислюється за такими формулами:
де: Вк – буферна ємність за кислотою; Вл – буферна ємність за лугом; ΔpH – зміна pН буферної системи при додаванні кислоти (лугу); Буферна ємність тим більша, чим більша концентрація компонентів буферного розчину, при цьому співвідношення їх концентрацій має дорівнювати одиниці.
Завдання: – Заповнити одну бюретку розчином ацетатної кислоти, другу - розчином натрій ацетату з с 0(CH3COOH) = с 0(CH3COONa)= 1∙10-2 моль/л. – У двох стаканчиках ємністю 25 мл приготувати буферні розчини об’ємом 10 мл із співвідношенням об’ємів розчинів CH3COOH та CH3COONa рівним одному. – Виміряти рН0 приготовлених буферних розчинів за допомогою рН - метра або іонометра. – Заповнити одну бюретку розчином хлоридної кислоти, другу - розчином натрій гідроксиду з с (HCl) = с (NaOH)=0,1моль/л. – До одного із ацетатних буферів додати розчин HCl (c (HCl)=0,1моль/л) при постійному перемішуванні до зміни рН0 розчину на одиницю – ΔрНк=рН0–рН1=1 (рН1 розчину контролювати за допомогою рН - метра або іонометра). – До другого ацетатного буферного розчину за допомогою бюретки додати розчин NaOH (c (NaOH)=0,1моль/л) при постійному перемішуванні до зміни рН0 розчину на одиницю – ΔрНосн.=рН2–рН0=1 (рН2 розчину контролювати за допомогою рН - метра або іонометра). – Виміряні значення об’єму розчинів HCl і NaOH та рН0, рН1, рН2 занести до таблиці.
Таблиця
с (CH3COOH) = моль/л с (CH3COONa) = моль/л с (HCl) = моль/л с (NaOH) = моль/л
________________________________________________________________________________________________________________________________________________________________
Заняття 7. Колігативні властивості розчинів.
Мета (знати, вміти): – аналізувати взаємозв'язок між колігативними властивостями і концентрацією розчинів; – застосовувати теоретичні положення осмотичних явищ для пояснення процесів в організмі людини. Основні поняття теми заняття: колігативні властивості, осмос, ізотонічний коефіцієнт, гемоліз, плазмоліз, онкотичноготиск, кріоскопія, ебуліоськопія. Література: 1. Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [93-104] 2. Медична хімія: Підр. для вузів/В.О. Калібабчук, Л.І. Грищенко, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: Інтермед, 2006 – 460 с. [119-133]
Теоретичні питання: Колігативні властивості розведених розчинів неелектролітів. Відносне зниження тиску насиченої пари розчинника над розчином. Ідеальні розчини. Зниження температури замерзання та підвищення температури кипіння розчинів у порівнянні з розчинниками. Закони Рауля. Осмос та осмотичний тиск. Закон Вант-Гоффа. Колігативні властивості розведених розчинів електролітів. Ізотонічний коефіцієнт. Гіпо-, гіпер- та ізотонічні розчини. Кріометрія, ебуліометрія, осмометрія, їх застосування в медико-біологічних дослідженнях. Роль осмосу в біологічних системах. Осмотичний тиск плазми крові. Рівняння Галлера. Онкотичний тиск. Плазмоліз та гемоліз.
Тести та вправи до самостійної роботи: 1. Яким буде розчин кальцій хлориду стосовно розчину натрій хлориду, якщо молярні концентрації електролітів однакові: а) ізотонічним; б) гіпертонічним; в) гіпотонічним?
2. Який із розчинів має найбільший осмотичний тиск, якщо масові концентрації розчинених речовин однакові: а) фруктози; б) мальтози; в) рибози; г) глюкози?
3. Який із розчинів має найбільший осмотичний тиск, при однаковій температурі, якщо масові концентрації розчинених речовин однакові: а) калій хлориду; б) літій хлориду; в) амоній хлориду; г) кальцій хлориду; д) натрій хлориду?
4. У якому із розчинів ізотонічний коефіцієнт для NaCl найбільший: а) c(NaCl) = 0,1моль/л; б) c(NaCl) = 0,01моль/л; в) c(NaCl) = 0,05моль/л; г) c(NaCl) = 0,001моль/л?
5. Для якого електроліту ізотонічний коефіцієнт найбільший у таких розчинах: а) c(NaCl) = 0,01моль/л; б) c(KCl) = 0,01моль/л; в) c(K2SO4) = 0,01моль/л; г) c(MgSO4) = 0,01моль/л?
6. Для якого із водних розчинів температура замерзання найнижча: а) b(КCl) = 0,1моль/кг; б) b(KNO3) = 0,1моль/кг; в) b(K2SO4) = 0,1моль/кг; г) b(KBr) = 0,1моль/кг?
7. Для якого із водних розчинів температура замерзання найнижча: а) 10г глюкози на 1000г води; б) 10г рибози на1000г води; в) 10г фруктози на 1000г води; г) 10г сахарози на 1000г води?
8. Який із розчинів натрій хлориду стосовно крові буде гіпотонічним і в ньому буде відбуватися гемоліз: а) c(NaCl) = 1,5моль/л; б) c(NaCl) = 0,5моль/л; в) c(NaCl) = 0,15моль/л; г) c(NaCl) = 0,015моль/л?
9. Який із розчинів при температурі 370С має найменший осмотичний тиск: а) с(NaCl) = 0,1моль/л; б) с(KCl) = 0,1моль/л; в) с(K2SO4) = 0,1моль/л; г) c(глюкози) = 0,1моль/л?
10. Який осмотичний тиск має бути у розчинах лікарських речовин, що застосовують в медичній практиці як ізотонічні по відношенню до крові: а) π = 3,8кПа; б) π = 770Па; в) π = 7,7кПа; г) π = 77,0кПа; д) π = 770кПа?
11. Чому буде дорівнювати ізотонічний коефіцієнт Вант - Гоффа для барій нітрату, якщо ця речовина повністю дисоціює у водному розчині: а) і = 2; б) і = 4; в) і = 3; г) і = 1; д) і = 5?
12. У якому випадку відбувається осмос, якщо через напівпроникну мембрану у контакт приведено розчини солей з однаковою молярною концентрацією: а) NaCl / KCl; б) NaCl / CaCl2; в) CaCl2 / Ca(NO3)2; г) NaCl / NaNO3?
13. Розчини натрій хлориду, літій хлориду, амоній хлориду, калій хлориду, кальцій хлориду замерзають при однакових температурах. Моляльність розчину якого електроліту найменша: а) кальцій хлориду; б) натрій хлориду; в) калій хлориду; г) літій хлориду; д) амоній хлориду?
14. Молярна концентрація якого електроліту найменша, якщо розчини ізотонічні: а) натрій сульфату; б) натрій хлориду; в) натрій нітрату; г) калій хлориду; д) калій нітрату?
15. Осмос – це: а) проникнення тільки молекул розчинника через напівпроникну мембрану; б) проникнення тільки молекул розчиненої речовини через напівпроникну мембрану; в) не проникнення ні молекул розчинника, ні молекул розчиненої речовини через напівпроникну мембрану; г) проникнення молекул розчиненої речовини та молекул розчинника через напівпроникну мембрану?
16. Найбільш вірогідне значення і в рівнянні π = і с(x) R Т для розчинів електролітів: а) і < 1; б) і = 1; в) і > 1; г) і > 100.
17. Явище гемолізу еритроцитів відбувається в: а) гіпертонічному розчині; б) розчинах електролітів; в)ізотонічному розчині; г) гіпотонічному розчині; д)розчинах неелектролітів? 18. Значення Кк в рівнянні ΔТзам. = Кк b(x) для водних розчинів дорівнює: а) 1
19. Визначення зміни температури замерзання розчину використовується в методі: а) ебуліометрії; б) кріометрії; в) кондуктометрії; г) потенціометрії?
Заняття 8. Теплові ефекти хімічних реакцій в розчинах. Направленість процесів. Мета (знати, вміти): – трактувати хімічні та біохімічні процеси з позиції їх теплових ефектів; – використовувати термодинамічні функції для оцінки спрямованості процесів, пояснювати енергетичне супряження в живих системах; – вміти проводити термохімічні розрахунки і використовувати їх для визначення калорійності харчових продуктів;
Основні поняття теми заняття: термодинамічна система, функція стану, внутрішня енергія, тепловий ефект хімічної реакції, ентальпія, ентропія, самодовільний процес. Література: 1. Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [45-62] 2. Медична хімія: Підр. для вузів/В.О. Калібабчук, Л.І. Грищенко, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: Інтермед, 2006 – 460 с. [56-77]
Теоретичні питання: Предмет хімічної термодинаміки. Основні поняття хімічної термодинаміки: термодинамічна система (ізольована, закрита, відкрита, гомогенна, гетерогенна), параметри стану (екстенсивні, інтенсивні), термодинамічний процес (оборотний, необоротний). Живі організми – відкриті термодинамічні системи. Необоротність процесів життєдіяльності. Перший закон термодинаміки. Ентальпія. Термохімічні рівняння. Стандартні теплоти утворення та згорання. Закон Гесса. Метод калориметрії. Енергетична характеристика біохімічних процесів. Термохімічні розрахунки для оцінки калорійності продуктів харчування та складання раціональних та лікувальних дієт. Самодовільні і несамодовільні процеси. Другий закон термодинаміки. Ентропія. Термодинамічні потенціали: енергія Гіббса, енергія Гельмгольца. Термодинамічні умови рівноваги. Критерії направленості самодовільних процесів. Застосування основних положень термодинаміки до живих організмів. АТФ як джерело енергії для біохімічних реакцій. Макроергічні сполуки. Енергетичні супряження в живих системах: екзергонічні та ендергонічні процеси в організмі.
Тести та вправи до самостійної роботи: 1. Який об’єкт можна розглядати як термодинамічну систему: а) одну молекулу; б) дві молекули; в) один моль речовини; г) усе з вказаного?
2. Термодинамічна система ізольована за умови, якщо: а) обмінюється з навколишнім середовищем тільки енергією; б) не обмінюється з навколишнім середовищем ні енергією, ні речовиною; в) обмінюється з навколишнім середовищем і енергією, і речовиною.
3. Розчин натрій хлориду містить компонентів: а) 1; б) 2; в) 3; г) 4.
4. Суміш, що складається з водного розчину NaCl, кусків льоду, кристалів NaCl, містить фаз: а) 1; б) 2; в) 3; г) 4.
5. Вказати фізичну величину, що не є параметром термодинамічної системи: а) P; б) V; в) Q; г) T.
6. Вказати фізичну величину, що не є функцією стану термодинамічної системи: а) U; б) A; в) H; г) G.
7. Вказати параметр системи, абсолютне значення якого можна виміряти: а) U; б) Т; в) H; г) G.
8. Який параметр системи є екстенсивним: а) Т; б) Р; в) Н?
9. Який параметр системи є інтенсивним: а) Р; б) U; в) V; г) Н; д)F?
10. При якій температурі ентропія чистого кристалічного тіла дорівнює нулю: а) 100С; б) 273,150С; в) 00С; г) –273,150С?
11. Який математичний вираз відповідає І закону термодинаміки для ізохорних процесів: а)
12. Вказати термодинамічну умову ендотермічного процесу: а) ΔH = 0; б) ΔH > 0; в) ΔH < 0.
13. Вказати термодинамічну умову самодовільного протікання процесу в закритій системі при ΔТ=0, ΔР=0: а) ΔG = 0; б) ΔG > 0; в) ΔG < 0.
14. Вказати умову термодинамічної рівноваги в ізольованій системі: а) ΔS > 0; б) ΔS = 0; в) ΔS < 0.
15. Вказати термодинамічну умову самодовільного протікання ізобарно-ізотермічного процесу в закритій системі: а) ΔG = 0; б) ΔF = 0; в) ΔG > 0; г) ΔF < 0; д) ΔG < 0.
16. Стандартна теплота утворення ( а) Дж/моль; б) Дж∙моль; в) Дж/К; г) Дж∙К.
17. Процес є ізохорно-ізотермічний, якщо: а) ΔP = 0, ΔV = 0; б) ΔV = 0, ΔT = 0; в) ΔT = 0, ΔP = 0.
18. Яким рівнянням описується зміна ентропії (ΔS) закритої системи: а) ΔF = ΔU – TΔS; б) ΔG = ΔH – TΔS; в) Q = ΔU + А; г) ΔS = Q/Т?
19. Який математичний вираз відповідає ІІ закону термодинаміки: а) ΔS = Q/Т; б) Qр=ΔH; в) ΔQv= ΔU; г) Q = ΔU + A?
20. Яка із систем стає гетерогенною внаслідок реакції, що відбувається в розчині: а) AgNO3 + HBr →; б) HCl + K2O →; в) NaOH + H2SO4 →?
21. Як змінюється ентропія системи: 2СО (г) а) зменшиться; б) збільшиться; в) залишиться без змін? 22. Чи можливий самодовільний процес при ΔH>0 та TΔS>0: а) можливий при в) можливий за будь - яких умов?
23. Вказати ендергонічний процес в організмі людини: а) гідроліз білків; б) гідроліз полісахаридів; в) синтез білків; г) окиснення вуглеводів?
24. Вказати катаболічний процес в організмі людини: а) гідроліз білків; б) синтез нуклеїнових кислот; в) синтез білків?
25. Вказати самодовільний процес в організмі людини: а) рух крові в судинах; б) активний транспорт іонів; в) пасивний транспорт іонів; г) синтез білків?
ЛАБОРАТОРНА РОБОТА №8
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 1839; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |

 ;
; 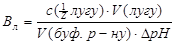 ,
, – об’єм буферного розчину.
– об’єм буферного розчину. =
= =
= ; б) 1,86
; б) 1,86  ;
; 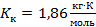 ;
;  ;
;  ;
; 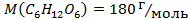 .
.
 в 1000г
в 1000г  , кипить при
, кипить при  . Визначити ізотонічний коефіцієнт гідроксиду натрію в цьому розчині.
. Визначити ізотонічний коефіцієнт гідроксиду натрію в цьому розчині.  .
.
 ;
;  .
.
 ;
; 
 , якщо осмотичний тиск цього розчину при температурі
, якщо осмотичний тиск цього розчину при температурі  дорівнює 618,8кПа,
дорівнює 618,8кПа, 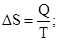 б) Q = ΔH; в) Q = ΔU?
б) Q = ΔH; в) Q = ΔU? ) вимірюється в:
) вимірюється в: С (т)+СО2 (г)
С (т)+СО2 (г) б) можливий при
б) можливий при 



