
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Добуток розчинності, умови утворення осадуСодержание книги
Поиск на нашем сайте
Для насиченого розчину важкорозчинної сполуки AmBn, що здатна до дисоціації добуток рівноважних молярних концентрацій утворених йонів при даній температурі є сталою величиною і має назву добуток розчинності. ДРAmBn= [An+]m ∙ [Bm-]n, де ДРAmBn – добуток розчинності речовини AmBn, що дисоціює за рівнянням AmBn = mAn+ + nBm-; [An+]m та [Bm-]n – рівноважні молярні концентрації утворених йонів у ступенях відповідних стехіометричних коефіцієнтів рівняння хімічної реакції. У тому випадку, коли добуток рівноважних молярних концентрацій (ДК) іонів електроліту перевищує добуток розчинності ДКAmBn > ДРAmBn, утвориться осад.
Завдання: - У дві пробірки внести по 1мл розчину Pb(NO3)2 з молярною концентрацією 1,0∙10-3 моль/л. - У першу пробірку додати 1мл розчину KCl з молярною концентрацією 5,0∙10-2 моль/л. - У другу пробірку додати 1мл розчину KI з молярною концентрацією 5,0∙10-2моль/л. - Занести результати спостережень до таблиці. Розрахувати ДК для відповідних продуктів. Зробити висновок про перебіг хімічних процесів, навести рівняння реакцій.
Таблиця
Рівноважні молярні концентрації йонів розраховують виходячи з формули: с(Х)·V(X) = с0(Х)·V0(X). с(Pb2+) = = моль/л
с(Cl‾) = = моль/л
с(I‾) = = моль/л
ДK(PbCl2)= [Pb2+] [Cl-]2 = = моль3/л3
ДK(PbI2)= [Pb2+] [I-]2 = = моль3/л3
____________________________________________________________________________________________________________________________________________________________________________________________________________ Заняття 11. Визначення окисно-відновного потенціалу.
Мета (знати, вміти): – пояснювати механізм утворення електродних потенціалів; – аналізувати принципи методу потенціометрії і робити висновки щодо його використання в медико-біологічних дослідженнях; – вимірювати окисно-відновні потенціали та прогнозувати спрямованість окисно-відновних процесів;
Основні поняття теми заняття: провідник, електрод, електродний потенціал, електродні процеси, гальванічний елемент, електрорушійна сила. Література: 1. Медична хімія: Підр. для ВНЗ/В.О. Калібабчук, І.С Чекман, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: ВСВ Медицина, 2013 – 390 с. [154-177] 2. Медична хімія: Підр. для вузів/В.О. Калібабчук, Л.І. Грищенко, В.І. Галинська та інш.; Під ред. В.О. Калібабчук.- К.: Інтермед, 2006 – 460 с. [185-205]
|
Теоретичні питання:
Роль електрохімічних явищ в біологічних процесах.
Електродні потенціали та механізм їх виникнення. Рівняння Нернста. Нормальний (стандартний) електродний потенціал. Нормальний водневий електрод. Вимірювання електродних потенціалів. Електроди визначення та електроди порівняння. Хлорсрібний електрод. Іонселективні електроди. Скляний електрод.
Гальванічні елементи.
Дифузійний потенціал. Мембранний потенціал. Біологічна роль дифузійних та мембранних потенціалів. Потенціал пошкодження. Потенціал спокою. Потенціал дії.
Роль окисно-відновних реакцій в процесах життєдіяльності. Окисно-відновний потенціал як міра окисної та відновної здатності систем. Рівняння Петерса. Нормальний окисно-відновний потенціал.
Прогнозування напрямку окисно-відновних реакцій за величинами окисно-відновних потенціалів. Еквівалент окисника та відновника. Значення окисно-відновних потенціалів у механізмі процесів біологічного окиснення.
Потенціометрія. Потенціометричне визначення рН, активності іонів. Потенціометричне титрування.
Тести та вправи до самостійної роботи:
1. Провідником І роду є:
а) залізо; б) сірка; в) фосфор; г) розчин солі; д) розчин Н2О2.
2. Провідником ІІ роду є:
а) розчин солі; б) мідь; в) графіт; г) сірка; д) йод.
3. В яких одиницях вимірюється електродний потенціал:
а) В/м; б) В; в) Кл∙В; г) Дж; д) Кл?
4. Чому дорівнює потенціал хлорсрібного електрода як електрода порівняння при 298К:
а) 0,222В; б) 0,240В;
в) 0,201В; г) 0,0201В?
5. Який знак заряду виникає на цинковому електроді при зануренні його в розчин ZnSO4:
а) “+”; б) “-“; в) 0?
6. Яку пару електродів необхідно застосувати для визначення окисно-відновних потенціалів:
а) водневий та скляний; б) хлорсрібний та платиновий;
в) цинковий та мідний; г) золотий та скляний?
7. У розчин якої солі треба занурити цинкову пластину, щоб одержати цинковий електрод:
а) K2SO4; б) CuCl2; в)CuSO4; г)ZnSO4; д) Al(NO3)3?
8. Який метал треба занурити в розчин FeSO4, щоб звільнити цей розчин від домішків катіонів купруму (ІІ):
а) Fe; б) Ag; в) Au; г) Pt?
9. Чому дорівнює вираз  , при розрахунках за рівняннями Нернста і Петерса, якщо Т = 298К:
, при розрахунках за рівняннями Нернста і Петерса, якщо Т = 298К:
а) 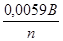 ; б)
; б)  ;
;
в)  ; г)
; г) 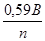 ?
?
10. Чому дорівнює універсальна газова стала (R) у рівняннях Нернста і Петерса при розрахунках:
а) 8,31∙ 103 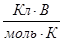 ; б) 8,31
; б) 8,31 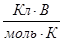 ;
;
в) 8,31  ; г) 8,31
; г) 8,31 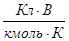 ?
?
11. У гальванічному елементі при його замиканні відбувається:
а) окисно-відновна реакція; б) реакція приєднання;
в) реакція розпаду; г) реакція іонного обміну.
12. Які електроди треба взяти для визначення молярної концентрації оцтової кислоти в розчині:
а) скляний та платиновий; б) мідний та цинковий;
в) хлорсрібний та скляний; г) платиновий та хлорсрібний?
13. Як змінюється потенціал Гіббса в гальванічних процесах:
а) ΔG>0; б) ΔG=0; в) ΔG<0?
14. Який із наведених електродів використовують як електрод порівняння:
а) скляний; б) цинковий; в) мідний; г) платиновий; д) хлорсрібний?
15. Як зміниться маса цинкової пластинки, зануреної в розчин CuSO4:
а) зменшиться; б) збільшиться; в) не зміниться?
16. Яка система має найбільшу окисну здатність:
а) E  = - 0,201В; б)E
= - 0,201В; б)E  =0,201В;
=0,201В;
в) E  =0,340В; г) E
=0,340В; г) E  =1,500В?
=1,500В?
17. При якій із наведених температур потенціал мідного електроду буде мати найбільше значення:
а) Т=273К; б) Т=283К;
в) Т=298К; г) Т=340К?
18. Написати рівняння Нернста для цинкового електрода (Zn/Zn2+).
19. Написати рівняння Петерса для електрода Pt/Fe3+, Fe2+.
20. Яка активність катіонів купруму (ІІ) в розчині, якщо потенціал мідного електроду дорівнює його стандартному значенню:
а) 0,1моль/л; б) 1моль/л; в) 2моль/л; г)0,2моль/л; д)10моль/л?
21. Який з гальванічних елементів є концентраційним:
а) Cu/c1(CuNO3)2//c2(AgNO3)/Ag; б) Cu/c1(CuSO4)//c2(CuSO4)/Cu;
в) Zn/ZnSO4//CuSO4/Cu; г) Zn/ZnSO4//KCl, AgCl/Ag?
22. Чому дорівнює окисно-відновний потенціал системи Fe3+/Fe2+,якщо співвідношення активностей цих іонів у розчині дорівнює 1 при температурі 298К:
а) EFe  /Fe
/Fe  =E0Fe
=E0Fe  /Fe
/Fe  -0,059B; б) EFe
-0,059B; б) EFe  /Fe
/Fe  =E0Fe
=E0Fe  /Fe
/Fe  + 1B?
+ 1B?
в) EFe  /Fe
/Fe  =E0Fe
=E0Fe  /Fe
/Fe  -1B; г) EFe
-1B; г) EFe  /Fe
/Fe  =E0Fe
=E0Fe  /Fe
/Fe  + 0,059B
+ 0,059B
д) EFe  /Fe
/Fe  =E0Fe
=E0Fe  /Fe
/Fe  ?
?
| 23.Розрахувати ЕРС гальванічного елементу при 298К, складеного з двох срібних електродів з с 1(Ag+)=10-3моль/л і с 2(Ag+)=10-1моль/л. |
24.Розрахувати ЕРС гальванічного елементу при 298К, складеного з двох водневих електродів з  і і  . .
|
25. Розрахувати ЕРС гальванічного елементу при 298К складеного з срібного електрода з с (Ag+) = 10-3моль/л і цинкового електрода з с (Zn2+) = 10-2моль/л. 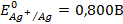 , ,  . .
|
ЛАБОРАТОРНА РОБОТА №11
|
| Поделиться: |




