
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакції катіонів ІІІ аналітичної групиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Груповий реактив (NH4)2S. Сульфід амонію (у слабколужному середовищі, яке створюється амонійною буферною сумішшю (NH4Cl + NH4OH) осаджує катіони третьої аналітичної групи у вигляді чорних осадів сульфідів, тільки Mn2+ дає сульфід жовто-рожевого (тілесного) кольору: Fe2+ + S2– = FeS ¯ – чорний 2Fe3+ + 3S2– = Fe2S3 ¯ – чорний Со2+ + S2– = СоS ¯ – чорний Mn2+ + S2– = MnS ¯ – жовто-рожевий Ni2+ + S2– = NiS ¯ – чорний Виконання: у п‘ять пробірок взяти по 2–3 краплі солей феруму (ІІ) та феруму (ІІІ), кобальту, мангану(ІІ) та нікелю, додати у кожну 3 – 4 краплі NH4Cl і 2 – 3 краплі NH4OH, перемішати і спостерігати утворення проміжних продуктів: основних солей, гідроксидів, комплексних сполук з амоніаком. Додати у кожну пробірку 2 – 3 краплі розчину (NH4)2S, перемішати. Спостерігати утворення чорних осадів у всіх пробірках, крім однієї, де утворюється світлий осад. За допомогою цієї реакції можна відкрити або відділити катіони третьої групи від катіонів першої та другої аналітичних груп. Катіони четвертої та п’ятої аналітичних груп також осаджуються у вигляді темнозабарвлених сульфідів і заважають цій реакції. Тому при аналізі невідомого розчину треба спочатку впевнитися, що в ньому відсутні катіони четвертої та п’ятої груп за допомогою НСl і сірководню, а вже потім відкривати третю аналітичну групу сульфідом амонію. Груповий реактив дає можлівость встановити, що у розчині є один або кілька катіонів третьої групи, а вже який саме – відкривають, виконуючи з окремими порціями невідомого розчину індивідуальні реакції катіонів третьої аналітичної групи у певній послідовності, яка наведена нижче. Катіони феруму (ІІ) – Fe2+ 1. Гексаціаноферат (ІІІ) калію K3[Fe(CN)6] у присутності розведеної НСl утворює з Fe2+ темно – синій осад, склад якого залежить від умов проведення реакції: 3Fe2+ + 2[Fe(CN)6]3– ® Fe3[Fe(CN)6]2 Виконання: у чисту пробірку взяти 1 – 2 краплі розведеної НСl, 2 – 3 краплі розчину солі феруму (ІІ) і додати 2 – 3 краплі K3[Fe(CN)6] (не торкатися піпеткою стінок пробірки!). Спостерігати утворення темно-синього осаду. КатіониFe3+ з цим реативом осаду не дають, але розчин набуває бурого забарвлення. Катіони Cо2+, Mn2+, Ni2+ утворюють осади бурого, червоного і жовто–бурого кольору, але вони не заважають реакції, тільки темно–синій осад Fe3[Fe(CN)6]2 стає темно–зеленим або синьо– чорним. Катіони феруму (ІІІ) – Fe3+ 1. Гексаціаноферат (ІІ) калію К4[Fe(CN)6] у присутності розведеної НСl дає з іонами Fe3+ темно – синій осад: 4Fe3+ + 3[Fe(CN)6]4– ® Fe 4[Fe(CN)6]3¯, склад якого залежить від умов проведення реакції. Виконання: у чисту пробірку взяти 1 – 2 краплі розведеної НСl, 2 – 3 краплі розчину солі феруму (ІІІ) і додати 2 – 3 краплі K4[Fe(CN)6] (не торкатися піпеткою стінок пробірки!). Спостерігати утворення темно-синього осаду. Катіони Cо2+, Mn2+, Ni 2+ дають з реактивом білий, зелений та світло – зелений осади, які не заважають спостерігати утворення темно – синього осаду. Якщо у невідомому розчині присутні катіони Fe2+, то вони дають з реактивом білий осад. Але внаслідок окиснення Fe2+ киснем повітря до Fe3+ у розчині, де є Fe2+ завжди буде невелика кількість Fe3+. Тому утворюється світло – синя суміш білого осаду Fe2[Fe(CN)6] з невеликою кількістю темно – синього Fe4[Fe(CN)6]3. 2. Роданід амонію NH4SCN (тіоціанат амонію) у кислому середовищі утворює з катіонами Fe3+ розчинну комплексну сполуку криваво – червоного кольору: Fe3+ + nSCN– «[ Fe(SCN)n]3–n, де n – від 1 до 6 Можлива зворотня реакція, тому треба додавати надлишок реактиву. Виконання: у чисту пробірку взяти 1 – 2 краплі розчину солі феруму (ІІІ) (Fe(NO3)3 або FeCl3), додати краплю розведеної HNO3 і 4 – 5 крапель NH4SCN. Спостерігати утворення криваво – червоної сполуки. Додати дистильованої води (до половини пробірки) і упевнитися, що утворюється не осад, а саме розчинна сполука червоного кольору. Аніони роданіду витісняють молекули води з внутрішньої координаційної сфери катіонів феруму (ІІІ) [Fe(H2O)6]3+ + 6SCN– «[ Fe(SCN)6]3– + 6H2O Але аніони, які мають більшу спорідненість до феруму (ІІІ), можуть витіснити роданід: [Fe(SCN)6]3– + 6F– «[Fe F6]3– + 6SCN– При додаванні фториду натрію або фториду амонію червоний розчин знебарвлюється, ферум зв‘язується у безбарвний фторидний комплекс. Ця реація використовується для маскування феруму (ІІІ) при відкритті Со2+ за допомогою роданіду. Катіони кобальту – Со2+ 1. Роданід амонію NH4SCN (тіоціанат амонію) утворює з іонами кобальту комплексну сполуку синього кольору: [Co(H2O)6]2+ + 4SCN– «[Co(SCN)4]2– + 6H2O у водному розчині катіони кобальту оточені шістьма молекулами води і мають рожевий колір, якщо ж навколо кобальту координуються чотири ліганди, такий комплекс набуває синього забарвлення. Роданід кобальту нестійкий і при розведенні розчину водою синє забаравлення зникає. Томутреба брати великий надлишок роданіду і екстрагувати продукт реації неводним розчинником (аміловим спиртом), у якому немає конкуренції з боку молекул води. Екстракція стабілізує продукт реакції і підвищує її чутливість. Виконання: у чисту пробірку взяти 2–3 краплі розчину солі кобальту (ІІ), і додати 4–5 крапель насиченого розчину NH4SCN. Спостерігати поступову зміну рожевого забарвлення розчину на синє. Додати 5-6 крапель ізоамілового спирту, закрити пробірку і добре перемішати. При відстоюванні і розшаруванні спостерігати інтесивно синє забарвлення верхнього неводного шару. Катіони феруму (ІІІ) утворюють з роданідом більш стійкий комплекс криваво-червоного кольору і заважають реакції на іон Со2+. При додаванні фториду натрію або амонію червоне забарвлення зникає, а синє залишається і його можна спостерігати. Ферум (ІІІ) залишається у розчин, але воно оточене фторидом – замасковане – і не взаємодіє з роданідом (див. попередню реакцію). Таким чином, якщо у невідомому розчині, де вже відкритий ферум (ІІІ), потрібно відкрити кобальт (ІІ), реакцію проводять так: у чисту пробірку взяти 2–3 краплі задачі, додати 10 крапель NH4SCN. 5-6 крапель амілового спирту і невелику кількість NaF або NH4F. Збовтувати, поки червоне забарвлення зникне, як у нижньому водному, так і у верхньому неводному шарі. Якщо є Со2+, верхній шар амілового спирту забарвлюється у синій або синьо-зеленій колір. Катіони мангану – Mn2+ 1. Сильні окисники (вісмутат натрію, діоксид плюмбуму, персульфат амонію) у сильнокислому середовищі окиснюють Mn2+ до MnO4– і розчин набуває червоно-фіолетового (малинового) забаравлення 2Mn2+ + 5NaBiO3 + 14H+ ® 2MnO4– +5Bi3+ + 5Na+ + 7H2O 2Mn2+ + 5PbO2 + 4H+ ® 2MnO4– +5Рb2+ + 2H2O 2Mn2+ + 5S2O82– + 8H2O ® 2MnO4– +10SO42– + 16H+ Надлишок Mn2+ заважає реакції, тому що він відновлює MnO4– до MnO2. Треба виконувати реацію так, щоб надлишку Mn2+ не було. Виконання: у чисту пробірку взяти не більше однієї краплі розчину солі маргацю (ІІ) додати 3 – 4 краплі 6н. HNО3, перемішати і вилити. Те, що залишилось на стінках пробірки, змити у пробірку 6н. розчином HNО3 (не торкатися піпеткою стінок пробірки!). Додати невелику кількість коричневого порошку NaBiO3, перемішати і почекати, поки надлишок NaBiO3 осяде на дно. Розчин повинен набути червоно-фіолетового або малинового забарвлення. Якщо малинове забарвлення швидко зникає, а у розчині і на стінках з”являється коричнева муть, це означає, що концентрація Mn2+ усе ще занадто велика.Інші катіони не заважають цій реакції. У лабораторії виконується тільки реакція з вісмутатом натрію. Вивчення реакцій з персульфатом амонію і діоксидом свинцю треба залишити як домашнє завдання для роботи з підручником. Які переваги має реакція з вісмутатом натрію? Катіони нікелю – Ni2+ 1. Диметилгліоксим (диметилдіоксим) у присутності амоніаку утворює з Ni2+ нерозчинну сполуку червоного (темно-рожевого) кольору.
O – H … O ½
CH3 – C = N – OH CH3 – C = N N = C – CН3 ¯ ½ O … H – O Катіон нікелю взаємодіє з двома молекулами диметилгліоксиму і витісняє з кожної по одному іону водню, які потрібно зв‘язати амоніаком (амоніак додається під-час приготування розчину диметилгліоксиму), оскільки сильнокисле середовище заважає реакції. Утворюється міцна внутрішньокомплексна сполука (хелат), де іон нікелю оточений симетричним угрупуванням з атомів чотирьох оксимних груп. Реакції заважають Fe3+ і Fe2+. Іон Fe3+ у слаболужному (амоніачному) середовищі утворює бурий осад Fe(ОН)3. Іон Fe2+ утворює з диметилгліоксимом сполуку брудно-червоного кольору. При поступовому окисненні Fe2+ до Fe3+ (киснем повітря) червоне забарвлення зникає, залишається буро-коричневе. Тому реакцію виконують на фільтрувальному папері у присутності фосфату, який зв‘язує ферум (ІІІ). Виконання: не капати, а тільки доторкнутися піпеткою з розчином Na2HPO4 до центру фільтрувального паперу і почекати, поки навколо піпетки утвориться кругла пляма. До центру цієї плями доторкнутися піпеткою з розчином, який може містити іони Ni2+ і почекати, поки попередня пляма почне збільшуватись. За межами цієї плями до сухого паперу доторкнутися піпеткою з розчином диметилгліоксиму і почекати, поки пляма розчину диметилгліоксиму, що буде утворюватись навколо піпетки, перетнеться з плямою невідомого розчину, де і повинен утворитися осад характерного кольору. При такому виконанні реакції Fe3+ затримується фосфатом, що знаходиться у центрі плями, а Ni2+ та інші двовалентні іони виходять на периферію плями. Якщо у невідомому розчині є іон Ni2+, то на периферії плями з‘являється червоне (темно-рожеве) забарвлення. Якщо присутній також іон Fe2+, то забарвлення буде брудно-червоним. Тоді треба почекати, поки пляма висохне. Червоне забарвлення, яке диметил-гліоксим утворює з іоном Fe2+, зникає (стає світло – коричневим), забарв лення з іоном Ni2+ залишається.
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 412; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.255.122 (0.007 с.) |

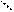
 CH3 – C = N – OH CH3 – C = N N = C – CН3
CH3 – C = N – OH CH3 – C = N N = C – CН3

 2 ½ + Ni2+ +2NH3 ® 2NH4+ + ½ Ni ½
2 ½ + Ni2+ +2NH3 ® 2NH4+ + ½ Ni ½


