
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічний склад поперечно-смугастих мязів.Содержание книги
Поиск на нашем сайте Біохімічний склад м'язів Скелетні м'язи ссавців містять у своєму складі: 72-80 % води; 16-20 % білків; 0,9-2,2 % небілкових азо-і А! тистих сполук (креатин, креатинфосфат, АТФ, АДФ, амінокислоти тощо); безазотисті органічні сполуки (глікоген - 0,3- 3,0 %; фосфоліпіди - 0,4— 1,0%; холестерин - 0,06- 0,2 %); мінеральні елементи (К+, Са2+, Na+ тощо). Білки м'язів Білки скелетних м'язів складаються з водонероз- чинних білків міофібрил (які становлять 75-80 % загального вмісту білків м'язів) і водорозчинних білків саркоплазми - так званого "міогену" До складу фракції міогену входять переважно ферменти, що каталізують ката- болічні реакції, які забезпечують біоенергетику м'язового скорочення - глікогенфос- форилаза, ферменти гліколізу, креатинфосфокіназа, аденілаткіназа, кисеньдепо- нуючий білок міоглобін. У саркосомах містяться ферменти циклу трикарбонових кислот, біологічного окислення й окисного фосфоритування. Білки міофібрил До складу міофібрил входять такі білки: 1) до складу товстих ниток - білок міозин; 2) до складу тонких ниток - білки актин, тропоміозин, тропоніновий комплекс {тропонін Т, тропонін І, тропонін Q; 3) білок a-актинін - компонент Z-лінії саркомерів; з цим білком сполучені кінці F-актинових молекул тонких філаментів. Міозин - фібрилярний білок, що утворює товсті філаменти міофібрил. Молекула міозину асиметрична, складається з двох важких поліпептидних ланцюгів, що мають конформацію ос-спіралі й закручені один відносно одного; довжина молекули - 160 нм. N-кінці важких ланцюгів утворюють глобулярні "головки", які нековалентни- ми зв'язками сполучені з додатковими чотирма легкими поліпептидними ланцюгами. В умовах триптичного гідролізу міозин розщеплюється на два фрагменти - меро- міозини: легкий мероміозин — LMM {light meromyosin - англ.) та важкий мероміозин - НММ {heavy meromyosin — англ.). Подальший гідроліз НММ папаїном спричиняє утворення двох ідентичних глобулярних субфрагментів S1 (головок міо зину) і паличкоподібного субфрагмента S2 (рис. 33.3). До складу головок S1 входять каталітичні центри з АТФ-азною активністю і центри для зв'язування з актином (при відсутності АТФ). Фібрилярні "хвости" молекул міозину контактують між собою в поздовжньому напрямку, утворюючи товсті філаменти саркомерів, до складу кожного з яких входять близько 400 молекул міозину. Глобулярні головки виступають із зовнішньої поверхні філамента (рис. 33.4). Актин - білок, що існує у двох формах: G- та F-актин. G-актин - глобулярний білок, що має вигляд кулястих молекул діаметром близько 5 нм. Молекули G-актину (субоди- ниці) нековалентно сполучаються між собою, утворюючи намистоподібні утворення -ланцюги фібрилярного F-актину. У м'язових клітинах F-актин представлений фібрилярними структурами, що складаються з двох ланцюгів, переплетених один навколо одного (рис. 33.5). F-актин складає основу будови тонких ниток саркомерів. У складі тонких ниток ланцюги F-актину сполучені з тропоміози- ном і тропонінами. Тропоміозин - білкові молекули витягнутої форми, що складаються з двох поліпептидних ланцюгів (а та 0), які утворю ють подвійну спіраль. Паличкоподібні молекули тропоміозину (довжиною 40 нм і товщиною 2 нм) розміщуються в борозенках між двома ланцюгами F-актину таким чином, що кожна молекула тропоміозину контактує із сімома молекулами (субоди- ницями) G-актину. Тропонін - білок тонких філаментів, що складається з трьох субодиниць: ТпТ, ТпІ, ТпС. Тропонінові комплекси мають глобулярну форму і розміщуються впродовж ак- тинового філамента з інтервалами в 38,5 нм, контактуючи з кінцями молекул тропоміозину (рис. 33.6). Найбільш вивченим компонентом тропонінового комплексу є ТпС - кальційзв 'язуючий білок, близький за структурою і властивостями до кальмодуліну - універсального трансдуктора кальцієвих сигналів у біохімічних системах. Білок ТпІ взаємодіє з актином, ТпТ - забезпечує взаємодію тропонінового комплексу з тропоміозином. Експресія генів на рівні транскрипції. ??? Білет 15 Гормони підшлункової. Цукровий діабет. Підшлункова залоза - орган мішаної секреції, ацинарна частина якої виконує екзокринну функцію, секретуючи у дванадцятипалу кишку травні ферменти та іони, а ендокринна {острівці Лангерганса) - продукує декілька гормональних факторів пептидної природи. Синтез та секреція пептидних гормонів забезпечують різні типи клітин острівкого апарату: А (а)-клітини - глюкагон; В (Р)-клітини - інсулін; D (б)-клітини - соматостатин; F-клітини - панкреатичний поліпептид. 1. Інсулін - поліпептидний гормон (м.м. 5,7 кДа), молекула якого складається з двох ланцюгів - А та В, що мають відповідно 21 і ЗО амінокислотних залишків. Пептидні ланцюги сполучені між собою дисульфідними зв'язками. Інсулін синтезується в рибосомах В- ((3-) клітин підшлункової залози у вигляді препрогормону - білка з м.м. 11,5 кДа, який у результаті обмеженого протеолізу послідовно перетворюється в ендоплазматичному ретикулумі та апараті Гольджі на прогормон (м.м. 9 кДа) та зрілий інсулін. Молекули інсуліну спаковуються в секреторні гранули, де вони утворюють комплекси з іонами цинку. Секреція інсуліну з клітини відбувається шляхом еміоцитозу, який полягає в міграції гранул до плазматичної мембрани, їх злитті з мембраною, розчиненні мембрани та "екструзії" - викиду вмісту гранули в екстрацелюлярний простір - рис. 24.3. Секреція інсуліну є енергозалежним процесом, головним фізіологічним стимулом секреції є збільшення концентрації глюкози в крові понад рівень фізіологічної норми (3,3 - 5,5 ммоль/л). Характеристика гормональної активності Інсулін позначають як "гормон засвоєння та депонування вуглеводів" стимуляція транспорту глюкози з екстрацелюлярного простору через плазматичні мембрани всередину клітин - ефект спостерігається здебільшого в клітинах м'язів, адипоцитах жирової тканини, лімфоцитах і є основною причиною швидкого (протягом декількох секунд) зниження рівня глюкоземіїпісля ін'єкції інсуліну. сприяння утилізації глюкози в м'язах, печінці, жировій тканині тощо шляхами гліколізу, пентозофосфатного шляху (ПФШ) та синтезу глікогену: Вплив на обмін ліпідів. Характеризується стимуляцією анаболічних шляхів ліпідного обміну і збільшеним внутріклітинним депонуванням тригліцеридів, що проявляється переважно в жировій тканині та в печінці. активацією синтезу вищих жирних кислот за рахунок збільшення притоку відповідних субстратів: ацетил-КоА та НАДФН, що утворюються при метаболізмі глюкози (див. вище); (2.2) активацією синтезу триацилглщеролів із жирних кислот та гліцерол-3-фосфату, який також постачається у збільшеній кількості при гліколітичному розщепленні глюкози (утворюється з діоксіацетонфосфату в гліцерол-3-фосфатдегідрогеназній реакції); (2.3) гальмуванням ліполізу в адипоцитах, що зумовлено зменшенням концентрації цАМФ, необхідного для активації ТГ-ліпази, та протидією ліполітичному впливу катехоламінів та глюкагону. Згідно із зазначеним, цукровий діабет характеризується активацією ТГ-ліпази жирової тканини із збільшеним надходженням НЕЖК у плазму крові, стимуляцією їх перетворення в кетонові тіла (кетогенезом) та виникненням при некомпенсованій течії захворювання кетоацидозу. Крім того, оскільки інсулін зменшує утворення в печінці основних транспортерів триацилглщеролів та холестерину - ЛПДНЩ та ЛПНЩ - "атерогенних ліпопротеїнів", цукровий діабет II типу (розділ 16) характеризується додатковим розвитком атеросклерозу та ожиріння. (3) Вплив на обмін амінокислот та білків. Дія інсуліну на амінокислотний та білковий обмін найбільш виражена у м'язах, печінці, нирках, сполучній тканині, має анаболічний характер Інсулін має виражені ростостимулюючі ефекти, що пов'язані як із стимуляцією надходження в клітини енергетичних та пластичних субстратів для росту (глюкози, жирних кислот, амінокислот), так і з безпосереднім активуючим впливом на біосинтез (реплікацію) ДНК, прискоренням переходу клітин у S-фазу. Травлення в шлунку. Перетравлювання білків у порожнині шлунка Шлунковий сік, під дією якого відбувається гідроліз білків, - це кисла рідина з рН 1,5-2,5. Основними біохімічними компонентами шлункового соку, що беруть участь у перетворенні білків продуктів харчування, є соляна кислота та протеолітичний фермент пепсин. Крім того, до складу шлункового соку входять кислі фосфати (переважно NaH2P04) та деякі органічні кислоти, складаючи загальну кислотність шлунка. Соляна кислота виробляється у спеціальних обкладкових (рксинтних) клітинах слизової оболонки шлунка за участю хлоридів, які надходять із крові. Донором протонів, необхідних для утворення НС1, є вугільна кислота, що утворюється з Н20 та С02 за участю карбоангідрази: Секреція іонів Н+в порожнину шлунка відбувається при дії протонної помпи мембран оксинтних клітин - Н+, К+-АТФази (рис. 26.2). Концентрація НС1 у шлунковому соку складає 0,45-0,60 %. Соляна кислота необхідна для утворення активного ферменту пепсину і прояву максимуму його каталітичної активності. Пепсин - протеаза з м.м. 35 кДа, що синтезується головними клітинами слизової оболонки шлунка у вигляді проферменту пепсиногену (м.м. 42 кДа). Початкові етапи перетворення пепсиногену в пепсин здійснюються за участю іонів Н+, які сприяють відщепленню від молекули проферменту N-кінцевого захисного пептиду, що супроводжується розкриттям активного центру; в подальшому процес стає авто-каталітичним - молекули пепсину спричиняють власне утворення з проферменту: За механізмом дії пепсин є ендопептидазою, що специфічно атакує пептидні зв'язки, в утворенні яких беруть участь залишки ароматичних (фенілаланіну, тирозину), а також дикарбонових (глутамату, аспартату) амінокислот. Під дією пепсину білки розщеплюються на великі поліпептидні фрагменти - пептони, гідроліз яких завершується в тонкій кишці. Рєпнін {хімозин, сичужний фермент) — протеаза, що міститься в шлунковому соку новонароджених дітей. Реннін є ферментом, який за участю іонів Са2+ спричиняє перетворення розчинних білків молока (казеїнів) у нерозчинні (параказеїни), які підлягають протеолітичній дії пепсину ("звурдження молока"). Білет 16. Ліпіди ЦНС Ліпіди нервової тканини Своєрідність хімічного складу нервової тканини і головного мозку полягає у надзвичайно високому вмісті ліпідів різноманітної хімічної структури. Сума ліпідів різних класів складає в середньому близько половини сухої маси тканини головного мозку. Особливостями хімічного складу ліпідів головного мозку є переважання складних полярних ліпідів (гліцерофосфоліпідів, сфінголіпідів, гліколіпідів) і холестерину при незначній кількості триацилгліцеролів. До того ж вміст ліпідів у білій речовині головного мозку значно вищий, ніж у сірій речовині, що пояснюється наявністю в останній структурі значної кількості мієлінових оболонок нервів Антибіотики
(1) інгібітори ініціації: стрептоміцин, ауринтрикарбоксилова кислота; (2) інгібітори елонгації: аміцетин, хлорамфенікол, еритроміцин, циклогекси- мід, пуроміцин, тетрацикліни; (3) інгібітори термінації: анізоміцин, хлорамфенікол, еритроміцин, лінкоцин, стрептоміцин. Антибіотики, що є інгібіторами процесів трансляції у прокаріотів, застосовуються як антибактеріальні лікарські засоби в терапії інфекційних хвороб та інших захворювань, що спричинені мікробним фактором. Антибіотики, які інгібують трансляцію в еукаріотичних клітинах вищих організмів, зокрема ссавців, застосовуються як протипухлинні засоби. Гальмуючи біосинтез білка в клітинах злоякісних пухлин, ці антибіотики спричиняють регресію росту пухлини. Сполучна тканина Сполучна тканина - це комплекс спеціалізованих клітин, волокон та основної речовини, що утворює внутрішнє середовище та інтегрує між собою інші клітини і тканинні елементи в єдиний багатоклітинний організм людини і тварин. Головними фізіологічними функціями сполучної тканини є: - опорна (механічна) функція; - захисна функція; - трофічна та транспортна функція; - регуляторна функція. Залежно від особливостей структурної організації та функцій, виділяють декілька типів сполучної тканини, а саме: - волокнисті сполучні тканини, які у свою чергу підрозділяють на пухку волокнисту сполучну тканину та компактну (щільну) волокнисту сполучну тканину; - скелетні сполучні тканини (суглобові та кісткові); - сполучні тканини із спеціальними властивостями. Волокнисті сполучні тканини є типовими представниками групи сполучних тканин, що їх називають також "власне сполучними тканинами".У свою чергу, найбільш поширеним видом волокнистих сполучних тканин є пухка волокниста сполучна тканина, яка має найбільш характерну для всіх типів сполучних тканин будову. Структурними компонентами сполучних тканин (волокнистих сполучних тканин) є: 1) клітини, що виконують різноманітні захисні, трофічні, регуляторні функції. До них належать: фібробласти з різним ступенем диференціювання, макрофаги (гістіоци- ти), опасисті клітини (тканинні базофіли), плазматичні клітини, різні типи лейкоцитів. 2) волокна - структурні утворення білкової природи, що формують міжклітинну сітку в сполучній тканині. Вони підрозділяються на: - колагенові волокна; -ретикулярні волокна; - еластичні волокна. 3) основна аморфна речовина, що заповнює проміжки між волокнистими компонентами та клітинами. За хімічною природою основна аморфна речовина являє собою складні білки та глікокон'югати - протеоглікани та структурні глікопротеїни. Волокна та основна аморфна речовина складають у сукупності міжклітинну речовину волокнистої сполучної тканини. Пухка волокниста сполучна тканина відрізняється від і^ідьноі'відносно більшим об'ємом основної аморфної речовини, меншою кількістю волокон та різноманітнішим клітинним складом
|
||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 287; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.013 с.) |

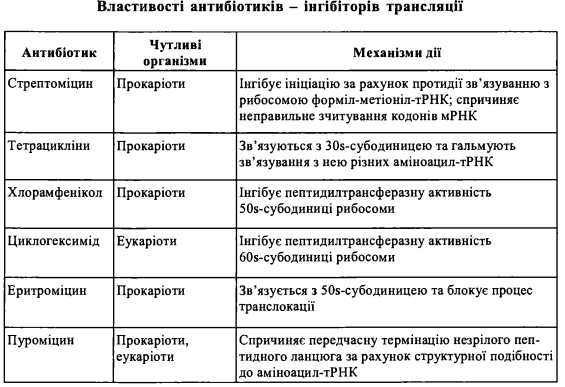 1. У клінічній практиці, а також в експериментальній біології і медицині, знайшли широке застосування антибіотики, що є інгібіторами біосинтезу білка у прока- ріотичних та еукаріотичних організмів на різних етапах трансляції:
1. У клінічній практиці, а також в експериментальній біології і медицині, знайшли широке застосування антибіотики, що є інгібіторами біосинтезу білка у прока- ріотичних та еукаріотичних організмів на різних етапах трансляції:


