
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Панкреатичне і кишкове травлення. Роль жовчі в механізмі травленняСодержание книги
Поиск на нашем сайте Білет 1 Функції печінки 100% синтез альбумінів, 98% синтез альфа-2-глобулінів, фактори згортання крові, перетворення феніл-аланіну, цикл Корі (молочна кислота – глюкоза), глюконеогенез, клюкокіназа (забирає з крові альфа-Д-глюкозу), синтез глікогену, перетворення фруктози і галактози на глюкозу, активація вітаміну Д, дезамінування (аспартат- і аланін-амінотрансферази), синтез сечовини і креатину, розподіл глюкози, формування ліпідів низької щільності (холестерол в клітину), синтез фосфоліпідів, жовчних кислот, вуглеводний і ліпідний обмін, дає глюкозу для живлення головного мозку, пентозофосфатний шлях=НАДФН2, мікросомальне окислення ксенобіотиків, виводить ксенобіотики, запас вітамінів (крім С) Панкреатичне і кишкове травлення. Роль жовчі в механізмі травлення Перетравлення поживних речовин (білків, вуглеводів, ліпідів) — це процес гідролізу відповідних сполук у складі продуктів харчування, що відбувається в травному каналі і призводить до утворення простих біомолекул, які за рахунок дії спеціальних механізмів мембранного транспорту всмоктуються у кров. кишечник (залози Брунерата Ліберкюна) синтезує деякі пептидази, дисахаридази, фосфоліпази та полінуклеотидази. Травлення в кишечнику неможливе без участі гідролітичних ферментів, які надходять сюди з підшлункової залози — протеаз (трипсину, хімотрипсину, еластази), карбоксипептидази, амілаз, ліпаз. У процесі травлення жирів беруть участь біохімічні компоненти жовчі, що синтезуються в гепатоцитах печінки. Перетравлення білків протеолітичні ферменти та пептидази, які діють на пептиди, що надходять зі шлунка. Каталітична дія цих ферментів відбувається в слабколужному середовищі (рН 7,5-8,0) Більшість ферментів протеолітичної дії, що функціонують у тонкій кишці, синтезуються в екзокринних клітинах підшлункової залози у вигляді проферментів, які активуються після їх надходження в дванадцятипалу кишку (трипсиноген, хімотрипсиноген, проеластаза, прокарбоксипептидази А і В). Гідроліз білків та пептидів, що надходять із шлунка, відбувається як у порожнині тонкої кишки, так і на поверхні ентероцитів — пристінкове, або мембранне травлення. розщеплення білків та пептидів продуктів харчування до амінокислот. У кровотік слизовою оболонкою кишечника всмоктуються тільки вільні амінокислоти. Перетравлення вуглеводів Амілази, Панкреатична, альфа-Амілаза, Дисахаридази та олігосахаридази — ферменти, що синтезуються в тонкій кишці і спричиняють розщеплення до моносахаридів відповідних цукрів, які утворюються як продукти дії амілаз або надходять до травного каналу в складі рослинних продуктів харчування: мальтаза сахараза Внаслідок дії зазначених глікозидазних ферментів на рослинні та тваринні вуглеводи продуктів харчування утворюється суміш моносахаридів (в основному глюкози, фруктози й галактози), які всмоктуються клітинами кишкового епітелію і поступають у кров. Гідроліз фосфоліпідів (гліцерофосфоліпідів) каталізується фосфоліпазою А2, розщеплюють гліцерофосфоліпіди до гліцерину, вищих жирних кислот, азотистих основ та фосфорної кислоти: Гідроліз ефірів холестерину холестеролестерази (гідролази холестерилових ефірів) з утворенням холестеролу, який всмоктуєтьсяентероцитами у вільній формі. Синтез гема Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и. В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах - для образования цитохрома Р450. Первая реакция синтеза гема - образование 5-аминолевулиновой кислоты из глицина и сук-цинил-КоА идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции - сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты молекулу порфобилиногена, дезаминирование порфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходять заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX - в Протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентное железо, превращает его в гем. Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится. Вторинні месенджери та їх роль в механізмах гормонального впливу на клітини-мішені Сигнал на подальше включення каскаду біохімічних реакцій передається вторинними посередниками, або месенджерами — біомолекулами, що передають інформацію від гормону (первинного месенджеру) на ефекторні системи клітини. До вторинних месенджерів належать: циклічні нуклеотиди — циклічний аденозинмонофосфат (3',5'-АМФ; цАМФ) і циклічний гуанозинмонофосфат (3',5'-ГМФ, цГМФ), фосфоінозитиди та іони Са2+. Зростання внутрішньоклітинної (цитозольної) концентрації зазначених вторинних посередників здійснюється шляхом: (1) активації аденілатциклази, що утворює циклічний АМФ; (2) активації гуанілатциклази, що утворює циклічний ГМФ; (3) активації фосфоліпази С, що призводить до включення фосфоінозитидного каскаду — механізму мобілізації внутрішньоклітинного Са2+; (4) надходження Са2+ з екстрацелюлярного простору за рахунок відкриття кальцієвих каналів на плазматичній мембрані (механізм, більш притаманний іонотропним рецепторам). ефекторними механізмами, які реалізують трансформацію гормонального (регуляторного сигналу) через систему вторинних посередників у послідовність специфічних біохімічних реакцій клітини, є: (1) цАМФ-залежне фосфорилювання ферментних білків (здійснюється через цАМФ-залежні протеїнкінази); (2) цГМФ-залежне фосфорилювання ферментних білків (здійснюється через цГМФ-залежні протеїнкінази); (3) Са2+/кальмодулінзалежне фосфорилювання ферментних білків (здійснюється Са/кальмодулін-залежними протеїнкіназами); (4) Са2+/фосфоліпідзалежне фосфорилювання ферментних білків (здійснюється Cа/фосфоліпідзалежними протеїнкіназами); (5) фосфорилювання ферментних білків через тирозинзалежні кінази; Білет 2 Білет3 Розпад гема 1. Розрив тетрапірольного кільця гему (у складі гемоглобіну) шляхом окислювального розщеплення метинового містка між І та II кільцями протопорфіринового циклу; в результаті реакції червоний пігмент еритроцитів гемоглобін перетворюється на зелений кров'яний пігмент вердоглобін (холеглобін). Реакція каталізується ферментом НАДФН-залежною гемоксигеназою і супроводжується виділенням монооксиду вуглецю. Перетворення гемоглобіну на вердоглобін внаслідок окислення гему спричиняє послідовну зміну забарвлення в ділянках гематом, що утворюють "синці" 2. Розпад вердоглобіну з відщепленням білкової частини, вивільненням іона заліза та утворенням тетрапірольної молекули білівердину. 3. Перетворення білівердину на білірубін шляхом відновлення метинового зв'язку між піроламиIII, IV. Реакція каталізується ферментом НАДФН-залежною білівер- динредуктазою 4. Зазначені етапи утворення жовчних пігментів (1-3) відбуваються в клітинах ретикулоендотеліальної системи, з яких білірубін надходить у кров, де адсорбується молекулами сироваткового альбуміну. Комплекс "сироватковий альбумін - білірубін" транспортується в печінку, де пігмент поглинається гепатоцитами і підлягає подальшим перетворенням. 5. Білірубін є ліпідорозчинною речовиною і у високих концентраціях проявляє мембранотоксичність, особливо щодо клітин головного мозку. Детоксикація білірубіну, яка полягає в перетворенні пігменту у водорозчинну (і менш токсичну) форму - глю- куронід білірубіну, відбувається в мембранах ендоплазматичного ретикулуму гепатоцитів. У процесі взаємодії білірубіну з УДФ-глюкуроновою кислотою (УДФГК) утворюються моно- та диглюкуроніди білірубіну: Реакція каталізується УДФ-глюкуронілтрансферазою. Основна частина білірубіну екскретується в жовч у формі диглюкуронідів; Білет4. Обтураційна жовтяниця Післяпечінкова (обтураційна) жовтяниця — спричиняється неможливістю надходження жовчі у дванадцятипалу кишку внаслідок закупорки жовчних шляхів. знебарвленням калових мас внаслідок відсутності в них стеркобіліногену та стеркобіліну ("ахолічний" кал) і цілковитою відсутністю уробіліну в сечі. Білет 5 Види жовтяниць Причинами виникнення гіпербілірубінемії і розвитку жовтяниць є надмірне утворення білірубіну в організмі, пошкодження печінки з порушенням її детоксикаційної та екскреторної функцій або наявність механічних перешкод у системі жовчовивідних шляхів, що протидіють нормальному виведенню жовчі в кишечник. Розрізняють кілька типів жовтяниць. Передпечінкова {гемолітична) жовтяниця — розвивається внаслідок патологічно підсиленого руйнування (гемолізу) еритроцитів та розщеплення гемоглобіну і надмірного накопичення в крові білірубіну. Причинами такого стану можуть бути резус-конфлікт у новонароджених, переливання несумісної крові, радіаційне ураження, дія гемотоксичних отрут. збільшення концентрації в крові загального білірубіну, переважно за рахунок непрямої фракції Печінкова {паренхіматозна) жовтяниця — розвивається внаслідок порушення структури та ферментативних властивостей гепатоцитів в результаті дії пошкоджуючих факторів вірусного, бактеріального, хімічного походження. значна гіпербілірубінемія (збільшення концентрації загального білірубіну) Зростання в крові прямого білірубіну Післяпечінкова (обтураційна) жовтяниця — спричиняється неможливістю надходження жовчі у дванадцятипалу кишку внаслідок закупорки жовчних шляхів. знебарвленням калових мас внаслідок відсутності в них стеркобіліногену та стеркобіліну ("ахолічний" кал) і цілковитою відсутністю уробіліну в сечі. Ферментативні (спадкові) жовтяниці - виникають внаслідок генетичних ен- зимопатій, що спричинені порушеннями експресії генів, які відповідають за синтез у гепатоцитах ферментів кон'югації білірубіну його абсорбції з крові або екскреції в жовч. 3. Вітаміни – органічні харчові речовини (ну-и-ну, даже стихами говорят) Вітаміни - біоорганічні сполуки, що є життєво необхідними компонентами обміну речовин; вітаміни не синтезуються в організмі людини як інші біомолекули, а надходять з компонентами харчування. На відміну від таких поживних речовин, як вуглеводи, ліпіди та білки, вітаміни належать до мікрокомпонентів харчування: їх добові потреби для людини складають міліграмові або мікрограмові кількості. Водорозчинні вітаміни Вітамін В] (тіамін; антиневритний вітамін). Вітамін В2 (рибофлавін). Вітамін РР (вітамін В а ніацин; антипелагричний вітамін). Вітамін В6 (піридоксин; антидерматитний вітамін). Вітамін Вп (кобаламін; антианемічний вітамін). Фолієва кислота (птероїлглутамат; антианемічний вітамін). Вітамін Н(біотин; антисеборейний вітамін). Пантотенова кислота (вітамін EL; антидерматитний вітамін). Вітамін С (аскорбінова кислота). Вітамін Р (вітамін проникності). Жиророзчинні вітаміни Вітамін А (ретинол; аксерофтол; вітамін росту). Вітамін К (філохінон; антигеморагічний вітамін). Вітамін Е (а-токоферол; вітамін розмноження). Вітамін F (комплекс поліненасичених жирних кислот). Вітамін D (кальциферол; антирахітний вітамін). Вітамінна недостатність - стан, що розвивається внаслідок зменшення (або відсутності) певного вітаміну в організмі. Вітамінна недостатність супроводжується важкими розладами біохімічних та фізіологічних процесів і виникненням специфічної патології. Схема синтезу ІМФ (1) взаємодія а-0-рибозо-5-фосфату з АТФ з утворенням 5-фосфорибозил-1-піро- фосфату (ФРПФ); (2) взаємодія ФРПФ із глутаміном з утворенням 5-фосфорибозиламіну; (3) взаємодія 5-фосфорибозиламіну з гліцином з утворенням гліцинамід-рибозил-5- фосфату (ГАР); о (4) взаємодія ГАР з активною формою форміату (—С—Н) (К5,К10-метеніл-Н4-фо- латом) з утворенням форміл-ГАР; (5) взаємодія форміл-ГАР з глутаміном (донором аміногрупи) з утворенням форміл- гліцинамідин-рибозил-5-фосфату(форміл-ГАМ); (6) взаємодія форміл-ГАМ з АТФ із замиканням імідазольного кільця, тобто утворенням сполуки, що містить п'ятичленне кільце пуринового циклу - аміноімідазол- рибозил-5-фосфату (АІР); (7) карбоксилування АІР з утворенням аміноімідазолкарбоксилат-рибозил-5-фос- фату (АІКР); (8) взаємодія АІКР із аспартатом (донором аміногрупи) з утворенням проміжної сполуки - аміноімідазолсукцинілкарбоксамід-рибозил-5-фосфату (АІСКР); (9) розщеплення АІСКР з елімінацією фумарату та утворенням аміноімідазолкарбо- ксамід-рибозил-5-фосфату (АІКАР); О (10) форматування АІКАР за рахунок (—С—Н)-групи №°-форміл-Н4-фолату з утворенням формамідоімідазолкарбоксамід-рибозил-5-фосфату (ФАІКАР); (11) дегідратація та циклізація ФАІКАР з утворенням першого пуринового нуклео- тиду - інозинмонофосфорної (інозинової) кислоти, (ІМФ). \Білет 6 Білет 7 Розпад гема. 1. Розрив тетрапірольного кільця гему (у складі гемоглобіну) шляхом окислювального розщеплення метинового містка між І та II кільцями протопорфіринового циклу; в результаті реакції червоний пігмент еритроцитів гемоглобін перетворюється на зелений кров'яний пігмент вердоглобін (холеглобін). Реакція каталізується ферментом НАДФН-залежною гемоксигеназою і супроводжується виділенням монооксиду вуглецю. Перетворення гемоглобіну на вердоглобін внаслідок окислення гему спричиняє послідовну зміну забарвлення в ділянках гематом, що утворюють "синці" 2. Розпад вердоглобіну з відщепленням білкової частини, вивільненням іона заліза та утворенням тетрапірольної молекули білівердину. 3. Перетворення білівердину на білірубін шляхом відновлення метинового зв'язку між піроламиIII, IV. Реакція каталізується ферментом НАДФН-залежною білівер- динредуктазою 4. Зазначені етапи утворення жовчних пігментів (1-3) відбуваються в клітинах ретикулоендотеліальної системи, з яких білірубін надходить у кров, де адсорбується молекулами сироваткового альбуміну. Комплекс "сироватковий альбумін - білірубін" транспортується в печінку, де пігмент поглинається гепатоцитами і підлягає подальшим перетворенням. 5. Білірубін є ліпідорозчинною речовиною і у високих концентраціях проявляє мембранотоксичність, особливо щодо клітин головного мозку. Детоксикація білірубіну, яка полягає в перетворенні пігменту у водорозчинну (і менш токсичну) форму - глю- куронід білірубіну, відбувається в мембранах ендоплазматичного ретикулуму гепатоцитів. У процесі взаємодії білірубіну з УДФ-глюкуроновою кислотою (УДФГК) утворюються моно- та диглюкуроніди білірубіну: Реакція каталізується УДФ-глюкуронілтрансферазою. Основна частина білірубіну екскретується в жовч у формі диглюкуронідів; Білет 8 Гормони гіпофіза Передня частка гіпофіза (аденогіпофіз) продукує значну кількість гормонів, які стимулюють фізіологічні та біохімічні процеси в різних тканинах-мішенях, у тому числі активують дію інших ендокринних залоз (тропна функція гіпофізарних гормонів). Виходячи з особливостей молекулярної генетики, біосинтезу та структурно-функціональних властивостей, гормони аденогіпофіза утворюють три групи: I група - "гормон росту-пролактин-хоріонічний соматомамотропін"; II група - глікопротеїни - "тропні гормони гіпофіза"; III група - похідні "проопіомеланокортину" 1. Гормон росту (соматотропін, соматотропний гормон, СТГ) - простий білок, що складається з одного поліпептидного ланцюга. Головна функція СТГ - стимуляція постнатального росту організму; ця складна біологічна функція реалізується за рахунок різноманітного спектра впливу гормону на біосинтез білка, вуглеводний та ліпідний метаболізм. 2. Пролактин (лактогенний гормон, мамотропін, лютеотропний гормон) - простий білок, що складається з одного поліпептидного ланцюга. 3. Хоріонічний соматомамотропін {ХС; плацентарний лактоген) -гормон, що проявляє лактогенну та лютеотропну активності, а за метаболічними ефектами близький до соматотропіну. 2. включає в себе сполуки глікопротеїнової природи: тиреотропний та гонадотропний гормони гіпофіза і плаценти. Тиреотропний гормон (ТТГ; тиротропін) - подібно до інших глікопротеїнових гормонів гіпофіза є димером типу альфа-бета. Основна біологічна функція ТТГ - підтримка функціональної активності (синтезу тиреоїдних гормонів) та структури щитовидної залози. Гонадотропні гормони: 1. Фолікулостимулюючий гормон {ФСГ; фолітропін) — білок з м.м. 33 кДа. Мішенями для ФСГ є фолікулярні клітини яєчників та клітини Сертолі сім'яників. Передача хімічного сигналу при дії ФСГ здійснюється за рахунок активації аденілатциклази. 2. Лютеїнізуючий гормон (ЛГ; лютропін; гормон, що стимулює інтерстиці- альні клітини Лейдига - ГСІК) - білок з м.м. 29 кДа. Рецептори для ЛГ локалізовані на плазматичних мембранах клітин яєчників (у жіночому організмі) та клітин Лейдига сім'яників (у чоловічому організмі). Як і в разі ФСГ, вторинним месендже- ром у дії ЛГ на ефекторні системи клітин є цАМФ. 3. Хоріонічний гонадотропін (ХГ) - білок з м.м. близько 37 кДа; синтезується трофобластом плаценти. Біологічна роль гонадотропінів полягає в регуляції функцій статевої сфери людини як в препубертатному та пубертатному періодах, так і у дорослих особин, процесів як гаметогенезу, так і продукції статевих гормонів. 3. Адренокортикотропний гормон (АКТГ; кортикотропін) - одноланцюговий пептид, що складається з 39 амінокислотних залишків (м.м. 4,5 кДа). Головними мішенями АКТГ є клітини кори надниркових залоз, відносно яких гормон проявляє два типи біологічної активності: стимуляцію стероїдогенезу та підтримання маси надниркових залоз. 2. Ліпотропний гормон (ЛПГ; ліпотропін) - група пептидів, що мають властивості активувати ліполіз в адипоцитах жирової тканини і мобілізацію жирних кислот. 3. Ендорфіни - представники групи опіоїдних нейропептидів (а-, (3-, у- та д-ендорфіни), що виконують функції нейромедіаторів, ендогенних знеболювальних факторів та модуляторів певних важливих психофізіологічних процесів у пептидергіч- них структурах головного мозку (розділ 33). 4. Меланоцитостимулюючий гормон (МСГ) — група пептидів (а-, Р-, у-МСГ), які продукуються у проміжній частці гіпофіза і стимулюють функціональну активність меланоцитів шкіри, збільшуючи її пігментацію. Гормони задньої частки гіпофіза – вазопресин і окситоцин. Накопичуються, у нейрогіпофізі. Впливають на нирки. Розпад гема 3-1 Жиророзчинні вітаміни Вітамін А (ретинол; аксерофтол; вітамін росту). Вітамін К (філохінон; антигеморагічний вітамін). Вітамін Е (а-токоферол; вітамін розмноження). Вітамін F (комплекс поліненасичених жирних кислот). Вітамін D (кальциферол; антирахітний вітамін). РИСУНОК 4-5 Білет 9. Білет 10 Білет 11 Білет 12 Білет 13 Білет 14 Білет 15 Травлення в шлунку. Перетравлювання білків у порожнині шлунка Шлунковий сік, під дією якого відбувається гідроліз білків, - це кисла рідина з рН 1,5-2,5. Основними біохімічними компонентами шлункового соку, що беруть участь у перетворенні білків продуктів харчування, є соляна кислота та протеолітичний фермент пепсин. Крім того, до складу шлункового соку входять кислі фосфати (переважно NaH2P04) та деякі органічні кислоти, складаючи загальну кислотність шлунка. Соляна кислота виробляється у спеціальних обкладкових (рксинтних) клітинах слизової оболонки шлунка за участю хлоридів, які надходять із крові. Донором протонів, необхідних для утворення НС1, є вугільна кислота, що утворюється з Н20 та С02 за участю карбоангідрази: Секреція іонів Н+в порожнину шлунка відбувається при дії протонної помпи мембран оксинтних клітин - Н+, К+-АТФази (рис. 26.2). Концентрація НС1 у шлунковому соку складає 0,45-0,60 %. Соляна кислота необхідна для утворення активного ферменту пепсину і прояву максимуму його каталітичної активності. Пепсин - протеаза з м.м. 35 кДа, що синтезується головними клітинами слизової оболонки шлунка у вигляді проферменту пепсиногену (м.м. 42 кДа). Початкові етапи перетворення пепсиногену в пепсин здійснюються за участю іонів Н+, які сприяють відщепленню від молекули проферменту N-кінцевого захисного пептиду, що супроводжується розкриттям активного центру; в подальшому процес стає авто-каталітичним - молекули пепсину спричиняють власне утворення з проферменту: За механізмом дії пепсин є ендопептидазою, що специфічно атакує пептидні зв'язки, в утворенні яких беруть участь залишки ароматичних (фенілаланіну, тирозину), а також дикарбонових (глутамату, аспартату) амінокислот. Під дією пепсину білки розщеплюються на великі поліпептидні фрагменти - пептони, гідроліз яких завершується в тонкій кишці. Рєпнін {хімозин, сичужний фермент) — протеаза, що міститься в шлунковому соку новонароджених дітей. Реннін є ферментом, який за участю іонів Са2+ спричиняє перетворення розчинних білків молока (казеїнів) у нерозчинні (параказеїни), які підлягають протеолітичній дії пепсину ("звурдження молока"). Білет 16. Ліпіди ЦНС Ліпіди нервової тканини Своєрідність хімічного складу нервової тканини і головного мозку полягає у надзвичайно високому вмісті ліпідів різноманітної хімічної структури. Сума ліпідів різних класів складає в середньому близько половини сухої маси тканини головного мозку. Особливостями хімічного складу ліпідів головного мозку є переважання складних полярних ліпідів (гліцерофосфоліпідів, сфінголіпідів, гліколіпідів) і холестерину при незначній кількості триацилгліцеролів. До того ж вміст ліпідів у білій речовині головного мозку значно вищий, ніж у сірій речовині, що пояснюється наявністю в останній структурі значної кількості мієлінових оболонок нервів Антибіотики
(1) інгібітори ініціації: стрептоміцин, ауринтрикарбоксилова кислота; (2) інгібітори елонгації: аміцетин, хлорамфенікол, еритроміцин, циклогекси- мід, пуроміцин, тетрацикліни; (3) інгібітори термінації: анізоміцин, хлорамфенікол, еритроміцин, лінкоцин, стрептоміцин. Антибіотики, що є інгібіторами процесів трансляції у прокаріотів, застосовуються як антибактеріальні лікарські засоби в терапії інфекційних хвороб та інших захворювань, що спричинені мікробним фактором. Антибіотики, які інгібують трансляцію в еукаріотичних клітинах вищих організмів, зокрема ссавців, застосовуються як протипухлинні засоби. Гальмуючи біосинтез білка в клітинах злоякісних пухлин, ці антибіотики спричиняють регресію росту пухлини. Сполучна тканина Сполучна тканина - це комплекс спеціалізованих клітин, волокон та основної речовини, що утворює внутрішнє середовище та інтегрує між собою інші клітини і тканинні елементи в єдиний багатоклітинний організм людини і тварин. Головними фізіологічними функціями сполучної тканини є: - опорна (механічна) функція; - захисна функція; - трофічна та транспортна функція; - регуляторна функція. Залежно від особливостей структурної організації та функцій, виділяють декілька типів сполучної тканини, а саме: - волокнисті сполучні тканини, які у свою чергу підрозділяють на пухку волокнисту сполучну тканину та компактну (щільну) волокнисту сполучну тканину; - скелетні сполучні тканини (суглобові та кісткові); - сполучні тканини із спеціальними властивостями. Волокнисті сполучні тканини є типовими представниками групи сполучних тканин, що їх називають також "власне сполучними тканинами".У свою чергу, найбільш поширеним видом волокнистих сполучних тканин є пухка волокниста сполучна тканина, яка має найбільш характерну для всіх типів сполучних тканин будову. Структурними компонентами сполучних тканин (волокнистих сполучних тканин) є: 1) клітини, що виконують різноманітні захисні, трофічні, регуляторні функції. До них належать: фібробласти з різним ступенем диференціювання, макрофаги (гістіоци- ти), опасисті клітини (тканинні базофіли), плазматичні клітини, різні типи лейкоцитів. 2) волокна - структурні утворення білкової природи, що формують міжклітинну сітку в сполучній тканині. Вони підрозділяються на: - колагенові волокна; -ретикулярні волокна; - еластичні волокна. 3) основна аморфна речовина, що заповнює проміжки між волокнистими компонентами та клітинами. За хімічною природою основна аморфна речовина являє собою складні білки та глікокон'югати - протеоглікани та структурні глікопротеїни. Волокна та основна аморфна речовина складають у сукупності міжклітинну речовину волокнистої сполучної тканини. Пухка волокниста сполучна тканина відрізняється від і^ідьноі'відносно більшим об'ємом основної аморфної речовини, меншою кількістю волокон та різноманітнішим клітинним складом
Білет 1 Функції печінки 100% синтез альбумінів, 98% синтез альфа-2-глобулінів, фактори згортання крові, перетворення феніл-аланіну, цикл Корі (молочна кислота – глюкоза), глюконеогенез, клюкокіназа (забирає з крові альфа-Д-глюкозу), синтез глікогену, перетворення фруктози і галактози на глюкозу, активація вітаміну Д, дезамінування (аспартат- і аланін-амінотрансферази), синтез сечовини і креатину, розподіл глюкози, формування ліпідів низької щільності (холестерол в клітину), синтез фосфоліпідів, жовчних кислот, вуглеводний і ліпідний обмін, дає глюкозу для живлення головного мозку, пентозофосфатний шлях=НАДФН2, мікросомальне окислення ксенобіотиків, виводить ксенобіотики, запас вітамінів (крім С) Панкреатичне і кишкове травлення. Роль жовчі в механізмі травлення Перетравлення поживних речовин (білків, вуглеводів, ліпідів) — це процес гідролізу відповідних сполук у складі продуктів харчування, що відбувається в травному каналі і призводить до утворення простих біомолекул, які за рахунок дії спеціальних механізмів мембранного транспорту всмоктуються у кров. кишечник (залози Брунерата Ліберкюна) синтезує деякі пептидази, дисахаридази, фосфоліпази та полінуклеотидази. Травлення в кишечнику неможливе без участі гідролітичних ферментів, які надходять сюди з підшлункової залози — протеаз (трипсину, хімотрипсину, еластази), карбоксипептидази, амілаз, ліпаз. У процесі травлення жирів беруть участь біохімічні компоненти жовчі, що синтезуються в гепатоцитах печінки. Перетравлення білків протеолітичні ферменти та пептидази, які діють на пептиди, що надходять зі шлунка. Каталітична дія цих ферментів відбувається в слабколужному середовищі (рН 7,5-8,0) Більшість ферментів протеолітичної дії, що функціонують у тонкій кишці, синтезуються в екзокринних клітинах підшлункової залози у вигляді проферментів, які активуються після їх надходження в дванадцятипалу кишку (трипсиноген, хімотрипсиноген, проеластаза, прокарбоксипептидази А і В). Гідроліз білків та пептидів, що надходять із шлунка, відбувається як у порожнині тонкої кишки, так і на поверхні ентероцитів — пристінкове, або мембранне травлення. розщеплення білків та пептидів продуктів харчування до амінокислот. У кровотік слизовою оболонкою кишечника всмоктуються тільки вільні амінокислоти. Перетравлення вуглеводів Амілази, Панкреатична, альфа-Амілаза, Дисахаридази та олігосахаридази — ферменти, що синтезуються в тонкій кишці і спричиняють розщеплення до моносахаридів відповідних цукрів, які утворюються як продукти дії амілаз або надходять до травного каналу в складі рослинних продуктів харчування: мальтаза сахараза Внаслідок дії зазначених глікозидазних ферментів на рослинні та тваринні вуглеводи продуктів харчування утворюється суміш моносахаридів (в основному глюкози, фруктози й галактози), які всмоктуються клітинами кишкового епітелію і поступають у кров. Гідроліз фосфоліпідів (гліцерофосфоліпідів) каталізується фосфоліпазою А2, розщеплюють гліцерофосфоліпіди до гліцерину, вищих жирних кислот, азотистих основ та фосфорної кислоти: Гідроліз ефірів холестерину холестеролестерази (гідролази холестерилових ефірів) з утворенням холестеролу, який всмоктуєтьсяентероцитами у вільній формі. Синтез гема Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и. В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах - для образования цитохрома Р450. Первая реакция синтеза гема - образование 5-аминолевулиновой кислоты из глицина и сук-цинил-КоА идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции - сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты молекулу порфобилиногена, дезаминирование порфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходять заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX - в Протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентное железо, превращает его в гем. Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится.
|
||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 216; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.013 с.) |

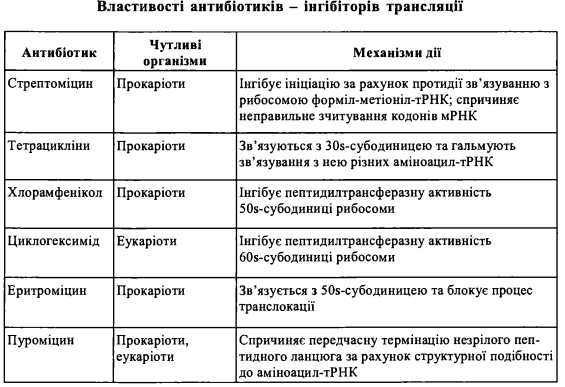 1. У клінічній практиці, а також в експериментальній біології і медицині, знайшли широке застосування антибіотики, що є інгібіторами біосинтезу білка у прока- ріотичних та еукаріотичних організмів на різних етапах трансляції:
1. У клінічній практиці, а також в експериментальній біології і медицині, знайшли широке застосування антибіотики, що є інгібіторами біосинтезу білка у прока- ріотичних та еукаріотичних організмів на різних етапах трансляції:


