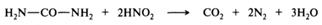Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ацетоуксусный эфир: строение, таутомерия; синтез карбоновых кислот и кетонов.Содержание книги
Поиск на нашем сайте Алкилирование эфиров β-оксокарбоновых кислот. Как уже упоминалось, эфиры β-оксокарбоновых кислот обладают довольно сильными кислотными свойствами, например, рКа ацетоуксусного эфира составляет 10,65. Анионы солей ацетоуксусного и других эфиров β-оксокислот стабилизированы за счет сопряжения, отрицательный заряд делокализуется в них при участии атомов кислорода двух карбонильных групп:
Ацетоуксусный эфир имеет 2 СН-кислотных центра => в молекулу могут быть введены 2 алкильных радикала. Анионы солей ацетоуксусного и других эфиров β-оксокислот вследствие делокализации отрицательного заряда в сопряженной системе представляют собой амбидентные нуклеофилы (два нуклеофильных центра: α-атом углерода и атом кислорода кетонной группы). Кислотное расщепление. Ацетоуксусный эфир и его алкильные производные при действии концентрированных спиртовых растворов щелочи подвергаются так называемому кислотному расщеплению, приводящему к образованию сложных эфиров замещенных уксусных кислот. Гидролиз сложного эфира обычно осуществляют в кислой среде:
Декарбоксилирование. Декарбоксилирование является этапом так называемого кетонного расщепления замещенных ацетоуксусных эфиров с целью получения метилкетонов. Процедура включает в себя щелочной гидролиз сложного эфира β-оксокислоты и декарбоксилирование образовавшейся оксокислоты после подкисления реакционной смеси:
Из приведенных примеров видно, что ацетоуксусный эфир является удобным синтетическим предшественником алифатических карбоновых кислот и метилкетонов. При планировании синтеза какой-либо карбоновой кислоты или метилкетона исходят из того, что от молекулы ацетоуксусного эфира в результате кетонного расщепления в структуре соответствующего кетона останется фрагмент ацетона, а в результате кислотного расщепления в молекуле образовавшейся карбоновой кислоты — остаток уксусной кислоты.
59. Функциональные производные угольной кислоты: фосген, эфиры карбаминовой кислоты; карбамид (мочевина) – гидролиз, взаимодействие с азотистой кислотой и гипобромитами, образование биурета, биуретовая реакция; основные свойства гуанидина. Угольная кислота традиционно не относится к органическим соединениям, но она сама и ее функциональные производные имеют определенное сходство с карбоновыми кислотами и их производными, поэтому и рассматриваются в настоящей главе. Двухосновная угольная кислота — неустойчивое соединение, легко распадается на диоксид углерода и воду. В водном растворе углекислого газа лишь 0,1% его существует в виде угольной кислоты. Угольная кислота образует два ряда функциональных производных — полные (средние) и неполные (кислые). Кислые эфиры, амиды и другие производные нестабильны и разлагаются с выделением диоксида углерода:
Хлорангидриды. Полный хлорангидрид угольной кислоты — фосген СОС12 — низкокипящая жидкость с запахом прелого сена, очень ядовит, вызывает отек легких, образуется в качестве вредной примеси при фотохимическом окислении хлороформа в результате неправильного хранения последнего. В промышленности фосген получают радикальным хлорированием оксида углерода(Н) в реакторе, заполненном активированным углем:
Фосген, подобно хлорангидридам карбоновых кислот, обладает высокой ацилирующей способностью, из него получают многие другие функциональные производные угольной кислоты. При взаимодействии фосгена со спиртами образуются сложные эфиры двух типов — полные (карбонаты) и неполные (хлороугольные эфиры, или хлороформиаты), последние одновременно являются и сложными эфирами, и хлорангидридами.
С гликолями и пирокатехином фосген образует циклические эфиры, используемые в качестве защитных групп. Для ацилирования фенолов часто применяют метод Шоттена—Баумана, например:
Карбоновые кислоты под действием фосгена превращаются в соответствующие хлорангидриды:
Амиды. Угольная кислота образует два ряда амидов — кислые (карбаминовая кислота и ее производные) и средние (мочевина и ее производные). Карбаминовая кислота — неполный амид угольной кислоты — неустойчивое соединение, распадается с образованием аммиака и диоксида углерода:
Эфиры карбаминовой кислоты — карбаматы, или уретаны, — устойчивые соединения, получаемые в результате присоединения спиртов к изоцианатам или ацилированием аммиака и аминов соответствующим хлороформиатом:
N-Замещенные карбаматы широко используются в качестве пестицидов. Некоторые карбаматы нашли применение в медицине как лекарственные средства. Широкое практическое применение имеют полиуретаны — высокомолекулярные соединения, образующиеся при взаимодействии полифункциональных изоцианатов с многоатомными спиртами. Получаемый при этом сшитый полимер применяют в основном в виде разнообразных пенопластов. Мочевина (карбамид) — полный амид угольной кислоты — важнейший конечный продукт белкового обмена у млекопитающих; взрослый человек выделяет в сутки 25—30 г мочевины. Мочевина — крупнотоннажный продукт (мировое производство более 100 млн т/год), используется в основном как азотное удобрение, значительныеьколичества мочевины идут на получение мочевиноформальдегидных смол. В фармацевтической промышленности мочевину используют для получения барбитуратов. Мочевина обладает слабыми основными свойствами, образует соли с сильными кислотами. Соли азотной и щавелевой кислот нерастворимы в воде.
Мочевина протонируется по атому кислорода, а не азота. Это, вероятно, связано с делокализацией неподеленных пар электронов атомов азота за счет р,π-сопряжения. В кипящей воде мочевина гидролизуется с образованием аммиака и диоксида углерода; кислоты и основания катализируют эту реакцию:
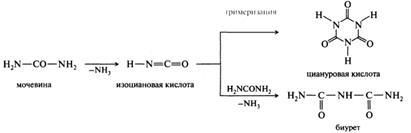
Первичными продуктами, образующимися при нагревании мочевины, являются аммиак и изоциановая кислота. Изоциановая кислота может тримеризоваться в циануровую кислоту или конденсироваться со второй молекулой мочевины с образованием биурета. В зависимости от скорости нагрева доминирует тот или иной путь разложения мочевины:
С гидроксидом меди(II) в щелочной среде биурет образует хелатный комплекс красно-фиолетового цвета (моделирует качественная реакция на белки).
При взаимодействии мочевины с азотистой кислотой образуются диоксид углерода, азот и вода. Реакция применяется для удаления избытка азотистой кислоты при проведении реакций диазотирования и нитрозирования:
Действие гипогалогенитов также приводит к разложению мочевины. В зависимости от условий могут образовываться азот или гидразин; последний именно так получают в промышленности:
Гуанидин. Гуанидин, или иминомочевину (H2N)2C=NH, в промышленности получают сплавлением мочевины с нитратом аммония или при нагревании эфиров ортоугольной кислоты с аммиаком. Гуанидин — бесцветное кристаллическое вещество (т. пл. 50 °С), обладает сильными основными свойствами. Высокая основность на уровне гидроксидов щелочных металлов обусловлена полной делокализацией положительного заряда в симметричном катионе гуанидиния:
Остатки гуанидина и бигуанидина содержатся в некоторых природных соединениях и лекарственных веществах.
60. Сульфокислоты: номенклатура; кислотные свойства, образование солей; функциональные производные: эфиры, амиды, хлорангидриды. Реакции десульфирования и замещения сульфогруппы в ароматических сульфокислотах. Сульфоновыми кислотами называются сероорганичсские соединении общей формулы RSО3Н. Сульфоновые кислоты (сульфокислоты) имеют сходство с карбоновыми кислотами, обладают кислотными свойствами, образуют производные тех же типов, что и карбоновые кислоты. Сульфоновые кислоты представляют собой кристаллические вещества, часто гигроскопические, хорошо растворимые в воде. В органическом синтезе, например при получении красителей, введение сульфогруппы в структуру соединений используется для повышения их растворимости в воде. Химические свойства. Сульфоновые кислоты обладают высокой кислотностью, они сравнимы с серной кислотой и даже превосходят ее (например, трифторометансульфоновая кислота CF3SО3H). Атом серы в сульфокислотах и их производных имеет тетраэдрическую конфигурацию. В анионах сульфоновых кислот заряд делокализован при участии трех атомов кислорода, т. е. более полно, чем в анионах карбоновых кислот. Ниже приведены геометрические параметры бензолсульфонат-иона и резонансные структуры, демонстрирующие делокализацию заряда:
Как слабые, так и сильные основания образуют с сульфокислотами соли, называемые сульфонатами:
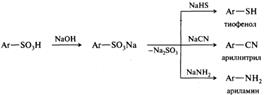
Сульфонаты бария и свинца в отличие от сульфатов хорошо растворимы в воде, это их свойство используется при очистке полученных в результате сульфирования ароматических сульфоновых кислот. Под действием перегретого водяного пара сульфоновые кислоты подвергаются десульфированию:
Возможность удаления сульфогруппы используется в препаративной органической химии для защиты определенных положений бензольного кольца, что можно проиллюстрировать на примере синтеза 2,6-динитроанилина:
Сульфогруппа из ароматического кольца может быть удалена также при действии нуклеофилов, при этом степень окисления серы понижается. Кроме упоминавшегося ранее способа получения фенолов, с помощью реакций этого типа получают тиофенолы, амины и др.:
Сульфонилхлориды. Сульфонилхлориды синтезируют из сульфоновых кислот или их солей теми же методами, что и хлорангидриды карбоновых кислот:
Кроме того, арилсульфонилхлориды могут быть получены прямым сульфированием ароматического кольца хлорсульфоновой кислотой. В качестве побочных продуктов в этой реакции образуются диарилсульфоны:
Химические свойства. Из сульфонилхлоридов в результате нуклеофильного замещения у атома серы получают различные функциональные производные сульфоновых кислот, наиболее значимы из которых сульфонаты (сложные эфиры) и сулъфонамиды (амиды). Сульфонаты образуются в реакциях сульфонилхлоридов со спиртами. При получении сульфонатов в качестве акцептора хлороводорода и нуклеофильного катализатора используют пиридин:
Сульфонамиды образуются при взаимодействии сульфонилхлоридов с аммиаком или аминами:
При восстановлении сульфонилхлоридов образуются тиолы или тиофенолы, например:
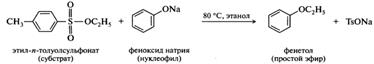
Эфиры сульфоновых кислот. Эфиры сульфоновых кислот используют в органическом синтезе в качестве субстратов в реакциях нуклеофильного замещения. Как уже упоминалось, сульфоновые кислоты обладают высокой кислотностью, поэтому их анионы, будучи стабильными, являются хорошими уходящими группами в реакциях нуклеофильного замещения. Алкильный радикал эфира должен быть первичным или вторичным, поскольку сульфонаты третичных спиртов труднодоступны и малоустойчивы (подвергаются элиминированию). Приведенный ниже пример показывает, что из алкилсульфонатов можно получать соединения практически тех же классов, что и из алкилгалогенидов. Например, при взаимодействии этил-п-толуолсульфоната с феноксидом натрия образуется простой эфир фенола:
Сульфонамиды. Существуют сульфонамиды трех типов: незамещенные, монозамещенные и дизамещенные, которые следует рассматривать как сульфонильные производные соответственно аммиака, первичных и вторичных аминов:
Атом серы в молекулах сульфонамидов, как и в сульфоновых кислотах и их солях, имеет тетраэдрическую конфигурацию. Ниже приведены геометрические параметры метансульфонамида:
Сульфонамиды представляют собой кристаллические вещества с довольно высокими и четкими температурами плавления, поэтому их получают в аналитических целях для идентификации соответствующих сульфоновых кислот. Сульфонамиды гидролизуются в жестких условиях в кислой или щелочной среде с образованием аммиака или аминов и сульфоновой кислоты. В отличие от сульфонатов, в которых при действии нуклеофилов расщепляется связь С—О, в сульфонамидах расщепляется связь S—N:
Незамещенные и монозамещенные сульфонамиды обладают NH-кислотными свойствами и образуют соли со щелочами:
На этой реакции основана проба Хинсберга, позволяющая различать первичные, вторичные и третичные амины, а также разделять их смеси (качественная реакция). С этой целью смесь аминов обрабатывают тозилхлоридом в присутствии щелочи, при этом первичные и вторичные амины образуют соответственно моно- и дизамещенные сульфонамиды, третичные амины в эту реакцию не вступают. Сульфонамид, образовавшийся из вторичного амина, нерастворим в щелочах и выпадает в осадок. Сульфонамид, полученный из первичного амина, остается в щелочном растворе в виде соли и выпадает в осадок после подкисления раствора.
Еще одним практически значимым производным сульфоновых кислот является сахарин, который представляет собой имид о-сульфобензойной кислоты. Сахарин в виде натриевой соли применяется в качестве подсластителя диетических пищевых продуктов; он в 500—600 раз слаще сахара и в неизмененном виде выводится с мочой из организма. 61. Сульфаниловая кислота: строение, биполярная структура; реакция диазотирования (вопр. 29); сульфаниламид (стрептоцид), общий принцип строения сульфаниламидных лекарственных препаратов. Аминосульфоновые кислоты. Из этой группы аминокислот наибольшее практическое значение имеет п-аминобензолсульфоновая (сульфаниловая) кислота, представляющая собой внутреннюю соль (хотя записывается обычно в виде неионизированного соединения):
Она обладает одновременно и кислотными, и основными свойствами, т. е. является амфотерной:
Реакции с азотистой кислотой – сульфаниловая кислота реагирует амино-группой. Амины разных типов с азотистой кислотой реагируют неодинаково. Некоторые продукты этих реакций, например соли диазония, имеют широкое практическое применение. Первичные ароматические амины. В результате реакции первичных ароматических аминов с азотистой кислотой при низких температурах в присутствии сильных минеральных кислот образуются соли арилдиазония, а сама реакция называется реакцией диазотирования:
Сульфаниламиды. Амид сульфаниловой кислоты — сульфаниламид (R=Н), известный под названием стрептоцид, является родоначальником огромного семейства химиотерапевтических антибактериальных средств.
За более чем полувековой период существования сульфаниламидных препаратов было синтезировано свыше 10 тыс. производных, отличающихся главным образом природой заместителя R в сульфонамидной группе. Реже модификации структуры затрагивали аминогруппу, связанную с бензольным кольцом. Несколько десятков сульфаниламидов применяются в медицине, и в большинстве из них заместитель R представлен различными гетероциклическими структурами. Сульфаниламиды плохо растворимы в воде, их растворимость повышается в щелочных средах благодаря наличию в молекуле NH-кислотного центра, обусловленного р,π-сопряжением в сульфанамидном фрагменте. Некоторые сульфаниламиды применяются в виде натриевых солей, например сульфацил-натрий. Сульфаниламиды относятся к лекарственным средствам, механизм действия которых достаточно изучен на молекулярном уровне. Полагают, что сульфаниламиды конкурируют с п-аминобензойной кислотой (благодаря подобию геометрических параметров их молекул) на стадии биосинтеза фолиевой кислоты и других веществ, необходимых для жизни и развития многих форм микроорганизмов. Иными словами, являются антиметаболитами ПАБК, и принцип их действия заключается в блокировании биохимических процессов связывания ПАБК, в результате чего нарушается рост и размножение микроорганизмов. Таким образом, сульфаниламиды действуют только на те виды микробов, которые самостоятельно производят фолиевую кислоту, и не действуют на микроорганизмы, утилизирующие кислоту в готовом виде.
|
||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 1584; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.013 с.) |